热重分析法对废旧电路板热解过程动力学和热力学分析
阳宇, 夏勇, 王君, 欧阳少波*, 熊道陵, 李立清
(1.江西理工大学材料冶金化学学部,江西 赣州 341000; 2.商洛学院化学工程与现代材料学院,陕西省尾矿资源综合利用重点实验室,陕西 商洛 726000)
电子产品行业的快速更新迭代和消费者对先进设备的强烈使用欲望,使得电子设备有着极高的报废率,电子废弃物目前已经成为一类增长速度极快的固体废弃物[1]。中国是电子产品最大消费国之一[2],电子废弃物产量也位居世界前列。与此同时,中国和非洲一些国家接受了世界上高达80%的电子垃圾,除对生态环境造成了极大破坏之外,还会危害人类生命健康[3]。近年来,中国对电子垃圾进行了严格管控,不仅将《废弃电器电子产品目录》中由原来5种增加到14种,同时也减少了废弃电子电气设备进口量[4]。废旧电路板(SPCB)是废弃电子电气设备中的关键组分,也是电子废弃物中最复杂、最难处理的重要部件[5]。据资料显示,2018年,全球共有4 850万吨废弃电子电器产品,然而其中仅有15%~20%得到了回收利用,而且电子电器废弃物的产生量会以年均8%的速度增长。我国每年产生40万吨SPCB,其中含有大量的贵金属,处理前景十分广阔[6]。
SPCB主要由玻璃纤维、含卤素的环氧树脂等有机高聚物以及金属材料(铁、铝、铜、金、银等)组成,有很高的回收利用价值[7]。目前,SPCB处理方法主要有湿法冶金、火法冶金、热解或几种方法相结合[8-9]。火法冶金会释放大量有毒成分,对环境造成严重危害;湿法冶金成本高、金属回收率慢[10]。热解法作为一种高效且环保的技术,在缺氧条件下废气产量少,对环境污染危害小,可以回收利用有机资源,并去除SPCB重污染物。相较其他方法,热解法操作简单、易于控制、效率高,在有机废弃物处理领域越来越得到关注,是一种很有前景的资源回收方法。尽管对于SPCB热解特性研究不尽相同,但主要采用热重分析方法(TGA)进行研究,对热失重数据进行动力学模型拟合,探讨其热解反应机理。王芳等[11]发现防溴型环氧树脂电路板热解主要集中在270~400 ℃,采用Flynn-Wall-Ozawa(FWO)模型和Kissinger-Akahira-Sunose (KAS)模型计算所得到活化能(Ea)分别为160.62 kJ/mol和166.39 kJ/mol。CAO等[12]以智能手机电路板为原料,采用DAEM法拟合,发现热解阶段Ea在98.29~177.59 kJ/mol之间。WU等[13]对不同粒径SPCB树脂粉在不同升温速率下研究其热解行为,发现热解区间发生在150~400 ℃,用KAS模型得到小粒径(<0.5 mm)和大粒径(0.5~0.9 mm)树脂粉的Ea分别为247.85 kJ/mol和178.83 kJ/mol;而FWO模型计算得到小粒径和大粒径树脂粉的Ea分别为215.059 kJ/mol和210.637 kJ/mol。ALENEZⅠ等[14]利用Friedman(FM)模型和FWO模型,对6个不同升温速率下的热失重数据进行拟合, 计算得到平均Ea均为110.2 kJ/mol。目前,国内外学者对SPCB热解特性展开了广泛的研究,但使用不同原料和模型所得动力学结果差异较大,且对SPCB热解过程热力学分析也相对较少。
基于以上原因,本文利用TGA技术,采用3种动力学模型(FWO模型、KAS模型和FM模型)对SPCB热解特性和反应机理进行系统地研究。FWO模型、KAS模型和FM模型都是典型的等转化率法,可以简化和避免与动力学模型选择有关的误差[15]。实验考察了不同升温速率对SPCB热失重特性曲线的影响规律,从动力学和热力学分析,探讨热解过程反应机理。为后续热解反应体系构建提供指导意义,同时,对其资源化利用具有重要的理论参考价值。
1 实验部分
1.1 实验原料及处理
实验所用原料来自江西赣州某废品回收厂提供的废旧电路板粉体,样品经进一步粉碎后,在105 °C烘箱中干燥12 h,之后放置在干燥器中备用。原料工业分析和元素分析结果见表1。由工业分析结果可知,样品含灰分高达59.02%,说明样品中无机组分含量相对较高;高位热值约为9.59 kJ/g,发热量较低;根据元素分析结果,其中C和O含量分别为55.25%和37.13%,含量相对较高,可能是与原料中含有大量环氧树脂有关。

表1 样品物化特征分析Table 1 Analysis of physical and chemical characteristics of samples
1.2 热重分析实验
热重分析实验在TG60系列差热-热重同步分析仪上进行,使用SPCB粉碎颗粒粒径d≤75 μm,每次称取样品质量约10 mg,由室温加热至800 ℃,升温速率分别为5、10、15 ℃/min,N2流速为75 mL/min。通过采集样品重量随温度、时间的变化数据,绘制出TG曲线和DTG曲线。
1.3 动力学模型
对SPCB主要热解阶段进行动力学计算,反应速率表达式通常如下:
式(1)、式(2)中:k为化学反应速率常数,遵循Arrhenius定律;f(a)为反应机理函数;a为转化率;t为反应时间。根据文献[16],可假设SPCB热解反应级数n=2,则f(a)=(1-a)2,F(a)=1/(1-a)。采用FWO模型、KAS模型和FM模型等转化率法[17-20],对热失重数据进行分析,其对应方程如下所示:
FWO模型:
KAS模型:
FM模型:
式(3)—式(5)中:A为指前因子;Ea为反应活化能;R为摩尔气体常数,取值8.314 J/(mol·K)计算;β为升温速率。
1.4 热力学参数计算
对于热解过程热力学参数,利用FWO模型等转化率法,A、焓变(ΔH)、吉布斯自由能变(ΔG)和熵变(ΔS)通过式(6)、式(7)、式(8)和式(9)得出[21-22]。
式(6)—式(9)中:Tm为DTG 曲线峰值温度;Ta为转化率a时所对应温度;KB为玻尔兹曼常数,取值1.381 ×10-23J/K;h为普朗克常数,取值6.626 ×10-34J·s。
2 结果与讨论
2.1 SPCB热解特性
不同升温速率下,SPCB热解特性曲线,TG曲线和DTG曲线如图1所示。
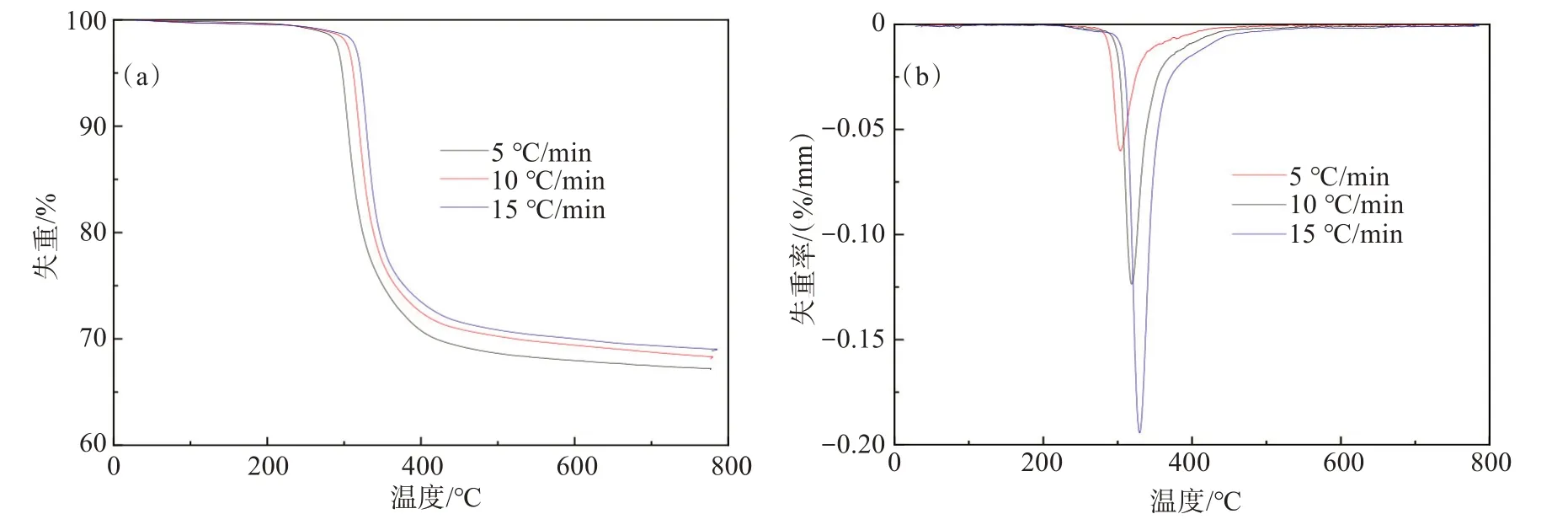
图1 SPCB热失重过程中TG(a)和DTG(b)曲线Fig.1 TG (a) and DTG (b) curves of SPCB
从图1(a)可以看出,SPCB热解过程可分为3个阶段:第一阶段失重缓慢,重量损失主要来自一些低沸点挥发物(H2O、HBr、丙酮、CO、CO2等)[23]。第二阶段是有机物分解阶段,集中在250~400 ℃,失重率约为30%,该范围内重量急剧下降,热分解过程主要发生在第二阶段,该现象与SHEN等[24]研究结果相一致。此阶段主要是环氧树脂及阻燃剂等复杂有机物发生分解反应,释放出高沸点挥发物(溴苯化合物、苯酚、芳香族化合物等)[25];400 ℃之后为第三阶段,热解反应基本完成,质量减少逐渐缓慢,是由于反应后热解残渣在高温下进一步发生缩聚、重排等反应,形成一些焦炭和小分子物质。随着升温速率的升高,TG曲线向右偏移,热滞后现象明显,表明达到相同转化率时,需要更高温度,主要是由于样品颗粒内部与外表面之间温度梯度分布不均匀导致,随着升温速率的升高,温度分布越不均匀,样品内部温度越低,分解速度变慢,热解产物逸出滞后;同时,颗粒热解反应时间变短,反应不充分,使得在相同温度范围内,随着升温速率增加,需要更长时间达到热平衡[26-27]。另外,升温速率增加,最终失重减少,主要是颗粒内外受热不均,颗粒内部发生热解释放的挥发组分在扩散过程中发生二次裂解,在颗粒内部或表面发生碳沉积现象,导致最终固体残渣质量增加。
从图1(b)可以发现,热解过程只有一个失重峰,主要对应于环氧树脂及阻燃剂等复杂有机物的分解过程。在5、10、15 ℃/min时,失重峰峰值温度分别为304、319、330 ℃,说明失重峰会随着升温速率的增大向高温方向移动,与TG曲线表现一致,表现出明显的热滞后现象。
2.2 热解过程动力学分析
利用3种不同模型对热解主要阶段为250~400 ℃之间的数据进行分析,a取值在0.1~0.8区间,步长为0.1,相关系数均在0.96以上。线性拟合结果见图2,KAS模型、FWO模型和FM模型热解动力学参数结果见表2。结合图2和表2可以看出,KAS型拟合结果中Ea在121.30~324.48 kJ/mol范围内,平均Ea为167.31 kJ/mol,A在6.2×108~1.25×1026s-1之间。利用FWO模型拟合,Ea在124.46~318.27 kJ/mol范围内,平均Ea为168.46 kJ/mol,A在1.46×109~4.96×1025s-1范围内。FM模型Ea在a= 0.8时达到535.40 kJ/mol,A为4.11×109~2.09×1043s-1。3个模型Ea变化趋势一致,均随着a增加而增大,在后期Ea增加趋势显著。Ea越高,反应需要较高的反应温度和较长的反应时间,才能获得足够的能量[28]。从图2可以看出,在a<0.6阶段,存在着C-Br、PhO-C等较弱的化学键和C-C、 C=C等强化学键的断裂;a>0.6的阶段活化能迅速上升,可能是产生的半焦重整反应等,所需活化能高。CHEN等[26]在研究SPCB与共存金属自催化热解时也发现了在热解后期Ea迅速增加的现象。A和Ea的变化一致,均随转化率增加相应增大。
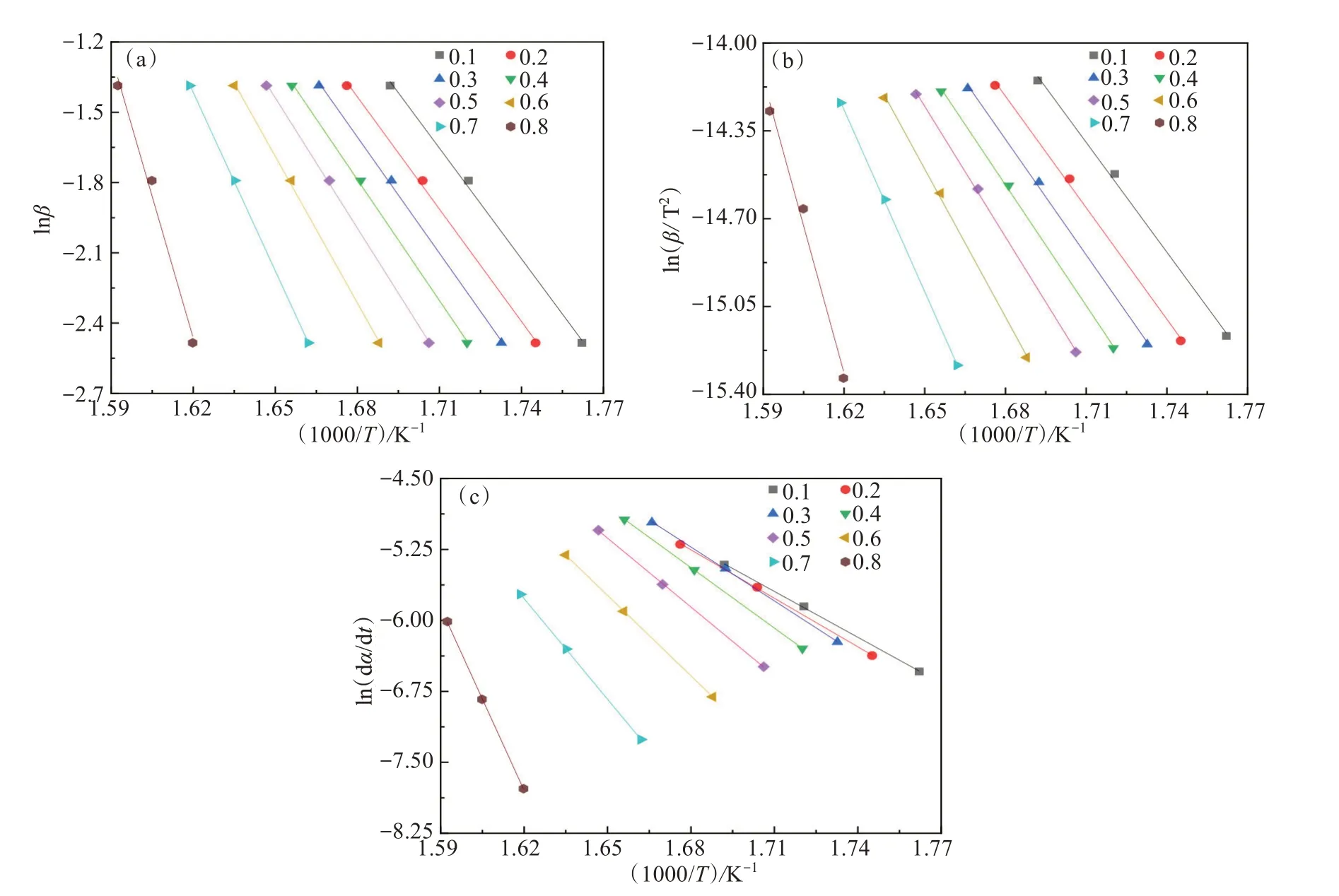
图2 FWO模型(a)、KAS模型(b)和FM模型(c)的拟合动力学曲线Fig.2 Kinetic fitting curves of FWO model(a), KAS model(b) and FM model (c)
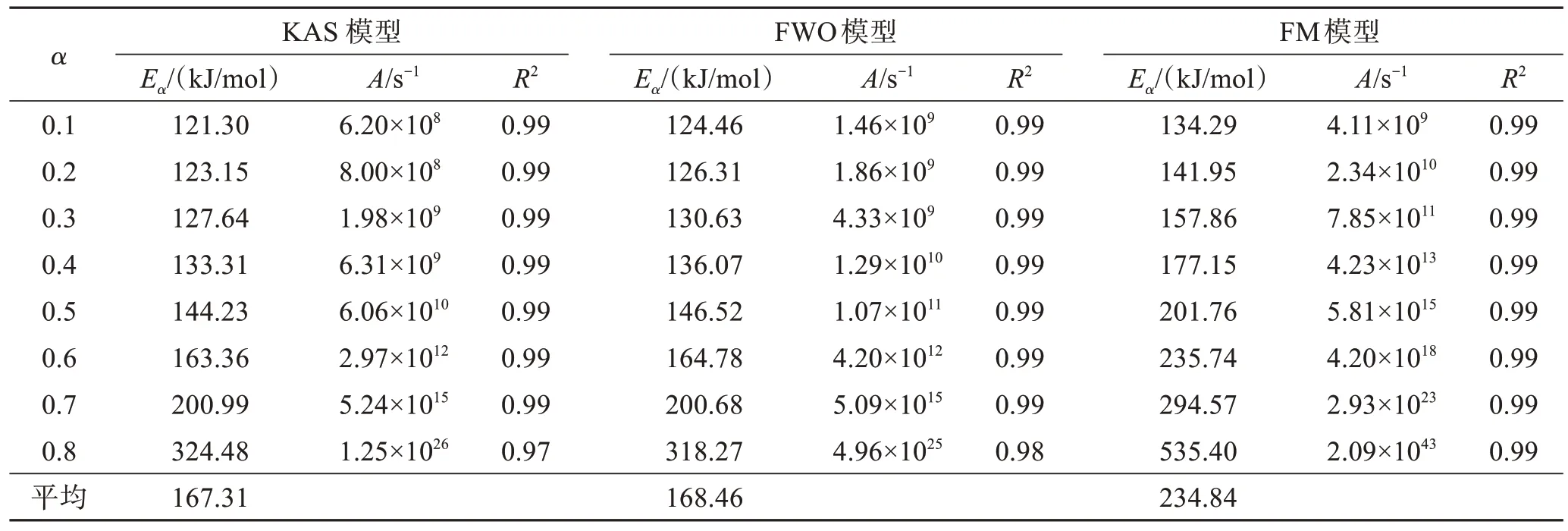
表2 KAS模型、FWO模型和FM模型热解动力学参数结果Table 2 Pyrolysis kinetics parameters of KAS, FWO and FM model
表3列举了本研究和其他学者对SPCB热解过程中Ea数值,整体上下浮动较大,主要由操作环境、选用原料及动力学模型不同导致。其中,王芳等[11]采用的FWO模型和KAS模型Ea同本实验使用所得结果高度吻合。本研究中FM模型所得Ea相较KAS模型和FWO模型拟合结果偏高,平均Ea为234.84 kJ/mol。FWO模型和KAS模型作了近似和假设处理,而FM模型不存在,故FM模型更接近实际活化能[29]。
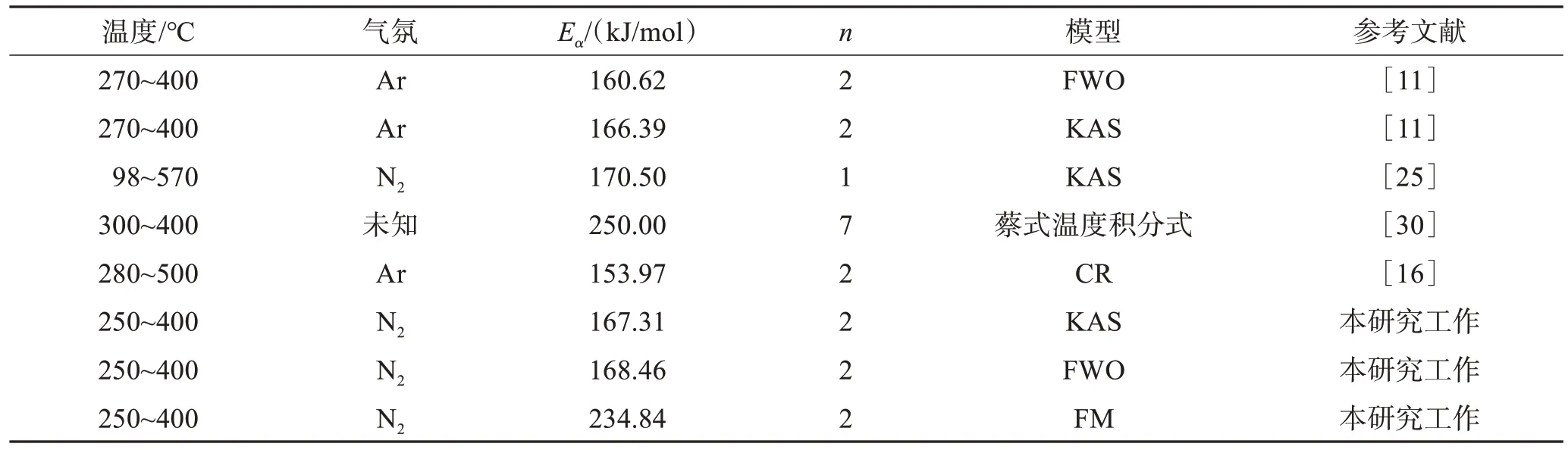
表3 各文献中SPCB热解过程活化能Table 3 Ea of SPCB pyrolysis from various literature
2.3 热解过程热力学分析
利用FWO模型得到表观活化能Ea,对不同升温速率下热力学参数ΔH、ΔG、ΔS和A进行分析,得到结果列于表4。
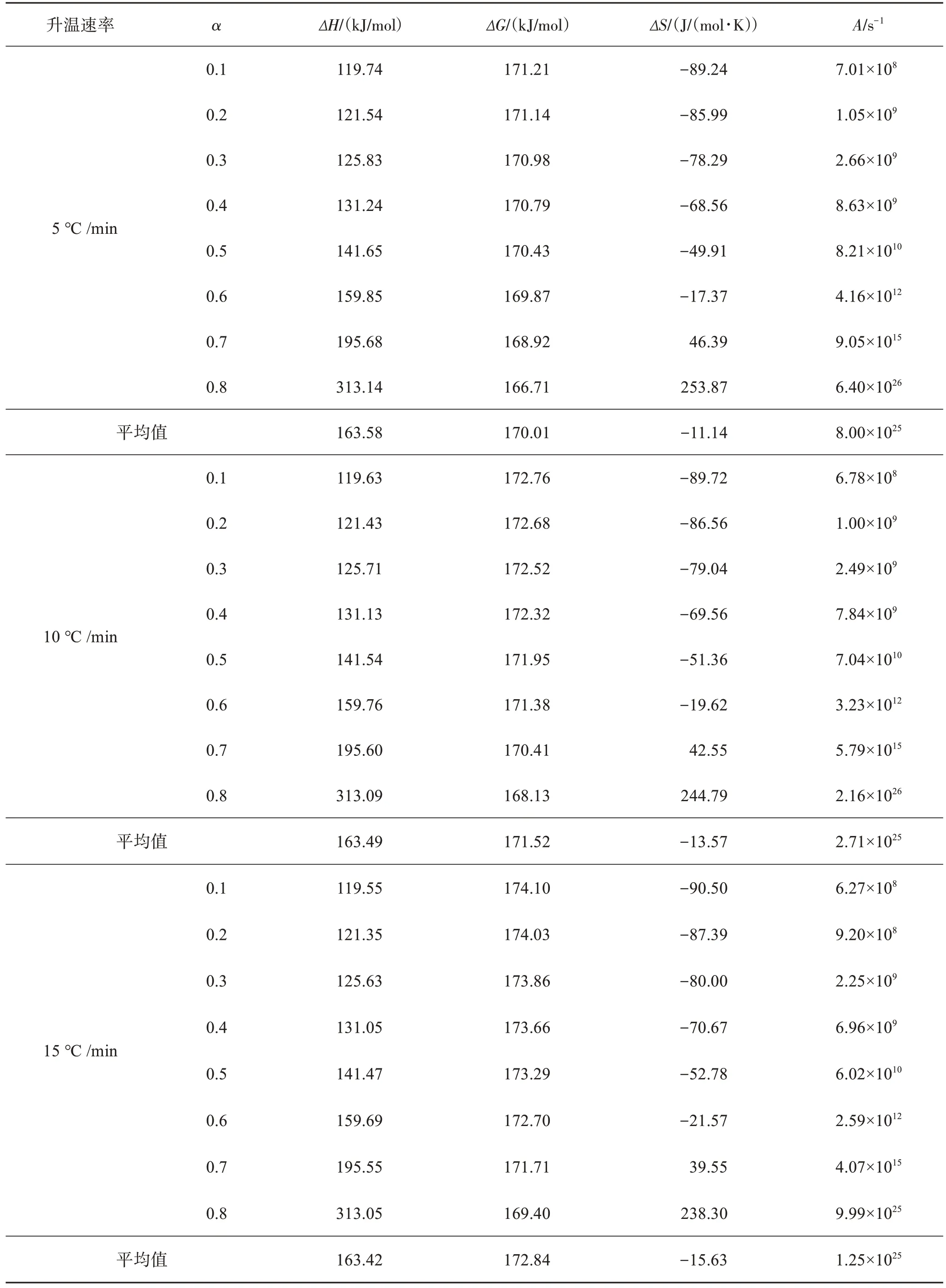
表4 不同升温速率下SPCB热解过程热力学参数Table 4 Thermodynamic parameters of SPCB pyrolysis at different heating rates
通过式(6)可以计算出A在不同a对应的数值。当A值小于109s-1时,反应表现出表面反应为速率控制步骤;当A值大于或等于109s-1时,发生复杂反应,挥发分可以顺利逸出[31-32]。表4所得的A在108~1026s-1之间,且在反应过程中迅速增加,故热解过程控制步骤发生了变化;同时,高数值的A意味着热解过程反应更加迅速。
ΔH是化学反应状态函数,表示单位质量的物质中总热含量[15]。从表4可知,ΔH值转化率增加不断增加,在120~320 kJ/mol范围内,ΔH>0,说明该热解过程吸收热量。5、10、15 ℃/min下的平均ΔH分别为163.58、163.49、163.42 kJ/mol,ΔH随升温速率增加而降低的程度可忽略不计,相同转化率情况下的ΔH变化并不明显。由此可知,升温速率并不会明显改变热解过程的热效应。
ΔG反应了反应体系在活化络合物形成过程中总能量的增加[33]。在热解反应过程中,ΔG均为正值,表明反应为非自发过程。在相同升温速率下,a由0.1增至0.8过程中,ΔG变化并不明显,大约降低了4.5 kJ/mol。在升温速率由5 ℃/min增至15 ℃/min时,ΔG平均值分别为170.01、171.52、172.84 kJ/mol,有着小幅度增加的趋势,说明更高的升温速率下,热解反应需要更高能量促使反应发生,该结果与TG曲线热滞后现象相符。
ΔS是关于体系内混乱程度的度量。根据表4中数据,发现相同升温速率下,随着a的增加,ΔS逐渐增大,当a>0.6时,由负值变成正值,符合熵增原理。ΔS<0说明产物微观结构混乱度降低,ΔS>0则说明产物微观结构的混乱程度增加[34]。低ΔS值意味着热解仅通过物理和化学变化,使其处于接近热力学平衡状态时,需要更长时间以形成活化络合物[32]。随着a的增加,热解体系混乱程度增加,反应物越远离热力学平衡值。
3 结 论
通过对SPCB热解过程动力学和热力学研究,主要得到以下结论:
根据TG分析结果,SPCB热解过程主要发生在250~400 ℃温度范围内,随着升温速率增加,TG曲线和DTG曲线均向高温方向偏移,且DTG曲线对应的失重峰峰值温度增加,热滞后现象的出现,表明热解过程达到相同转化率时,需要消耗更多的能量。利用3种模型(FWO模型、KAS模型与FM模型)分别对SPCB热解动力学进行分析,3种模型得到Ea值分别为167.31、168.46、234.84 kJ/mol,且对应的活化能均随转化率的增加不断增大。利用FWO模型对SPCB热力学函数进行分析,ΔH和ΔS分别在120~320 kJ/mol和-90~240 J/(mol·K)之间,随a增加,两者均不断增加,而ΔG呈不断减少的趋势。在相同a情况下,升温速率增加,会导致ΔG增大,对应的ΔS和ΔH稍有降低,但总体上,升温速率对热力学参数影响并不显著。

