新疆一枝蒿不同部位水提物的体外抗炎效果
邢天骄,彭凌峰,马丹阳,高雪嫣,赵红琼,郝智慧
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.中国农业大学动物医学院,北京 海淀 100193)
新疆一枝蒿(ArtemisiarupestrisL.)为菊科蒿属植物,广泛分布于我国新疆天山、阿尔泰山和昆仑山等地,是一味历史悠久的新疆道地药材,在新疆民间一直沿用至今[1]。新疆一枝蒿性寒,味辛、苦,具有祛风解表、健胃消积、活血散瘀的功效[2]。临床上常用来治疗风寒感冒、毒蛇咬伤和跌打肿痛等[3],其化学成分主要包括黄酮类、倍半萜类、有机酸、多糖类、挥发油类和生物碱等[4]。新疆一枝蒿作为一种传统中药材,其药理作用受到越来越多人的关注。药理学研究表明,新疆一枝蒿具有抗病毒、抗过敏、促消化、抗炎和调节免疫功能等药理作用[5-8]。然而,目前对新疆一枝蒿的开发和利用还存在不足,为了进一步在兽医临床上提高对该药材的综合利用,本试验基于体外炎症模型,对比研究了新疆一枝蒿不同部位(叶、茎、花)水提物抗炎效果的差异,以期提高药材使用效率,为新疆一枝蒿药材在兽医临床的应用和开发提供参考依据。
1 材料与方法
1.1 材料
1.1.1 受试药物 新疆一枝蒿(ArtemisiarupestrisL.),采集于新疆吐鲁番市鄯善县达浪坎乡乔亚村,室内通风干燥后避光保存。
1.1.2 细胞 小鼠单核巨噬白血病细胞(RAW 264.7),购自美国细胞培养物收藏中心(American Type Culture Collection,ATCC)细胞库。
1.1.3 主要试剂 DMEM培养基和脂多糖(Lipopolysaccharide,LPS),均购自美国默克有限公司;胎牛血清(Fetal bovine serum,FBS)、实时荧光定量PCR(Real-time fluorescence quantification PCR,RT-qPCR)试剂盒和逆转录试剂盒,均购自赛默飞世尔科技(中国)有限公司;磷酸盐缓冲液(Phosphate buffer saline,PBS)、细胞裂解液、二甲基亚砜(Dimethyl sulfoxide,DMSO)、10×TBST缓冲液、5×Tris-甘氨酸电泳缓冲液和10×电泳转移缓冲液,均购自北京索莱宝科技有限公司;噻唑蓝(Methyl thiazolyl tetrazolium,MTT),购自上海麦克林生物科技股份有限公司;BCA蛋白定量试剂盒,购自康为世纪生物科技股份有限公司;PVDF膜,购自密理博中国有限公司(上海)公司;β-actin兔源多克隆抗体、重组Anti-IL-1β抗体、重组Anti-IL-6抗体、重组Anti-TNF-α抗体和山羊抗兔IgG二抗,均购自艾博抗(上海)贸易有限公司;超敏ECL化学发光检测试剂盒,购自安诺伦(北京)生物科技有限公司。
1.1.4 主要仪器和设备 KDM电子调温电热套,龙口市先科仪器有限公司产品;RE-52AA真空旋转蒸发仪和SHZ-III循环真空泵,上海亚荣生化仪器厂产品;LRH-250F二氧化碳培养箱,上海一恒公司产品;倒置显微镜,奥林巴斯(中国)有限公司产品;Infinite M nano酶标仪,帝肯(上海)实验器材有限公司产品;CFX96 TouchTMReal-time PCR System实时荧光定量PCR仪,伯乐生命医学产品(上海)有限公司产品;Amersham Image Quant 800蛋白印迹成像系统,格来赛生命科技(上海)有限公司产品。
1.2 方法
1.2.1 药液制备 取新鲜的新疆一枝蒿分离其叶、花和茎,各称取10 g进行水提液的制备,第1次加10倍量水,室温浸泡30 min,在100 ℃条件下冷凝回流1 h,滤过,滤渣加8倍量水再次冷凝回流1 h,滤过,合并滤液,用真空旋转蒸发仪将药液浓缩至1 g/mL,过0.22 μm滤膜,即得母液。使用FBS和DMEM培养基对母液进行稀释,得到含10% FBS的新疆一枝蒿叶水提物(YZH-Y)、新疆一枝蒿茎水提物(YZH-J)和新疆一枝蒿花水提物(YZH-H)药液。
1.2.2 细胞培养 RAW264.7接种于含有10% FBS、100 U/mL青霉素和0.1 mg/mL链霉素的DMEM培养基中,并置于37 ℃、5% CO2细胞培养箱中进行培养。
1.2.3 MTT检测细胞活力度 取对数生长期的RAW264.7,用完全培养基(含10%FBS的DMEM培养基)吹打成细胞悬液。以5×104个/mL的密度均匀接种至96孔板,培养24 h后弃去培养液,分别加入终浓度为10.000、5.000、2.500、1.250、0.625、0.313、0.156和0.078 mg/mL的YZH-Y、YZH-J和YZH-H药液的完全培养基作为试验组,细胞加完全培养基作为对照组,不含细胞只加入完全培养基作为空白组,每孔100 μL。于细胞培养箱中培养24 h后,每孔加入10 μL MTT溶液孵育4 h,随后每孔加入150 μL DMSO,10 min后用酶标仪在490 nm下检测吸光度(Optical density,OD)值,按照公式(1)计算细胞活力度。
细胞活力度(%)=(试验孔OD值-空白孔OD值)÷(对照孔OD值-空白孔OD值)×100%
(1)
本试验在体外用LPS诱导RAW264.7构建炎症模型,取对数生长期的RAW264.7,同上进行处理,分为对照组、试验组和LPS模型组。对照组加入完全培养基100 μL,LPS模型组加入含LPS(1 μg/mL)的完全培养基100 μL,试验组加入含LPS(1 μg/mL)和相应浓度药物的完全培养基100 μL,培养24 h后,同上使用MTT法检测每孔的OD值,根据公式(2)计算细胞活力度。
细胞活力度(%)=(试验孔OD值-对照孔OD值)÷(LPS模型孔OD值-对照孔OD值)×100%
(2)
1.2.4 RT-qPCR检测炎症相关基因表达 根据MTT试验结果,选定药物浓度为0.625和1.250 mg/mL进行后续试验。取对数生长期的RAW264.7,以5×105个/mL的密度接种至6孔板,待细胞贴壁后,对照组和LPS模型组加入2 mL完全培养基,0.625 mg/mL药物浓度组、1.250 mg/mL药物浓度组、LPS+0.625 mg/mL药物浓度组和LPS+1.250 mg/mL药物浓度组分别加入0.625和1.250 mg/mL 的YZH-Y、YZH-J和YZH-H药液预处理1 h,之后将每孔内液体弃去。不同分组细胞分别加入2 mL对应液体,完全培养基(对照组)、含1 μg/mL LPS的完全培养基(LPS模型组)、含0.625(0.625 mg/mL药物浓度组)和1.250 mg/mL(1.250 mg/mL药物浓度组)药液的培养基和含1 μg/mL LPS和0.625(LPS+0.625 mg/mL药物浓度组)、1.250 mg/mL药液(LPS+1.250 mg/mL药物浓度组)的培养基,培养24 h。采用TRIzol法从细胞样品中提取总RNA,用逆转录试剂盒将总RNA反转录为cDNA。按RT-qPCR试剂盒说明书,应用RT-qPCR仪进行炎症相关基因表达检测。循环扩增条件:95 ℃预变性2 min,95 ℃持续变性5 s,60 ℃退火延伸30 s,采集荧光。完成40个PCR扩增周期后,进行熔解曲线分析。以β-actin为内参,检测TNF-α、IL-1β和IL-6 mRNA差异性表达,引物序列见表1。

表1 实时荧光定量PCR引物序列
1.2.5 Western blot法检测炎症相关蛋白表达 细胞分组和处理同1.2.4,药物作用24 h后,弃去液体用 PBS 洗 2 次,加入裂解液 100 μL,在 4 ℃条件下裂解 1 h。将裂解液收集到 1.5 mL离心管中,12 000 r/min离心 10 min,提取细胞蛋白,用BCA试剂盒测定总蛋白浓度。在蛋白样品中加5×蛋白上样缓冲液,100 ℃加热10 min,使蛋白完全变性,保存于-20 ℃冰箱备用。将蛋白样品用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离后,通过电转将蛋白转移至0.45 μm PVDF膜上,用含0.2%明胶的TBST于室温封闭2 h;4 ℃孵育一抗(β-actin、IL-1β、IL-6和TNF-α)过夜;使用TBST洗3次,每次15 min;二抗孵育2 h;TBST清洗3次,每次15 min;用超敏ECL化学发光液显影。
1.2.6 统计学分析 所有试验均进行3次重复,使用SPSS 25统计学软件进行统计分析,并用GraphPad Prism 8.0进行作图,采用单因素方差法(Analysis of Variance,ANOVA)分析进行计算统计。在分析结果中,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 新疆一枝蒿叶、茎、花水提物对RAW264.7细胞活力度的影响 如图1所示,与对照组相比(细胞活力度为100%),YZH-Y浓度介于0.078~1.250 mg/mL时,细胞活力度介于85.73%~88.62%,表明该浓度范围内YZH-Y对细胞活性无显著影响;当YZH-Y浓度大于2.500 mg/mL时,细胞活力度极显著下降(P<0.01),在YZH-Y浓度为2.500、5.000和10.000 mg/mL时,细胞活力度分别为78.64%、58.76%和4.63%;YZH-J浓度介于0.078~5.000 mg/mL时,细胞活力度介于89.02%~109.73%,表明该浓度范围内YZH-J对细胞活性无显著影响;YZH-J浓度为10.0 mg/mL时,细胞活力度极显著下降(P<0.01),细胞活力度仅为20.47%;YZH-H浓度介于0.078~1.250 mg/mL时,细胞活力度介于86.07%~106.85%,表明该浓度范围内YZH-H对细胞活性无显著影响;YZH-H浓度为2.500 mg/mL时,细胞活力度显著下降(P<0.05),为77.88%;YZH-H浓度为5.000和10.000 mg/mL时,细胞活力度极显著下降(P<0.01),分别为60.24%和5.48%。

图1 新疆一枝蒿不同部位水提物对RAW264.7细胞活力度的影响(n=3)
2.2 新疆一枝蒿叶、茎、花水提物对LPS诱导下RAW264.7细胞活力度的影响 如图2所示,与对照组相比,叶、茎、花水提物试验中LPS模型组细胞活力度下降了7.09%~11.78%。与LPS模型组相比,当YZH-Y在0.313~1.250 mg/mL浓度范围时,细胞活力度极显著升高(P<0.01),提高了23.12%~28.14%;当YZH-Y的浓度大于5.000 mg/mL时,细胞活力度极显著下降(P<0.01);当YZH-J在0.625~2.500 mg/mL浓度范围时,细胞活力度极显著升高(P<0.01),提高了10.88%~18.62%;当YZH-J的浓度大于5.000 mg/mL时,细胞活力度极显著下降(P<0.01);当YZH-H的浓度为0.625和1.250 mg/mL,细胞活力度分别提高了16.13%和16.76%(P<0.05);当YZH-H的浓度大于5.00 mg/mL时,细胞活力度极显著下降(P<0.01)。

图2 新疆一枝蒿不同部位水提物对LPS诱导RAW264.7细胞活力度的影响(n=3)
2.3 新疆一枝蒿叶、茎、花水提物对LPS诱导下RAW264.7炎症相关基因表达的影响 如图3所示,与对照组相比,叶、茎、花水提物试验中LPS模型组炎症因子IL-6、IL-1β和TNF-α的mRNA表达极显著增加(P<0.01)。与LPS模型组相比,0.625和1.250 mg/mL浓度的YZH-Y、YZH-J和YZH-H处理均极显著降低了IL-1β的mRNA表达(P<0.01);0.625和1.250 mg/mL浓度的YZH-Y和YZH-J处理均极显著降低了IL-6的mRNA表达(P<0.01),0.625 mg/mL浓度的YZH-H处理极显著降低了IL-6的mRNA表达(P<0.01);0.625 和1.250 mg/mL浓度的YZH-J处理极显著降低了TNF-α的mRNA表达(P<0.01),1.250 mg/mL浓度的YZH-Y处理极显著降低了TNF-αmRNA的表达(P<0.01),1.250 mg/mL浓度的YZH-H处理极显著升高了TNF-α的mRNA表达(P<0.01)。
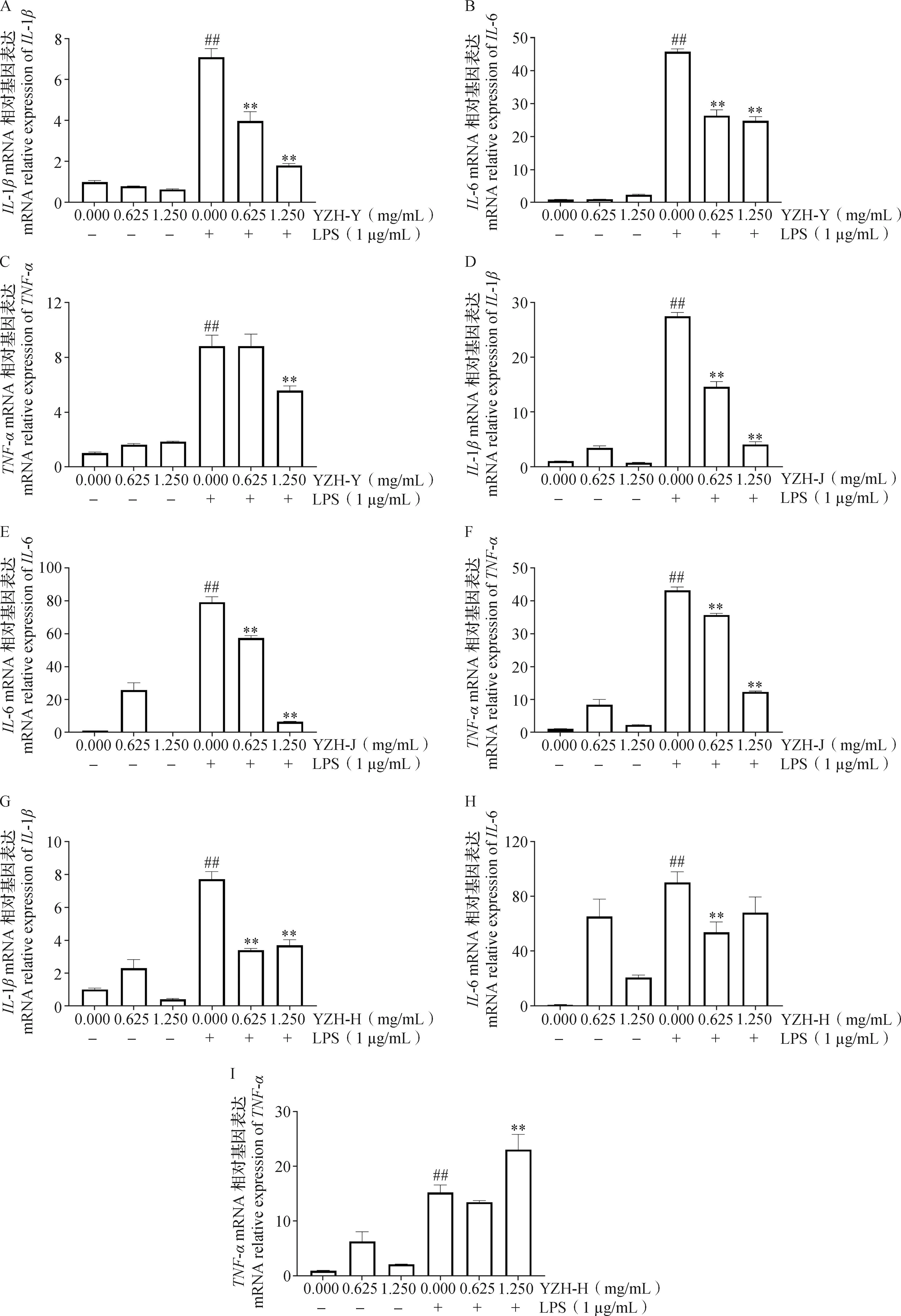
图3 新疆一枝蒿不同部位水提物对LPS诱导RAW264.7中IL-6、IL-1β和TNF-α mRNA相对表达的影响(n=3)
2.4 新疆一枝蒿叶、茎、花水提物对LPS诱导下RAW264.7炎症相关蛋白表达的影响 结果如图4所示,与对照组相比,叶、茎、花水提物试验中LPS模型组的IL-1β和IL-6的蛋白表达极显著增加(P<0.01)。与LPS模型组相比,0.625和1.250 mg/mL浓度的YZH-Y、YZH-J和YZH-H处理均极显著降低了IL-1β的蛋白表达(P<0.01);0.625和1.250 mg/mL浓度的YZH-H处理极显著降低了IL-6的蛋白表达(P<0.01);1.250 mg/mL浓度的YZH-Y处理极显著降低了IL-6和TNF-α的蛋白表达(P<0.01);0.625 mg/mL浓度的YZH-H极显著增加了TNF-α的蛋白表达(P<0.01)。
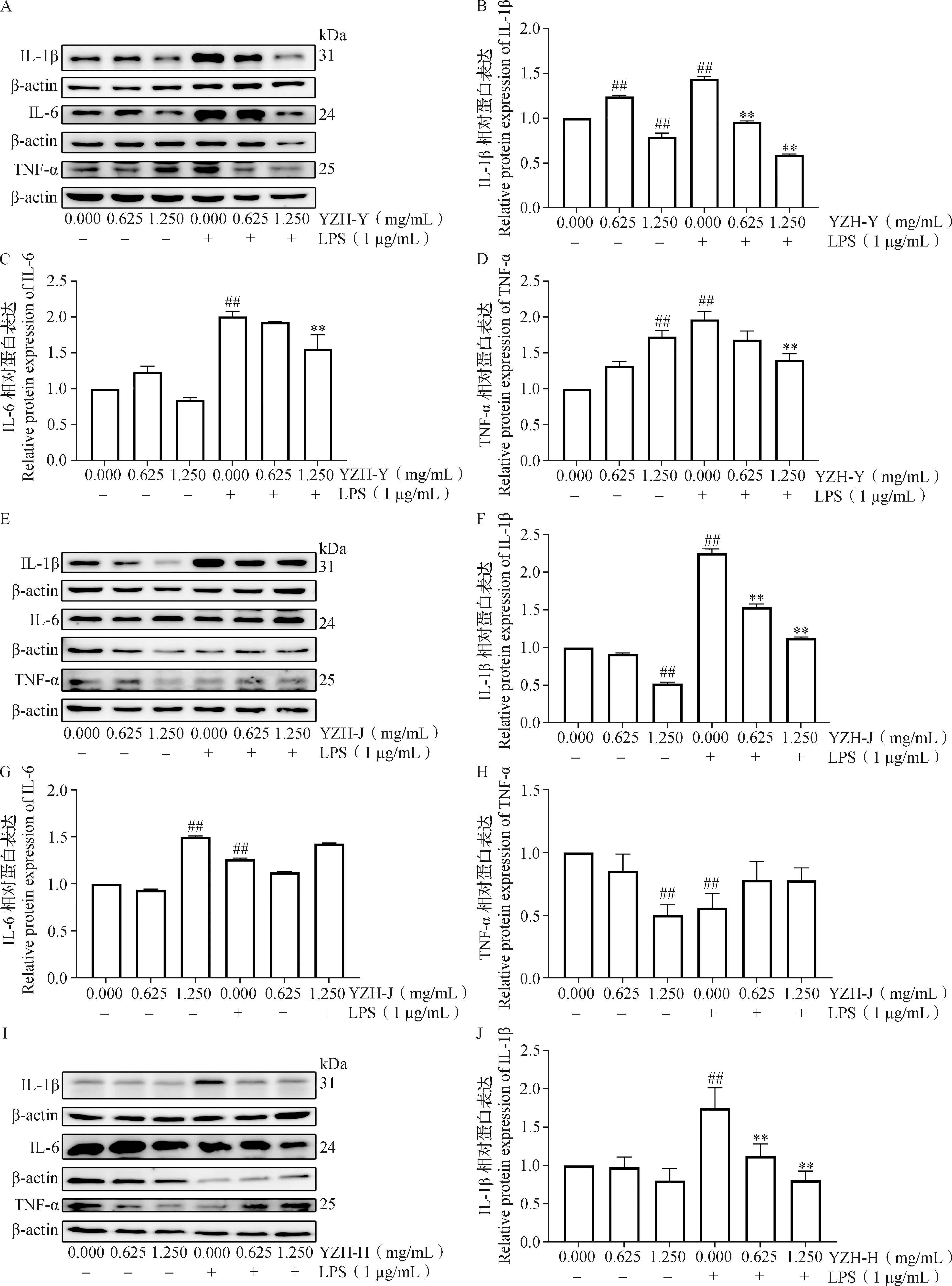
图4 新疆一枝蒿不同部位水提物对LPS诱导RAW264.7中IL-6、IL-1β和TNF-α蛋白相对表达的影响(n=3)
3 讨论
MTT法是利用MTT被活细胞线粒体中的琥珀酸脱氢酶还原成甲臜并经DMSO溶解,通过检测其OD值来反映细胞活性变化的一种方法,具备快速、简便等优点。本试验首先通过MTT法检测YZH-Y、YZH-J和YZH-H对RAW264.7细胞活力度的影响,结果显示,YZH-Y、YZH-J和YZH-H在0.078~1.250 mg/mL浓度范围内对RAW264.7细胞活力度均无显著影响。随后进一步探究了3种水提物对LPS诱导RAW264.7细胞活力度的影响,结果显示,同LPS模型组相比,YZH-Y、ZYH-J和ZYH-H分别在0.313~1.250、0.625~2.500和0.625~1.250 mg/mL浓度范围进行处理时,细胞活力度显著提升。根据以上试验结果,选择药物浓度为0.625和1.250 mg/mL进行后续试验,考察其不同部位的抗炎活性差异。
LPS诱导巨噬细胞释放炎性介质的模型被广泛应用于药物抗炎、抗氧化应激的药效评价和机制研究。LPS为革兰阴性细菌细胞壁成分,可刺激巨噬细胞产生炎症介质,引起炎症反应[9]。巨噬细胞作为免疫细胞,在炎症发生过程中会分泌很多细胞因子,参与炎性疾病过程。TNF-α、IL-1β和IL-6三个促炎性细胞因子为炎性疾病过程所关注的重点[10]。IL-1β作为炎症早期指标,可以诱导和促进其他炎症因子的分泌,引起炎症级联反应和组织损伤,严重时可引起全身炎症反应综合征、多器官功能衰竭甚至死亡[11]。IL-1β可以促进IL-6的表达,当IL-6与重组人白介素6受体α(Recombinant human interleukin-6 receptor subunit alpha,IL-6Rα)结合时,会增强炎症反应。在炎症发生过程中,TNF-α作为炎症初期的炎症介质可以同IL-1β和IL-6因子一起发生级联反应,引起炎症反应加剧[12]。本试验中浓度为1 μg/mL的LPS刺激巨噬细胞可以使促炎因子显著升高,这与张艺等[13]和李玉凤等[14]的研究结果一致。
本试验利用RT-qPCR和Western blot试验进一步检测TNF-α、IL-1β和IL-6三个炎症因子的mRNA和蛋白表达,通过表达水平的差异来反映新疆一枝蒿不同部位水提物抗炎效果的差异。结果显示,与对照组相比,LPS模型组TNF-α、IL-1β和IL-6的mRNA表达均显著增加。浓度为1.250 mg/mL的YZH-Y在mRNA和蛋白水平上都极显著降低IL-1β、IL-6和TNF-α的表达。一些研究表明,中药水提物可通过抑制炎症介质进而抑制NF-κB通路的激活,以减轻炎症效果。例如,阿尔泰瑞香水提物可抑制IL-1β、IL-6和TNF-α炎症因子的释放,发挥抗炎活性[15];翼茎羊耳菊水提物可显著抑制炎性因子IL-1β、IL-6和TNF-α的mRNA和蛋白表达,从而发挥较好的抗炎活性[16]。本试验结果与上述结果类似,表明YZH-Y具有类似的抗炎效果。浓度为0.625 mg/mL的YZH-H可显著降低IL-1β和IL-6的mRNA和蛋白表达,但对TNF-α无抑制作用,这与金骨莲提取物发挥抗炎效果的炎症因子分泌趋势类似[17],因此推测YZH-H通过抑制IL-1β和IL-6细胞因子分泌以减轻炎症状态。YZH-J则仅通过减少IL-1β的表达发挥抗炎作用。
研究表明,新疆一枝蒿含有丰富的活性成分,其中与抗炎活性有关的化合物多为黄酮和倍半萜类化合物,如一枝蒿酮酸、木犀草素、槲皮素、芦丁、蒙花苷和芹菜素等均可以发挥抗炎作用[18]。新疆一枝蒿不同部位的活性成分含量也不相同,芦丁和绿原酸在叶中的含量明显高于茎和花,木犀草素在叶中含量较高,一枝蒿酮酸和蒙花苷在叶和花中的含量远高于茎中含量,黄酮和倍半萜类化合物多累积在花和叶中[19-21]。本试验基于体外RAW264.7炎症反应,首次对比分析了新疆一枝蒿不同部位(叶、茎、花)水提物的抗炎效果差异。结果表明,新疆一枝蒿不同部位(叶、茎、花)水提物均可通过抑制炎症因子,发挥抗炎作用,其中浓度为1.250 mg/mL的新疆一枝蒿叶水提物可以抑制炎症因子IL-6、IL-1β 和TNF-α的mRNA转录和蛋白表达,浓度为0.625和1.250 mg/mL的茎水提物可以抑制炎症因子IL-1β的mRNA转录和蛋白表达,浓度为0.625 mg/mL的花水提物可以抑制炎症因子IL-6和IL-1β的mRNA转录和蛋白表达,该结果可为新疆一枝蒿药材的兽药开发和临床应用提供参考依据。然而,本试验仅在细胞分子水平上比较了其抗炎差异,相较于动物而言,其机体内环境更加复杂,因此后续还需要通过进一步的动物试验明确抗炎相关作用机制。

