木材分子考古研究进展*
焦立超 陆 杨 郭 雨 殷亚方
(中国林业科学研究院木材工业研究所 中国林业科学研究院木材标本馆 国家林业和草原局木材标本资源库CITES全球野生动植物鉴定实验室 北京 100091)
木材作为人类最早使用的天然材料之一,因获取方式简单、资源丰富、用途多样等优点,从史前时代至今一直被广泛用于社会生活的诸多方面,几乎贯穿整个人类社会发展历史(Sandströmet al.,2002;Walsh-Korbet al.,2019;王树芝,2017;赵广杰,2021;Luet al.,2023)。木质遗存是人类文化遗产的重要载体,蕴含着丰富的历史文化和生态价值,随着考古发现的日益丰富和现代科学技术的不断发展,人们对木质遗存的保护、修复和研究更加迫切,通过包括木材学、测年技术、分子生物学等在内的木材考古学方法手段研究木质遗存蕴含的自然和社会属性,可为木质文物的历史信息挖掘、修复和保存提供科学依据。
分子考古学(molecular archaeology)是一门新兴的交叉学科,主要针对古DNA分子开展研究,是目前考古学的热门方向。分子考古学的理论基础是分子系统学(molecular phylogenetics)和群体遗传学(population genetics)。最早关于木材分子考古的研究可追溯至20世纪90年代(Dumolin-Lapègueet al.,1999),采用聚合酶链式反应(PCR)技术从14世纪的水坝栎木(Quercus)木桩中成功获取长度为290 bp的叶绿体非编码区DNA片段。近年来,随着古DNA捕获和测序分析技术的快速发展,木材古DNA研究逐步取得长足进展,采用分子生物学手段已分别从木结构古建筑承重构件(Jiaoet al.,2022)、饱水考古栎属木材(Wagneret al.,2018)甚至亚化石木(Lendvayet al.,2018)中成功获取微量且高度降解的古DNA信息。本文梳理国内外木材分子考古研究的主要进展,总结该领域的需求和难点,并提出优先发展方向,以进一步加强木材分子考古等多学科交叉研究,推动新理论、新方法、新技术在木材学和考古学领域的应用,为木质文物修复、保护与保存,深入理解先民认知与利用森林资源方式以及复原历史时期地域性森林植被类型和物种多样性提供科学依据。
1 木材分子考古研究发展概述
古DNA是木材分子考古研究的核心,其利用现代分子生物学手段提取和分析保存在木质遗存中的古DNA分子,以解决考古学问题。
古DNA指从生物遗骸或环境中获取的古代生物遗传物质(Higuchiet al.,1984;Pääbo,1989;Kistleret al.,2020;Jiaoet al.,2022),作为重要的遗传信息载体,其从分子水平记录着生物的进化、迁移及其对环境和气候变化的响应。随着以第二代DNA测序技术为基础(Rasmussenet al.,2010)并结合古DNA提取与富集方法的建立和发展,分子考古研究已由成功提取古DNA片段为起点进入古基因组分析时代(Römpleret al.,2006;Kistleret al.,2020),通过分子考古研究有望突破时间和空间尺度局限,为解决生物进化历史、灭绝物种和现存物种进化关系、古环境中生物主要组成等重建问题,以及深入探究物种迁徙、入侵和灭绝等内在原因提供科学途径和技术手段(Hofreiteret al.,2015)。
迄今为止,全球分子考古研究多集中于人类和动物物种。1984年,《Science》期刊首次报道从灭绝的斑驴(Quagga)标本中成功提取长度为229 bp的线粒体DNA片段(Higuchiet al.,1984),标志着分子考古研究序幕的开启。植物分子考古研究始于1985年,从保存500~44 600年前的叶片、种子和胚芽等材料中成功获取了DNA(Rogerset al.,1985)。当前,植物分子考古研究主要涉及小麦(Triticum aestivum)(Wuet al.,2019)、玉米(Zea mays)(Liaet al.,2007)、稻(Oryza sativa)(Castilloet al.,2016)等古作物遗存,为植物起源与演化、农作物驯化等提供了重要科学参考。木材(树木木质部)作为一种重要的植物组织类型,尽管与森林植被演变和人类文明发展密切相关,但与其他植物组织样本相比,木材分子考古研究仍较缺乏。20世纪90年代,研究人员采用PCR技术从栎木中获取叶绿体DNA片段(Dumolin-Lapègueet al.,1999),开启了木材古DNA研究(图1)。在随后迅速发展的高通量测序技术背景下,科研人员从保存时间跨度550年至13 000年的栎属饱水考古木材以及亚化石材料中成功获得木材内源DNA信息,并评估了影响木材细胞古DNA保存的关键环境因素(Lendvayet al.,2018;Wagneret al.,2018)。Jiao等(2022)将古DNA液相杂交捕获技术应用于故宫古建筑楠属(Phoebe)木材,成功获得了高质量质体DNA基因组。开展木材分子考古研究,为进一步揭示古代人类生活方式和社会文化发展提供了新的途径。

图1 木材相关分子考古研究的主要时间线(1999—2022年)Fig. 1 Main timeline for molecular archaeological research for ancient woods (1999—2022)
2 木材古DNA保存和降解
生物细胞死亡后,水解、氧化和微生物作用将直接造成DNA双螺旋结构主链断裂和分子降解(Camposet al.,2012;Kapustaet al.,2017)。古DNA保存时间的限制由其降解速率决定,降解速率主要取决于考古材料自身条件和保存环境(Parducciet al.,2005;2017)。
起源于树木形成层的木质部主要由木纤维、管胞、导管分子和薄壁细胞等不同类型细胞构成。在树木心材形成过程中,管胞、导管分子等轴向管状细胞的细胞壁和原生质体发生明显变化,细胞器也随之消失(Nakabaet al.,2011);而具有养分存储和径向输导功能的射线薄壁细胞可能保持数十年甚至上百年的生命活力(Morris,2016)。尽管在木质部形成尤其是细胞程序性死亡(programmed cell death,PCD)阶段,细胞核及其他各种细胞器开始降解,DNA也逐渐被释放的核酸酶分解,但仍会有少量质体等细胞器甚至片段化的DNA最终附着在细胞壁上,同时木质化的细胞壁形成的封闭微空间也可能为DNA的长期保存提供良好环境(Gugerliet al.,2005),然而在时间和空间维度的共同作用下,考古木材内源古DNA普遍发生降解、损伤等显著变化。
对古代样本中残存DNA分子的研究表明,DNA降解并非线性过程,且损伤速度不与时间呈正比关系,在生物死亡后的早期,因核酸内切酶的活性致使DNA发生迅速降解;核酸内切酶活性丧失后,DNA降解速率变慢并保持相对稳定状态(Yang,1997)。古DNA的存在状态与温度、氧含量、湿度、pH和腐殖酸含量等保存条件有关(盛桂莲等,2016;Kistleret al.,2017)。古DNA分子发生化学损伤时,主要表现为含氮碱基脱氨基、脱嘌呤以及脱嘧啶等(表1),尤其是DNA链5′端C→T错配和3′端G→A的互补,这一变化特征已成为检验所获取古DNA真实性的重要标准之一(Willerslevet al.,2005;杨周岐等,2006;Briggset al.,2007;Skoglundet al.,2014)。研究表明,从存储时间超过600年的古建筑楠木构件样本中获取的古DNA片段 3′端G→A损伤率为1.5%~5.7%,5′端C→T损伤率为0.3%~2.4%(Jiaoet al., 2022);而存储时间8 000年的出土饱水栎属木材古DNA片段 3′端G→A和5′端C→T损伤率均超过30%(Wagneret al.,2018)。因此,古DNA末端存在的化学损伤行为成为限制序列信息准确提取的关键因素。
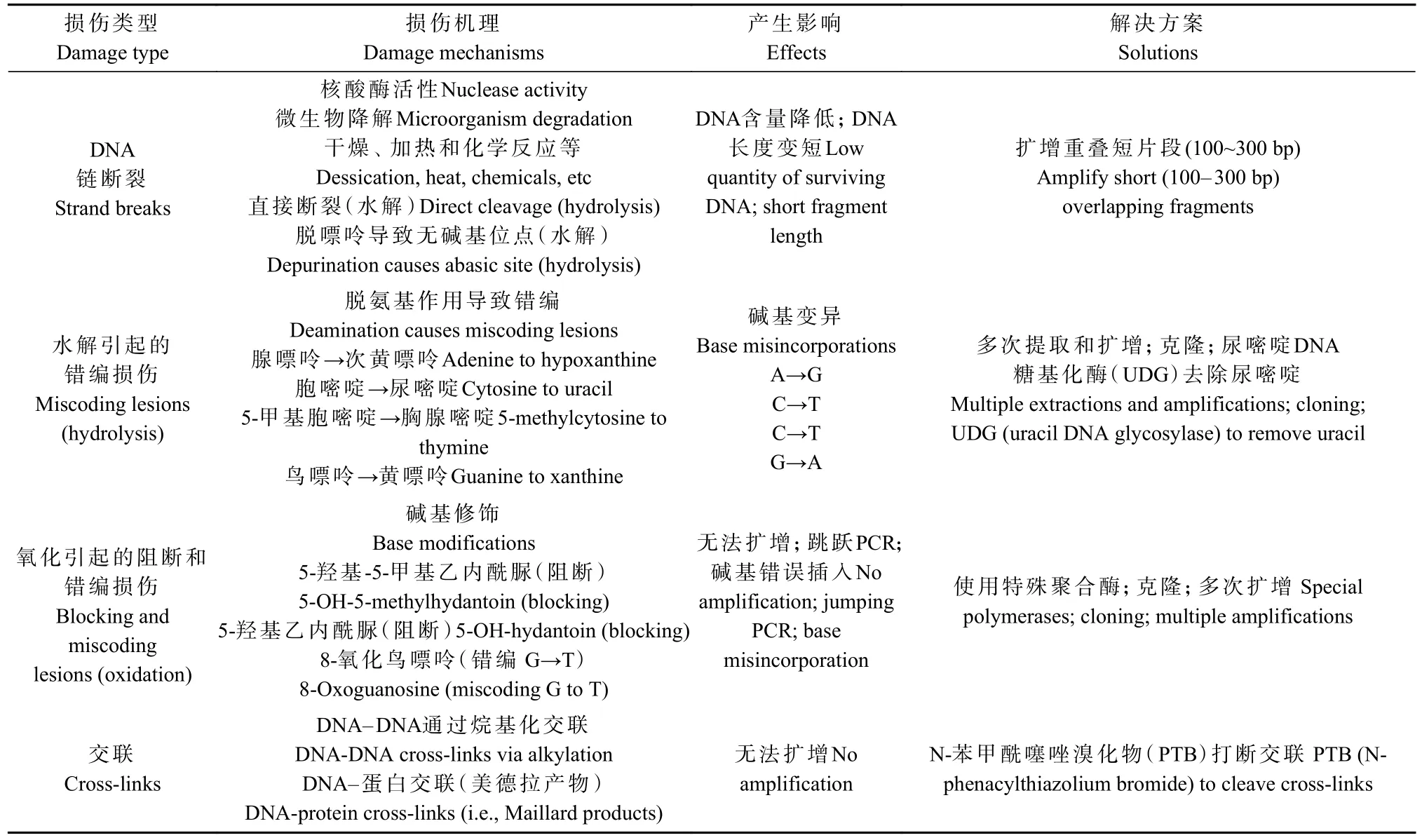
表1 古DNA损伤主要类型(Hofreiter et al.,2012;Orlando et al., 2021)Tab. 1 Main types of ancient DNA damage
3 木材古DNA获取
木材古DNA具有降解、损伤和易污染等特性,构建有针对性的古DNA提取方法尤为关键。考古木材DNA提取方法主要包括样品前处理(外源污染去除)、提取纯化、文库制备和基因捕获(图2)等步骤。

图2 考古木材DNA获取流程(修改自Jiao et al., 2022)Fig. 2 The process of archaeological wood DNA acquisition (modified from Jiao et al., 2022)
3.1 外源DNA污染去除
考古木材与古人类骨骼等遗存类似,在样本现场发掘与采集、运输、储存、实验室提取与分析阶段极易受现代外源DNA的污染(Sampietroet al.,2006;Pilliet al.,2013);而且,在长期存储过程中样本表层甚至内部多会发生微生物侵染。因此,在外源污染控制方面,最直接的途径是在样本预处理阶段对考古木材中的微生物和现代DNA进行去除,样本表面组织去除、次氯酸钠处理、紫外照射等是去除外源污染的常用有效方法。根据样本实际尺寸通常将表面组织切除1~3 mm,以消除表面残存的微生物甚至现代DNA污染。研究表明,木材样本经0.5%次氯酸钠浸泡处理后外源污染可有效去除,但该方法也同时易造成内源DNA的损失(Malmströmet al.,2007;Korlevićet al.,2015)。相比单一处理方法,通过表面去除、次氯酸钠处理和紫外照射3种方法的有效结合,更有助于提升外源污染的去除效果(Lendvayet al.,2018)。总体来说,在木材样本采集和处理过程中应通过制定并执行严格的古DNA试验操作规程,将外源DNA干扰因素降至最低(Hofreiteret al.,2012;Marx,2017),这对古DNA研究极为关键。
3.2 木材古DNA提取与纯化
考古木材DNA提取方法的发展是建立在植物DNA常规提取方法基础上,并通过技术参数改进优化逐步形成的。目前,常见的古DNA提取方法主要包括十二烷基硫酸钠(SDS)法、十六烷基三甲基溴化铵(CTAB)法、硅离心柱法和磁珠法等。利用含十二烷基硫酸钠(SDS)、蛋白酶K和二硫苏糖醇(DTT)的DNA裂解方法,从取自湖泊或海洋的亚化石木中可成功获取木材内源古DNA(Waleset al.,2014;Wagneret al.,2018);向十六烷基三甲基溴化铵(CTAB)裂解液中加入聚乙烯吡咯烷酮(PVP),可显著提升木材化石中古DNA提取效率(Gómez-Zeledónet al.,2017;Sobiehet al.,2020);基于硅离心柱或磁珠的商用DNA试剂盒优化提取方法,也被证实可有效提取亚化石木、饱水木材和古建筑木构件等样本的DNA(Lendvayet al.,2018;Akhmetzyanovet al.,2020)。
此外,与现代健康木材相比,因受环境和生物因子影响,考古木材细胞壁化学成分会发生改变,其热水抽提物和1%NaOH抽提物相对含量均显著提高,这些抽提物包含较多的多糖、多酚等成分(Gaoet al.,2014;袁诚等,2019),严重影响其DNA的有效提取。同时,在古DNA抽提过程中常有腐殖酸、无机沉积物或微生物代谢产物等成分也一并被提取出来,直接抑制下游反应。因此,考古木材样本粗提液通常需要进一步纯化,以获得较高质量的内源古DNA。目前DNA纯化方法主要包括溶剂萃取法和二氧化硅吸附法,溶剂萃取法即采用苯酚、氯仿、异戊醇等有机溶剂萃取抽提液中的多酚、蛋白质以及脂类等有机代谢产物后,通过超滤离心管对古DNA进行进一步浓缩纯化(Calvignacet al.,2008;Fuet al.,2014;Wagneret al.,2018;Kistleret al.,2020);二氧化硅吸附法则基于二氧化硅颗粒吸附核酸原理,将裂解液中古DNA与经修饰的二氧化硅磁珠表面高效结合,通过洗脱即可获得高质量的DNA提取液(Vaneket al.,2009;Gómez-Zeledónet al.,2017)。与溶剂萃取法相比,二氧化硅吸附法以单一方式将DNA固定在二氧化硅表面,对考古木材样品抽提液中抑制成分的去除更加彻底。
尽管古DNA提取与纯化已取得明显进展,但由于考古木材保存状态的不均匀性以及储存环境的复杂性和特殊性,仍需进一步探究并不断完善考古木材DNA提取方法。
3.3 木材古DNA杂交捕获
从木质遗存中获取的内源古DNA含量通常较低,难以采用聚合酶链式反应(PCR)技术进行有效扩增。随着高通量测序等分子生物学技术的不断发展,包括诱饵设计、总DNA获取、文库制备、杂交捕获、杂质DNA片段清除、高通量测序等流程在内的古DNA液相杂交捕获方法在古人类和古动物考古领域已取得突破(Fuet al.,2014;Orlandoet al.,2015;Wanget al.,2021)。其基本原理是通过生物素探针特异性“钓取”目标古DNA片段,再利用共价结合链霉亲和素的磁珠以生物素识别方式将古DNA片段吸附到磁珠上,然后完成目标古DNA洗脱以进行高通量测序(Orlandoet al.,2021)。
为降低古DNA末端损伤行为对序列信息误读的影响,在构建DNA文库前,一般采用USER酶处理方法,即尿嘧啶-DNA糖基化酶(uracil-DNA-glycosylase,UDG)与核酸内切酶VIII(endonuclease VIII)结合处理古DNA粗提取物,以通过去除尿嘧啶并切割产生的碱基位点的原理达到修复DNA损伤的目的(Burbanoet al.,2010)。然而该方法也存在负面效果,不仅缩短古DNA分子长度,同时其降解的典型特征也会被消除,给后续古DNA真实性验证带来难题。通过反应时间和尿嘧啶糖基化酶抑制剂(UGI)参数优化进一步形成的UDG-half方法,不但可去除绝大部分损伤,而且在DNA片段末端保留一个损伤性碱基(尿嘧啶),既有效修复了古DNA末端损伤,同时也为古DNA真实性验证提供了凭证(Orlandoet al., 2021)。此外常用于福尔马林固定石蜡包埋样本(FFPE)DNA修复的NEBNext FFPE DNA修复酶可有效去除长期存储样本线粒体DNA存在的化学损伤,修复后错误率从平均1.1%降至0.25%(Gordenet al.,2018)。因此,筛选适用于考古木材细胞中古DNA的修复酶种类以及优化反应时间、化学成分比例等方法参数,将有助于突破考古木材的古DNA末端损伤修复难题。
整体而言,目前针对植物古DNA的相关研究仍较少,2011年杂交捕获技术首次在玉米内源古DNA富集研究中得到应用(Ávila-Arcoset al.,2011),随后陆续在古代葫芦皮(Kistleret al.,2014)、亚化石针叶(Schmidet al.,2017)以及沉积物(Schulteet al.,2021)等研究中报道。在木材考古研究领域,古DNA杂交捕获技术成功实现了古建筑楠属木材DNA的有效提取,测序深度达27×~1 410×,突破了PCR技术难以实现低含量古DNA扩增和测序的瓶颈(Jiaoet al.,2022)。
4 木材古DNA数据处理和序列分析
以高通量测序为基础的古DNA分析会产生海量数据,需利用计算机科学和生物学等多学科交叉手段揭示高通量测序数据蕴含的生物学意义。然而,由于古DNA具有含量低、高度片段化、广泛损伤等典型特征,导致现代DNA数据分析手段和技术参数普遍难以参考和应用(Schuenemannet al.,2013)。
4.1 木材古DNA数据处理与真实性验证
分析木材古DNA测序数据前,应进行质量检测、数据处理和真实性评估等。以接头污染序列、碱基质量分数和未知碱基比例为指标的原始测序序列质控和数据过滤是古DNA质量检测的关键。关于数据处理,通常涉及去除测序接头和低质量序列、参考基因组比对、重复序列过滤和序列拼接等流程。AdapterRemoval和Samtools等生物分析方法是去除测序接头、低质量序列和DNA重复拷贝序列的重要手段(Renaudet al.,2014;Schubertet al.,2016)。由于古DNA片段长度短且外源DNA比例高,导致常用于现代DNA拼接的从头测序拼接(de novoSequence Assembly)方法在古DNA序列拼接中几乎无法实现(Schuenemannet al.,2013),普遍采用BWA(Burrows-Wheeler Aligner)方法将古DNA短片段序列与参考基因组进行比对和匹配,所有能匹配到参考基因组的内源DNA片段被保留,而外源DNA序列因无法匹配而被舍弃(Liet al.,2010;Langmeadet al.,2012)。同时,DNA损伤模式是古DNA真实性评估的关键指标。Jiao等(2022)通过BWA-bactrack算法实现了古建筑楠木样品DNA短片段(平均长度68~99 bp)的有效拼接,质体基因组测序覆盖度达90.09%~100%(137 663~152 805 bp)。近年来,随着BWA、mapDamage及PMDtools等生物信息学方法的不断完善,对古DNA数据的分析与挖掘研究已迈入新的发展阶段,为揭示考古木材DNA数据蕴含的生物学意义提供了新的机遇。
4.2 木材古DNA序列分析
获得科学可靠的木材古DNA序列后,一般基于系统发育树、主成分分析、群体遗传学等手段精准解析序列信息特征,进而通过分子标记方法实现木质文物用材树种的识别。加拿大动物学家Hebert等(2003)首次提出的DNA条形码分子标记方法目前已成功应用于生态学调查、濒危物种监管和保护、中草药资源与木材识别、法医鉴定、药物和食品市场监督等领域(高连明等,2012;周世良等,2015),然而通用DNA条形码普遍存在因信息位点缺乏导致对亲缘关系相近树种木材识别成功率低的问题(Jiaoet al.,2019)。基因组测序技术的发展让探索具有更高分辨率的分子标记甚至“基因组超级DNA条形码”成为可能(Liet al.,2015),借助BWA、遗传距离和单核苷酸多态性等方法可有效解析发生严重降解的考古木材DNA序列信息并阐明其种间变异规律,将为木质文物用材“种”的准确识别提供理论依据。
5 木材分子考古主要应用
木材考古研究与应用对象是考古发现的与古代人类生活直接或间接相关的木质遗存。通过考古发掘发现和分析木质遗存,深入挖掘木质文物蕴含的历史和自然信息,有助于进一步解读历史时期森林植被、环境气候与人类活动间的相互关系。
针对木质遗存的古DNA开展木材分子考古研究,是解读先民认知与利用森林资源方式的重要途径。明清时期被冠以“皇木”称谓的“楠木”,主要用于包括故宫等在内的皇家木结构宫殿营造,成为皇权与地位的象征。然而对《诗经》、《山海经》和《本草纲目》等历代典籍以及相关木质文物的研究表明,“楠木”的树种归属问题一直存在争议。通过探究代表性古楠木建筑用材,可为解读“楠木”树种归属提供新的认知。综合考古学、形态学、遗传学和生物信息学分析结果,确定21份故宫古建筑木构件“楠木”样本均为楠属木材,其中以楠木(Phoebe zhennan)和细叶楠(Phoebe hui)为主(90.48%),其余为闽楠(Phoebe bournei)和浙江楠(Phoebe chekiangensis)(Jiaoet al.,2022),研究结果为解读长期存在争议的“楠木”树种归属范围提供了新的见解,并为木质遗存的修复和保护提供了关键植物学信息。更重要的是,这充分表明在尚未形成系统的植物分类学框架条件下,我国先民亦能通过生产生活的经验智慧准确认知和掌握木材的类别及主要特性,并对其进行充分利用,体现了当时社会在林业、交通运输和建筑等方面的高度文明。
木材分子考古是复原历史时期地域性森林植被类型和物种多样性的重要方法。随着考古手段的不断发展,木质遗存考古发现数量显著增加。赵烨(2012)采用木材解剖方法解析良渚遗址群中出土木器最丰富的卞家山遗址所在地理区域的木本植被类型,确定当时该区域的森林植被类型以栎属、锥属(Castanopsis)、青冈属(Cyclobalanopsis)、樟属(Cinnamomum)等常绿阔叶树为主,以松属(Pinus)等针叶树为辅。木材分子考古学方法则突破了传统木材解剖学无法实现的“种”水平识别瓶颈,为木质遗存用材的精准识别提供了技术支撑(Wagneret al.,2018;Jiaoet al.,2022)。通过综合分子考古学、木材解剖学等方法手段,对木质遗存开展大尺度范围的种属鉴定,能够为重构历史时期地域性木本植物种类提供直接证据。
木材分子考古也是重建古代树木应对气候和生境变化微进化反应的重要手段。当前随时空演变的经典方法普遍依赖于花粉分布模式,但因受花粉百分比参数与周围植被盖度非线性关系等局限,区域性森林植被演化情况难以准确反映(李洁等,2013;戴璐等,2017)。而基于遗址考古木材和亚化石遗存的古DNA信息可从新的维度提供科学佐证。通过比较广泛分布于欧洲地域且大时间跨度(550~9 800年)的167份栎属饱水考古木材与现代居群之间叶绿体DNA单倍型的差异,可推测古代树木应对生境变化的微进化情况(Wagneret al.,2018)。高通量测序表明,来自瑞士和斯洛文尼亚的新石器时代遗址、德国和法国青铜时代遗址以及德国北部和法国北部的中世纪遗址且测序深度>5×的21个栎属考古木材样本,其叶绿体DNA单倍型与生长在同一地理区域的现代居群常见单倍型相匹配。考虑到叶绿体DNA基因组有限的进化速率,同时因缺乏细胞核DNA数据信息,单倍型分布范围内的跨区域流动等情况并不能被完全排除。因此,仅通过叶绿体DNA单倍型信息,仍不足以反映物种居群遗传结构的形成和演化时间。未来进一步加强对细胞核和叶绿体古DNA数据的筛选和综合分析,将有助于揭示时空维度下古DNA单倍型的变化规律,阐明古代树木物种遗传变异的空间分布模式,并应用于物种居群微进化历程的追溯和认知。
6 问题与建议
综上所述,古DNA因高度降解、含量极低和化学损伤特征导致其难于提取和信息解译仍是当前木材分子考古研究领域亟待突破的关键技术瓶颈。建议木材分子考古领域应围绕古DNA重点开展以下3方面研究:1) 建立考古木材标本库及其DNA信息数据库;2) 研究不同时空维度下木材古DNA损伤及变化规律;3) 构建稳定高效的木材古DNA提取及序列信息解译技术体系。在木材古DNA信息精准解译的基础上,通过加强木材分子考古等多学科交叉研究,进一步推动新理论、新方法、新技术在木材学和考古学领域的应用,为木质文物的用材树种识别、保护利用以及重建历史时期森林植被、环境气候与人类活动耦合关系提供重要科学依据。

