circRNA CPT1A调控PTEN在糖尿病视网膜病变患者神经组织病变中的作用△
尹 丹 韩莎莎 刘 颖 李跃峰 李 勇
糖尿病患者眼底发生特征性病变前,神经组织就已出现不同严重程度的损伤,且往往难以逆转,糖尿病视网膜病变(DR)患者神经组织病变情况已成为DR早期诊断的评价指标及治疗方向[1]。有研究表明[2],现有的治疗手段仍无法达到阻止视网膜神经病变或者修复、逆转神经组织损伤的目的,因此,深入研究DR患者神经组织病变的潜在机制对于指导药物研发具有重要价值。持续的高血糖状态引起的氧化应激损伤是DR患者神经组织病变的重要原因,磷酸酶-张力蛋白基因(PTEN)属于抑癌基因,具有双重磷酸酶活性,可维持细胞内氧化还原状态,保护细胞免受氧化应激损伤[3]。近年来,越来越多研究发现内源性环状RNA(circRNA)与多种神经退行性疾病密切关联,同时circRNA还参加代谢性疾病(高血糖、胰岛素抵抗)的发生、发展过程[4-5]。既往研究也证实[6],circRNA可在人胰岛中大量表达,并差异化调控血糖状态,而circRNA肉碱棕榈酰转移酶1A(CPT1A)基因异常高表达可增加代谢性疾病发生风险,且与空腹血糖呈正相关性,基于以上研究推测circRNA CPT1A可能在DR患者神经组织病变发生发展过程中存在调控作用。目前,有关circRNA CPT1A与PTEN、DR患者神经组织病变的关系,以及circRNA CPT1A调控疾病的机制尚未完全明确,因此,本研究将对此进行初步探讨。
1 资料与方法
1.1 临床资料与分组
选取我院2019年1月至2022年1月收治的2型糖尿病患者80例(102眼),其中无DR(NDR)患者22例(28眼)为NDR组,非增生型DR(NPDR)患者38例(48眼)为NPDR组,增生型DR(PDR)患者20例(26眼)为PDR组,年龄45~76(55.76±4.75)岁,男44例(48眼),女36例(54眼)。本研究已获得衡水市人民医院伦理委员会批准(批号:201903001)。
1.2 纳入与排除标准
纳入标准:(1)均为2型糖尿病患者;(2)眼压10~21 mmHg(1 kPa=7.5 mmHg),眼轴长度(AL) 22~25 mm,屈光度<±6.00 D;(3)能配合眼部相关检查,依从性较好;(4)资料完整。
排除标准:(1)合并老年性黄斑变性、青光眼、白内障等其他眼部疾病;(2)合并神经退行性疾病、心脑血管疾病等可影响视网膜神经改变的全身疾病;(3)既往眼部外伤史、眼部治疗史,如玻璃体内注射药物、激光光凝;(4)OCTA图像扫描质量指数(SQI)低于6;(5)屈光间质混浊,影响眼底检查。
1.3 方法
1.3.1 OCTA检查
3组患者入组后先采集外周静脉血,然后采用RTVue XR Avanti OCT仪(美国OptVue公司)扫描受检眼视盘和黄斑区,均由同一名经验丰富的眼科医师操作。HD Angio-Disc模式扫描,范围4.5 mm×4.5 mm,共3次,选取最佳清晰度图像进行保存。借助Angio HD Disc程序(版本号:Version 2017.1.0.155)计算视盘周围视网膜神经纤维层(pRNFL)厚度,包括整体、上半部分、下半部分。神经节细胞复合体(GCC)模式扫描,以黄斑中心凹为中心的6 mm×6 mm 区域,MCT软件测量黄斑GCC厚度,包括整体、上半部分、下半部分。GCC厚度指从内界膜至内丛状层边界的黄斑各层总平均厚度,上半部分、下半部分以水平子午线为分界的黄斑上半、下半部分区域[7]。pRNFL厚度指在视盘中心3.5 mm直径范围内的RNFL厚度。
1.3.2 患者外周血PTEN水平检测
采用Western blot法检测患者外周血circRNA CP1A,采集3组患者空腹肘静脉全血2 mL,共2管,置于抗凝管(乙二胺四乙酸二钾)中,其中1管采用RIPA裂解液提取总蛋白,SDS-PAGE凝胶上样、电泳分离,转移至PVDF膜,加入50 g·L-1脱脂奶粉室温封闭2 h,TBST缓冲液洗涤3次,加入兔抗人PTEN(1200,英国Abcam公司)一抗,4 ℃孵育过夜,TBST缓冲液洗涤3次,加入辣根过氧化物酶标记的羊抗兔二抗(11 000,武汉博士德生物工程公司)室温孵育1 h,洗涤3次,加入ECL发光液,凝胶成像系统采集图片,以GADPH为内参,分析蛋白条带灰度值,计算PTEN相对表达量。
1.3.3 患者外周血circRNA CPT1A水平检测
采用荧光定量聚合酶链式反应(PCR)法进行检测。全血中加入细胞裂解液,异硫氰酸胍-酚-氯仿法抽提总RNA,采用RNA 逆转录试剂盒(美国Takara科技有限公司)将RNA反转录成cDNA,并进行PCR扩增,以 GAPDH为内参基因。PCR扩增参数:94 ℃预变性40 s、92 ℃变性10 s、60 ℃退火60 s,72 ℃延伸30 s,共45个循环。以ABI 7500实时定量 PCR仪进行检测,建立PCR产物的熔解曲线,根据circRNA CPT1A与内参的Ct值计算相对表达量,以2-△△Ct表示,其中△△Ct=(Ct目的基因-Ct内参)-(Ct对照目的基因-Ct对照内参)。
1.4 统计学处理

2 结果
2.1 3组患者一般资料比较
3组患者性别、年龄、糖尿病病程、SQI比较差异均无统计学意义(均为P>0.05)(表1)。

表1 3组患者一般资料比较
2.2 3组患者外周血circRNA CPT1A、PTEN水平比较
3组患者外周血circRNA CPT1A、PTEN差异均有统计学意义(均为P<0.05)。其中PDR组患者外周血circRNA CPT1A均高于NDR组、NPDR组,而PTEN均低于NDR组、NPDR组(均为P<0.05)。NDR组与NPDR组患者外周血circRNA CPT1A、PTEN差异均无统计学意义(均为P>0.05)(表2)。

表2 3组患者外周血circRNA CPT1A、PTEN水平比较
2.3 患者外周血circRNA CPT1A与PTEN的相关性
Pearson相关性分析显示,患者外周血circRNA CPT1A与PTEN呈负相关性(r=-0.615,P<0.05)(图1)。
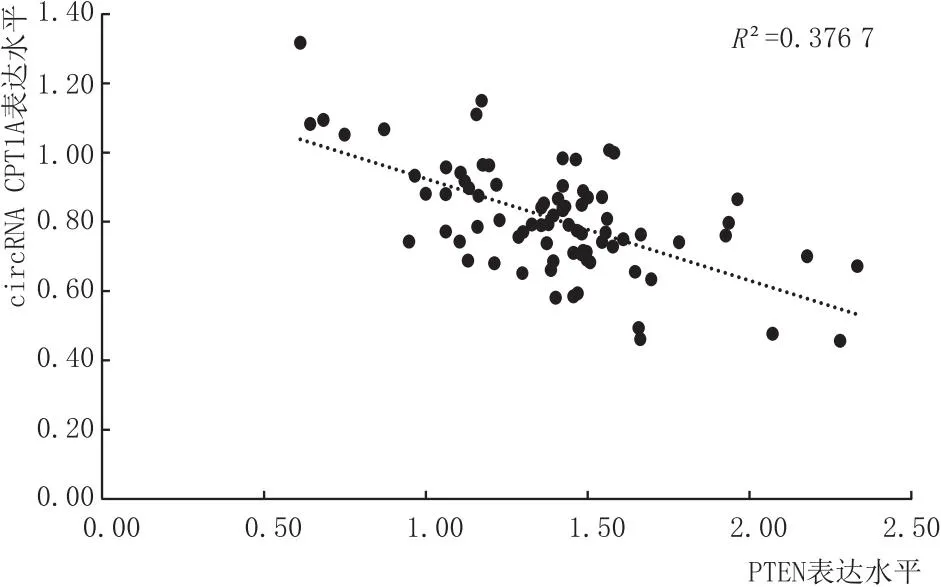
图1 患者外周血circRNA CPT1A与PTEN的相关性
2.4 3组患者受检眼神经组织病变相关指标比较
3组患者受检眼的整体、上半部分、下半部分pRNFL厚度以及GCC厚度差异均有统计学意义(均为P<0.05)。随着疾病严重程度的增加,pRNFL厚度以及GCC厚度均呈降低趋势,NDR组患者的整体、上半部分、下半部分pRNFL厚度以及GCC厚度均高于NPDR组(均为P<0.05);NPDR组患者以上指标均高于PDR组(均为P<0.05)(表3)。
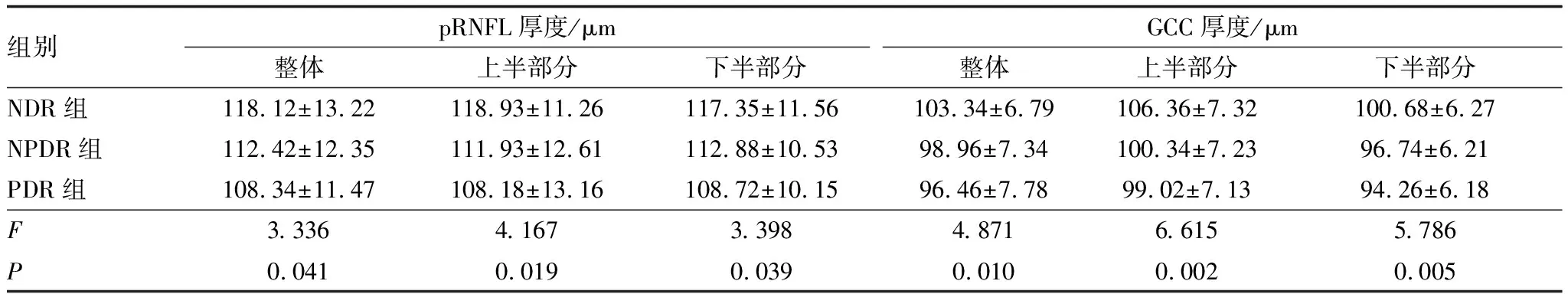
表3 3组患者受检眼神经组织病变相关指标比较
2.5 患者外周血circRNA CPT1A与受检眼神经组织病变相关指标的相关性
Pearson相关性分析结果显示,患者外周血circRNA CPT1A分别与受检眼的整体、上半部分、下半部分pRNFL厚度(r分别为-0.368、-0.506、-0.412)以及GCC厚度(r分别为-0.536、-0.624、-0.596)均呈负相关性(均为P<0.05)。
3 讨论
circRNA作为共价闭合环状转录物,已成为基因表达的新型调节因子,如可通过沉默circXPO5而调节GRIN2A的表达,从而在青光眼患者中发挥视神经保护作用,circRNA-ZNF532在DR、糖尿病性黄斑水肿等多种视网膜缺血性神经变性疾病中高表达,参与调控糖尿病诱导的视网膜周细胞病变以及血管功能[12-13]。circRNA在人类胰岛中表达量较多,与多种糖尿病相关疾病(妊娠糖尿病、DR)的发生密切关联,上调circPPM1F表达会活化M1巨噬细胞,进而损伤胰岛,上调circHIPK3表达则会引起高血糖、胰岛素抵抗。有研究表明[14],circRNA CPT1A基因高表达会增加代谢性疾病发生风险,而本研究中随着DR患者视网膜病变严重程度加重,外周血circRNA CPT1A呈增加趋势,进一步表明circRNA CPT1A与DR进展密切关联。同时,Pearson相关性分析结果显示,外周血circRNA CPT1A与受检眼的整体、上半部分、下半部分pRNFL厚度以及GCC厚度呈负相关性,表明circRNA CPT1A参与调控DR患者的神经组织病变过程。Ren等[15]研究证实,CPT1A基因与糖尿病的发生、发展密切关联,且其表达水平与空腹血糖呈正相关性,与HOMA-β呈负相关性,结合本研究结果进一步证实,circRNA CPT1A可通过影响血糖水平而参与DR的病理过程,circRNA CPT1A可作为治疗DR的潜在靶标。circRNA CPT1A参与糖尿病的发病过程[14],circRNA CPT1A通过诱导胰岛β细胞功能缺陷,进而诱发高血糖,且表达水平与空腹血糖呈正相关性。因此,基于以上研究可认为circRNA CPT1A可能通过影响血糖水平而参与DR的发生、发展,并诱发神经组织病变。
在高血糖患者中,血糖控制效果越差,氧化应激越强,则PTEN越低,PTEN缺失或者表达下降可引起糖尿病患者血管内皮细胞损伤,从而加重疾病进展[16]。有研究通过荧光素酶报告载体鉴定证实[17-18],miR-155可靶向调控PTEN,在ARPE-19细胞系中,上调miR-155表达可抑制细胞表达PTEN,进而诱导细胞发生上皮-间质转化,参与增生性玻璃体视网膜病变的发病过程,miR-29也能通过靶向PTEN的表达,从而调控高糖引起的人视网膜色素上皮细胞凋亡,以上研究表明,PTEN容易受到体内核酸物质的调控,且与糖尿病、视网膜病变的发生密切关联。本研究结果显示,PDR组患者的PTEN均低于NDR组、NPDR组(均为P<0.05),表明DR患者血糖控制效果越差,氧化应激越强,更容易发生视网膜神经病变。同时,Pearson相关分析结果显示,患者外周血circRNA CPT1A与PTEN呈负相关性,推测认为circRNA CPT1A可能通过下调PTEN表达而增加血管内皮细胞损伤程度,进而加重氧化应激反应,引起视网膜血管功能障碍以及神经炎症,最终参与DR患者的神经组织病变过程。本研究仍存在不足之处,其中对于circRNA CPT1A调控DR患者神经组织病变的具体过程仍需通过机制研究进一步论证,后续会开展双荧光素酶实验验证circRNA CPT1A与PTEN的靶向关系,并借助细胞、分子水平实验进行探讨。
4 结论
随着DR严重程度的增加,DR患者外周血circRNA CPT1A呈增加趋势,且与外周血PTEN、黄斑pRNFL厚度以及GCC厚度呈负相关性,其作用机制可能为circRNA CPT1A负性调控PTEN表达,从而参与DR的发生、发展。

