体重指数与视网膜中央动脉阻塞之间的因果关系:一项孟德尔随机研究△
刘 钊 周 丽 谢 仟 蔡善君
视网膜中央动脉阻塞(CRAO)是一种以突发性、非外伤性以及无痛性视力丧失为特征的眼科急症[1]。既往研究发现,动脉粥样硬化相关的血栓形成是引起CRAO最常见的原因,这与缺血性脑卒中的主要病因相同[2]。因此,大部分学者认为,CRAO属于缺血性脑卒中的眼部表现[3-4]。近期,Wang等[3]通过体重指数(BMI)评估肥胖并将其与缺血性脑卒中的发病风险相联系进行了荟萃分析,结果表明,随着BMI水平的升高,缺血性脑卒中的发病概率会同步升高。这表明了BMI在缺血性脑卒中发病过程中起到了重要作用。Shaikh等[4]
同样发现包括BMI、高血压、高龄、饮酒以及心脏瓣膜病等危险因素与CRAO的发生存在联系。这些研究证明了BMI与血管粥样硬化所导致的血栓形成之间存在联系,同样也说明了CRAO的发病与BMI密切相关。但是目前国内尚无大型随机对照研究系统性分析BMI与CRAO之间的关系,并且尽管随机对照试验是确定暴露与结果之间因果关系的黄金标准,但由于混杂因素和反向因果关系等,结果可能会出现偏差。孟德尔随机化(MR)分析是一种通过遗传工具变量(IVs)作为可能混淆或受反向因果关系影响暴露的工具,以评估暴露与结局之间的潜在关系[5]。既往已有国内外学者使用该方法对疾病及可能的危险因素进行分析,如较高的BMI、腰臀比和吸烟与糖尿病视网膜病变之间存在因果关系[6]。基于此特点,本研究通过MR分析将单核苷酸多态(SNP)作为IVs来探索暴露因素BMI和结局CRAO之间的关系。
1 数据来源与方法
1.1 数据来源
使用全基因组关联研究(GWAS)汇总统计数据,本研究进行了双样本MR分析,以探索BMI与CRAO之间的因果关系。在此MR设计中必须满足三个假设:(1)遗传工具可预测目标暴露(P<5×10-8);(2)遗传工具与潜在的混杂因素无关;(3)遗传工具仅通过目标暴露影响结局[5]。
本研究使用了综合流行病学单位公共可用数据(https://gwas.mrcieu.ac.uk/)的GWAS汇总数据,研究中暴露的遗传工具来自最近GWAS汇集的BMI数据,本研究将暴露的遗传工具分为了男性组(n=60 586,SNP=2 736 876,欧洲男性)与女性组(n=171 977,SNP=2 494 613,欧洲女性)。同时,本研究使用了FinnGen数据库(https://www.finngen.fi/en) 公共可用数据并纳入了CRAO患者数据(251例病例组,203 018例对照组,欧洲人群)作为结局。
1.2 IVs
IVs的筛查条件为:P<5×10-8,连锁不平衡(r2≤0.001),满足Hardy-Weinberg平衡,遗传距离<10 000 kb。收集每个IVs的主要等位基因、等位基因频率、β值、P值和标准误差[7]。同时,本研究计算了IVs的F值,确保F>10的IVs被纳入研究,以避免弱IVs所引起的偏移[8]。为避免提取SNP时相关协变量干扰最终结果,通过Phenoscanner平台对所有暴露SNP进行筛查。最终本研究男性暴露组纳入10个SNP,女性暴露组纳入37个SNP。
1.3 MR统计方法
在协调BMI与CRAO中的作用等位基因后,分别纳入10个与37个SNP。采用逆方差加权(IVW)、加权中位数(WM)、MR-Egger回归分析BMI与CRAO的因果关系,以提高分析结果的可靠性[9-10]。由于IVW的统计能力要远远高于其他两种方法[11-12]。因此,本研究中,IVW是判断BMI与CRAO之间联系的主要方法,当P<0.05时证明暴露因素BMI与结局CRAO之间存在因果关系[13]。
1.4 敏感性分析
采用Q统计量的P值判断结果是否存在异质性,当异质性检验结果P≥0.05时,认为因果分析不存在异质性[14]。绘制漏斗图检测异质性,当SNP分布对称时表示结果不存在异质性[15]。多效性评估通过散点图中MR-Egger回归截距确定,当截距为0时提示研究存在多效性[14-15]。此外,为评估每个SNP的影响,使用“留一法”分析计算每个SNP的综合影响[16]。
2 结果
2.1 MR分析
IVW分析结果显示,随着BMI水平升高,男性、女性患CRAO的风险均增加(男性:OR=4.57,95%CI为1.32~15.82,P=0.016;女性:OR=3.48,95%CI为1.40~8.63,P=0.007)。利用WM与MR-Egger回归对女性暴露组分析后发现,无论WM(OR=4.75,95%CI为1.20~18.75,P=0.025)还是MR-Egger回归 (OR=10.63,95 %CI为0.93~121.38,P=0.065),其计算结果的方向是相同的,且该结果与森林图相吻合。因此,虽然MR-Egger回归的估计值不显著,但仍可以证明对于女性而言,BMI水平的升高与CRAO的发生呈正相关。对于男性暴露组而言,WM(OR=4.69,95%CI为0.91~24.06,P=0.063)和MR-Egger回归(OR=7.40,95%CI为0.08~654.76,P=0.400)分析的结果同样显示与IVW相同的方向,尽管两者的估计值不显著,但其估计的方向是一致的。同时,由于IVW的结果也是最有判断价值的,且该结果与森林图相吻合,因此,同样可以认为BMI水平升高与男性发生CRAO的概率呈正相关(图1)。
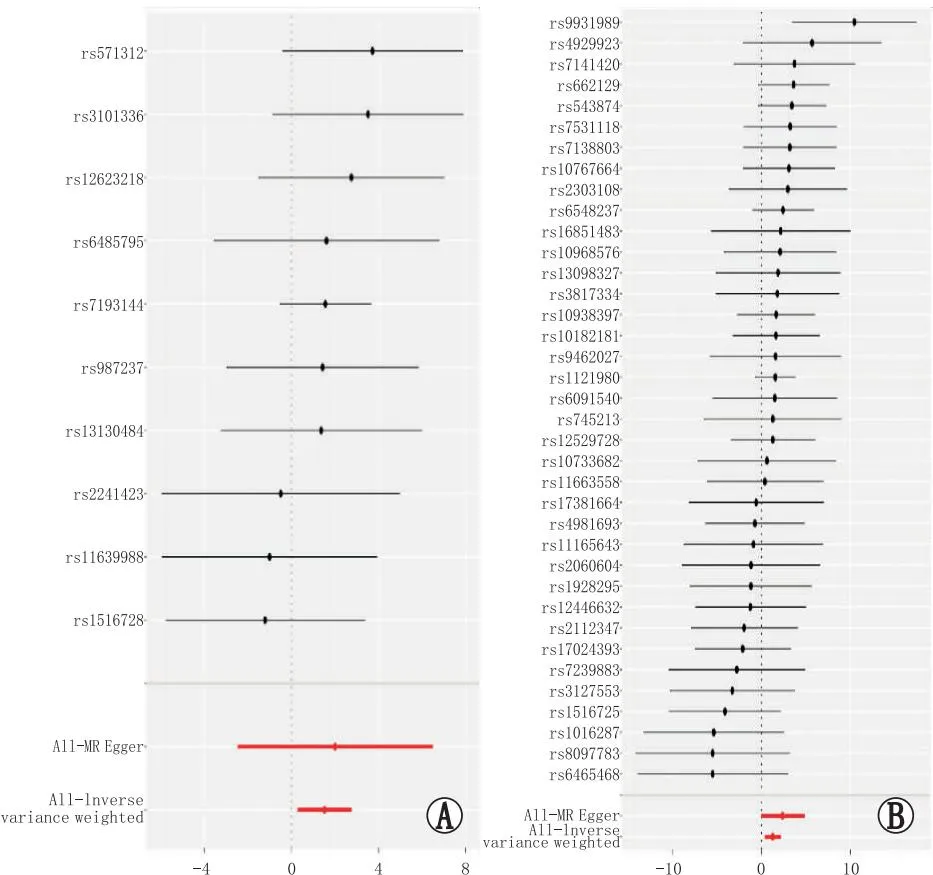
A:男性;B:女性。
2.2 敏感性分析
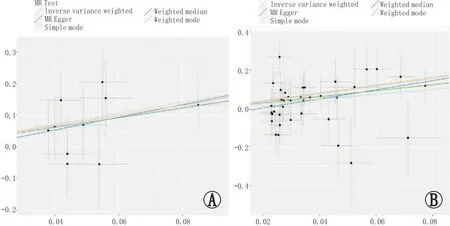
为了评估分析结果的有效性,本研究进行了敏感性分析,结果发现,对于男性暴露组而言,无论是IVW (Q=5.12,P=0.82)还是MR-Egger回归(Q=5.08,P=0.74)分析结果均未出现异质性。同样地,对于女性暴露组而言,无论是IVW(Q=31.85,P=0.66)还是MR-Egger回归(Q=30.92,P=0.66)分析结果也均未出现异质性。多效性检测结果显示,无论男性暴露组(intercept=-0.026,P=0.83)或是女性暴露组(intercept=-0.043,P=0.34)均不存在多效性。此外,散点图与漏斗图同样证明了上述结果(图2、图3)。“留一法”敏感性分析结果表明,在依次剔除暴露的每个SNP后,剩余SNP没有对结果产生显著影响(图4)。
A:男性;B:女性。

A:男性;B:女性。

A:男性;B:女性。
3 讨论
基于大规模GWAS数据,本研究揭示了BMI升高可能促进CRAO的发生。具体而言,无论是男性暴露组或是女性暴露组的分析结果均证明了上述结果。基于MR分析特点,本研究结果不容易受到偏倚和反向因果关系的影响,这有助于更好地了解BMI与CRAO之间的联系。
CRAO是由视网膜中央动脉突然阻塞引起的,通常表现为突然的、无痛的单眼视力丧失[1]。由于CRAO患者整体自发视力恢复的预后较低,93.2%的患者视力仅数指或更差[17]。因此,对于CRAO的预防及预测显得尤为重要。虽然目前尚无研究阐明CRAO的具体发病机制,但是作为缺血性脑卒中的一种,CRAO的发病机制与其他缺血性脑卒中的发病机制之间有着很多相似之处。既往已有研究证明了动脉粥样硬化所引起的血栓形成是CRAO发病的主要原因[18],同时,Wang等[3]的荟萃分析结果证明了BMI的升高可能引起动脉粥样硬化从而导致缺血型脑卒中的发生。除此之外,Strazzullo等[19]的荟萃分析结果显示,肥胖与缺血性脑卒中的患病风险增加有关。Hu等[20]的研究发现,BMI>30 kg·m-2组患者发生缺血性脑卒中的风险是BMI<23 kg·m-2组患者的1.95倍,BMI每增加1 kg·m-2,缺血性脑卒中风险增加4%。这些研究都间接证明了BMI的升高可能会通过引起动脉粥样硬化促进CRAO的发生。由于所选用数据集中并未提及具体BMI范围,因此本研究结论仅适用于广义的BMI升高(BMI≥24 kg·m-2),具体的BMI阈值尚需要进一步研究确定。结合既往研究结果我们认为,肥胖可能通过促进血管内皮细胞功能障碍以及胰岛素抵抗来引起动脉粥样硬化,促使血栓形成,进而导致动脉栓塞。然而,需要强调的是,这并不代表肥胖是促进CRAO发生的唯一因素,不能忽视其他潜在的影响因素。
本研究通过MR分析并探索BMI与CRAO发病之间可能的联系。研究的结果表明,随着BMI的增加,CRAO发病的风险也会增加,这表明降低BMI可以作为预防CRAO的干预指标。因此,应该鼓励BMI异常的人积极控制体重,且无论男性或是女性均可通过BMI来预测其发生CRAO的概率。此外,建议对BMI水平高的无症状者进行眼底筛查以早期预防眼底血管相关性疾病。
4 结论
本研究证明了BMI升高与CRAO发生呈正相关,为BMI升高的无症状者提供了有效的CRAO预防策略。考虑到CRAO患者的高致盲率,认识和控制CRAO的危险因素对降低其患病率具有重要意义。

