基于网络药理学和实验验证探讨血府逐瘀汤治疗特发性肺纤维化的作用机制
林 景,莫俊俏,宋 艳,周 欣,黎咏嫦
(1.海南省第五人民医院,海南 海口 570100; 2.海南医学院,海南 海口 571199; 3.广西中医药大学,广西 南宁 530000)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性、不可逆性肺间质纤维化疾病,可引起肺组织结构改变和功能丧失,最终导致患者死亡。IPF 的发病率约为0.22/100 000~17.4/100 000 人[1],而患者中位生存期仅为3~5 年[2-3]。目前,IPF 的具体发病机制尚未完全明确,但已证实,病毒感染是导致IPF 发病和病情进展的主要原因[4]。现阶段可用于IPF 临床治疗的手段非常有限,目前经FDA 批准可用于IPF 治疗的药物仅有吡非尼酮和尼达尼布,但只能延缓病情进展,并不能阻止或逆转IPF 的病理改变,是一种姑息性治疗[5]。因此,深入研究IPF 的发病机制,探索有效的治疗药物,对于IPF 患者的临床治疗具有重要意义。
IPF 临床表现符合中医学“肺痹” 等范畴,血瘀和气虚是其主要病机为[6]。血府逐瘀汤为中医经典名方,具有活血化瘀、行气止痛之功效。已有临床研究表明,采用血府逐瘀汤联合西药治疗IPF 可取得较好的临床疗效[7-8]。然而,目前关于血府逐瘀汤治疗IPF 的分子机制仅限于针对某一靶点或通路的动物或细胞实验研究,缺乏系统、全面和多靶点作用机制的认识。本研究采用网络药理学方法预测血府逐瘀汤治疗IPF 的分子作用机制,并进一步通过动物实验对其进行验证,以期为今后的临床和基础实验提供新的思路。
1 材料与方法
1.1 数据库和软件 本研究过程中所使用或涉及的数据库和软件详见表1。其中,软件运行于Window10 64 位操作系统平台,处理器为Intel® CoreTMi5-7500。本研究中使用的所有软件均以获得授权或为开源软件。
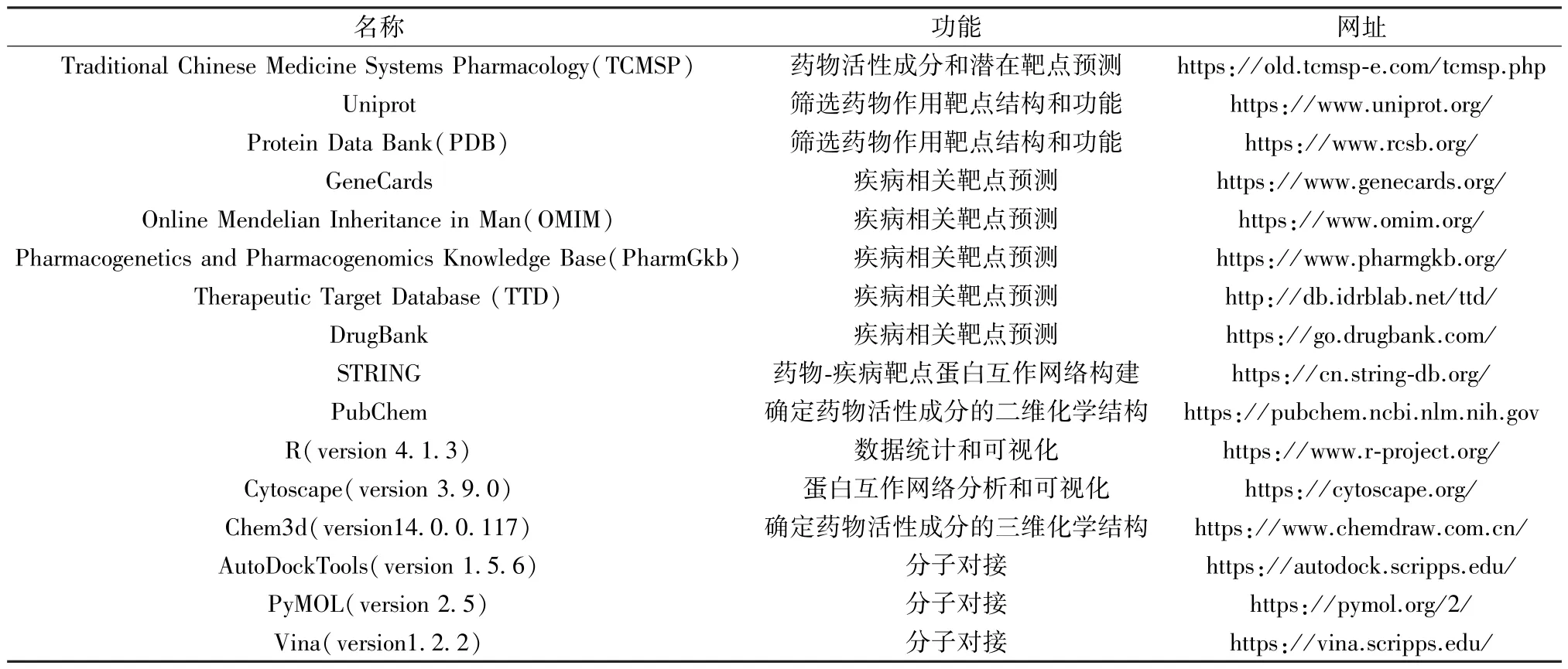
表1 数据库和软件
1.2 血府逐瘀汤潜在活性成分获取和作用靶点预测 血府逐瘀汤中桃仁、红花、当归、生地黄、牛膝、川芎、桔梗、赤芍、枳壳、甘草和柴胡11 味中药的化学成分筛选主要通过2 个途径: ①从TCMSP 数据库查询上述中药的主要化学成分,并根据药代动力学参数,筛选口服生物利用度(oral bioavailability,OB) ≥30%,且药物相似性(drug-likeness,DL) ≥0.18 的化学成分; ②以“血府逐瘀汤” 和“Xuefu Zhuyu Decoction” 作为关键词检索中国知网(CNKI) 和美国国家生物技术信息中心(NCBI) 相关文献,搜索并整理血府逐瘀汤水煎剂中相关活性成分。同时,在TCMSP 数据库中检索上述药物活性成分相应的作用靶点。
1.3 IPF 疾病相关靶点筛选 在GeneCards、OMIM、PharmGkb、TTD 和DrugBank 数据库中,以 “idiopathic pulmonary fibrosis” 和“IPF” 为检测词进行检索,取5 个数据库的并集靶点作为IPF 的疾病靶点。使用R 软件“Venn” 包对查询结果进行可视化处理。
1.4 血府逐瘀汤潜在活性成分-靶点调控网络及蛋白互作网络构建 将“1.2” 项下筛选得到的血府逐瘀汤潜在活性成分作用靶点与“1.3” 项下查询得到的IPF 疾病靶点进行交集,获得血府逐瘀汤治疗IPF 的关键靶点,并建立血府逐瘀汤潜在活性成分-靶点调控网络,同时将这些关键靶点导入STRING 数据库中,选择物种“Homosapiens”,将各节点置信度得分设置为≥0.9,同时删除游离节点,构建蛋白质-蛋白质相互作用网络(PPI),并以“tsv” 文件输出。
1.5 血府逐瘀汤治疗IPF 关键靶点的拓扑分析 将“1.4”项下STRING 数据库输出的“tsv” 文件导入Cytoscape 软件,通过CytoNCA 插件计算各靶点Betweenness、Closeness、Degree、Eigenvector、LAC 和Network 6 个拓扑性质参数及其中位值,以6 个拓扑性质参数均大于中位值作为筛选条件建立子网络,再以相同的方法对子网络进行一次拓扑分析,得到核心网络和靶点。
1.6 GO 和KEGG 分析 首先,使用R 语言“org.Hs.eg.db” 包将最终核心网络中的靶点基因名称转换为可识别的entrez ID; 然后,调用“clusterProfiler” 包对关键靶点进行基因本体(GO) 功能分析和京都基因与基因组百科全书(KEGG) 通路富集分析; 最后,通过 “ggplot2” 和“enrichplot” 包对分析结果进行可视化处理。
1.7 分子对接 对核心网络中的靶点按照Degree 值(连接节点数) 进行排序,将排名前10 位的靶点在血府逐瘀汤化学成分-靶点调控网络中找出相对应的活性化学成分,进行分子对接,以验证药物作用的可能性。从PDB 数据库获得关键靶点蛋白的三维结构,从PubChem 数据库查询活性化学成分的三维结构,并通过Chem3D 软件对化学结构的自由能进行优化。采用AutoDockTools、PyMOL 和Vina 软件进行分子对接。
1.8 实验验证
1.8.1 实验动物 60 只6~8 周龄无特定病原体级雄性SD大鼠,由广西医科大学实验中心提供,体质量(253.18±5.37) g,实验动物使用许可证号SYXK (桂) 2020-0004,实验动物生产许可证号SCXK (桂) 2020-0003。实验过程中予以自由食水,保持环境温度 (21±2)℃,相对湿度50% ~60%,昼夜明暗交替12 h。本研究动物实验过程经广西中医药大学实验动物福利伦理委员会审查通过(伦理号2110002)。
1.8.2 药物、试剂和仪器 血府逐瘀汤中的11 种中药材(桃仁、红花、当归、生地黄、牛膝、川芎、桔梗、赤芍、枳壳、甘草和柴胡) 均由广西中医药大学第一附属医院提供。博来霉素(瀚晖制药有限公司,批号210367); 吡非尼酮(北京凯因科技股份有限公司,批号211109); 多聚甲醛溶液、Masson 三色染色试剂盒、苏木素伊红染色试剂盒(南京森贝伽生物科技有限公司,批号2012664、2109321、2101339); 羟脯氨酸ELISA 检测试剂盒(上海研尊生物科技有限公司,批号19112589); 磷酸化信号转导和转录激活因子3 抗体(STAT3)、磷酸化丝裂原活化蛋白激酶(ERK) 抗体、Toll 样受体3 (TLR3) 抗体(上海雅吉生物科技有限公司,批号2011339、2009653、2112554);RIPA 裂解液、SDS-PAGE 蛋白上样缓冲液、5% 脱脂奶粉(北京伊塔生物科技有限公司,批号2109338、2110275、21114458)。全波长酶标仪(南京德铁实验设备有限公司);蛋白质印迹分子成像系统(美国Azure Biosystems 公司);冰冻切片机(深圳市瑞沃德生命科技有限公司)。
1.8.3 血府逐瘀汤水煎液制备 血府逐瘀汤由桃仁12 g,红花、当归、生地黄、牛膝各9 g,川芎、桔梗各4.5 g,赤芍、枳壳、甘草各6 g,柴胡3 g 组成。将上述75 g 药材加0.9 L 水浸泡30 min,武火煮沸后文火煎煮1 h,过滤药液,药渣加清水0.75 L,武火煮沸后继续文火煎煮1 h,过滤药液,将2 次煎煮药液混合、过滤,并减压浓缩为生药量9.0 g/mL 的水煎液[9]。
1.8.4 分组、造模与给药 将60 只大鼠适应性饲养3 d,按照体质量随机分为正常组、模型组、吡非尼酮组和血府逐瘀汤低、中、高剂量组,每组10 只。除正常组外,其余各组采用多次雾化吸入博莱霉素法造模,具体方法为博莱霉素(60 g/L) 吸入30 min,连续3 d[10]。造模后次日,正常组和模型组给予以0.9%氯化钠注射液灌胃; 吡非尼酮组给予吡非尼酮50 mg/kg 灌胃,每天2 次; 血府逐瘀汤低、中、高剂量组剂量参考Meng 等[9]研究,分别给予3.9、7.8、15.6 g/kg 血府逐瘀汤水煎液进行灌胃,每天1 次,持续给药21 d。于末次灌胃3 h 后以颈椎离断法处死大鼠,取所有大鼠右肺下叶于4%多聚甲醛固定液中固定,其余肺组织经液氮快速冷冻,置于-80 ℃超低温冰箱保存备用。
1.8.5 组织病理学检测 取固定于4%多聚甲醛中的大鼠肺下叶组织,常规脱色和石蜡包埋,纯净水冲洗过夜,并由梯度乙醇脱水,经二甲苯透明,浸蜡、包埋,于4 ℃冰箱保存过夜,取出包埋组织以5 μm 厚度切片,具体染色步骤按照试剂盒说明书进行,染色结束后中性树胶封片,于光学显微镜下观察HE 染色的肺泡炎症反应程度及Masson染色的胶原增殖情况,并参考Szapiel 等[11]研究,对HE 和Masson 染色结果进行半定量评分。具体方法为根据肺组织肺泡充血、出血、粒细胞浸润聚集或肺泡间隔增厚等情况对HE 染色结果进行评分,以评价肺组织的炎性反应程度;同时根据肺组织蓝色胶原沉积情况对Masson 染色结果进行评分,评分均为0~5 分,其中0 分代表正常,1~5 分分别定义为每1 个高倍视野下炎症病变或蓝色胶原沉积范围≤10%、10% ~30%、30% ~50%、50% ~80%、>80%。
1.8.6 羟脯氨酸水平检测 采用酶联免疫吸附法对大鼠肺组织的羟脯氨酸水平进行检测,检测试剂盒由深圳子科生物科技有限公司提供,具体步骤为称取大鼠肺组织30 mg,以匀浆器将其充分匀浆,3 000 r/min 离心20 min,收集上清液,同时配制不同浓度标准品用于绘制标准曲线。将标准液和待测样品置于羟脯氨酸酶标板中,上机后先后加入试剂盒中的抗体工作液、底物工作液和终止液,并在450 nm波长处检测吸光度,根据标准曲线计算羟脯氨酸水平。
1.8.7 蛋白质免疫印迹法检测STAT3、ERK 和TLR3 蛋白表达 取适量肺组织于冰上剪碎后加入RIPA 裂解液进行裂解,12 000 r/min 离心10 min,取上清液,采用BCA 法对蛋白质进行定量。将制得的蛋白质样品按照每孔上样量为40 μg 进行蛋白质凝胶电泳实验,转膜后以5%脱脂奶粉溶液封闭2 h,洗膜后,根据说明书加入目的蛋白一抗和内参GAPDH 一抗,4 ℃孵育过夜,再次洗膜后,加入HRP 标记的二抗,37 ℃孵育1 h。通过ECL 高敏发光液进行显影,胶片曝光,采用凝胶成像系统分析目的蛋白和内参GAPDH蛋白灰度值的比值,以该比值作为目的蛋白的相对表达量。
1.8.8 统计学分析 通过SPSS 软件进行处理,计量资料以(±s) 表示,组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 血府逐瘀汤治疗IPF 的关键靶点分析 查询TCMSP数据库,检索出符合筛选标准的血府逐瘀汤11 味中药潜在活性成分共计197 种。通过检索CNKI 和NCBI 数据库,检索到4 篇血府逐瘀汤活性成分的文献研究[12-14],共得到54种活性成分。将2 种检索方式得到的血府逐瘀汤活性成分进行合并,删除重复成分后,共计得到血府逐瘀汤活性化学成分237 种,相应作用靶点236 个。
从GeneCards、OMIM、PharmGkb、TTD 和DrugBank 数据库检索IPF 疾病相关靶点共计3 395 个(图1A),与血府逐瘀汤各味中药潜在活性成分对应的236 个作用靶点取交集后,共获得175 个关键靶点(图1B)。

图1 IPF 疾病相关靶点(A) 和血府逐瘀汤治疗IPF 的关键靶点(B) 预测
2.2 血府逐瘀汤潜在活性成分-靶点调控网络模型构建 将175 个关键靶点通过Cytoscape 软件建立血府逐瘀汤潜在活性成分-靶点调控网络。由图2 可知,血府逐瘀汤中化学成分槲皮素(MOL000098) 作用的靶点最多,共计110 个,其次为木犀草素(MOL000006) 和山柰酚(MOL000422) 分别有42、38 个。而在交集靶点中,受到血府逐瘀汤中化学成分作用最多的靶点为PTGS2,共计有127 种化学成分可作用于该靶点,其次为ESR1 和HSP90AA1,分别有90、86 个。
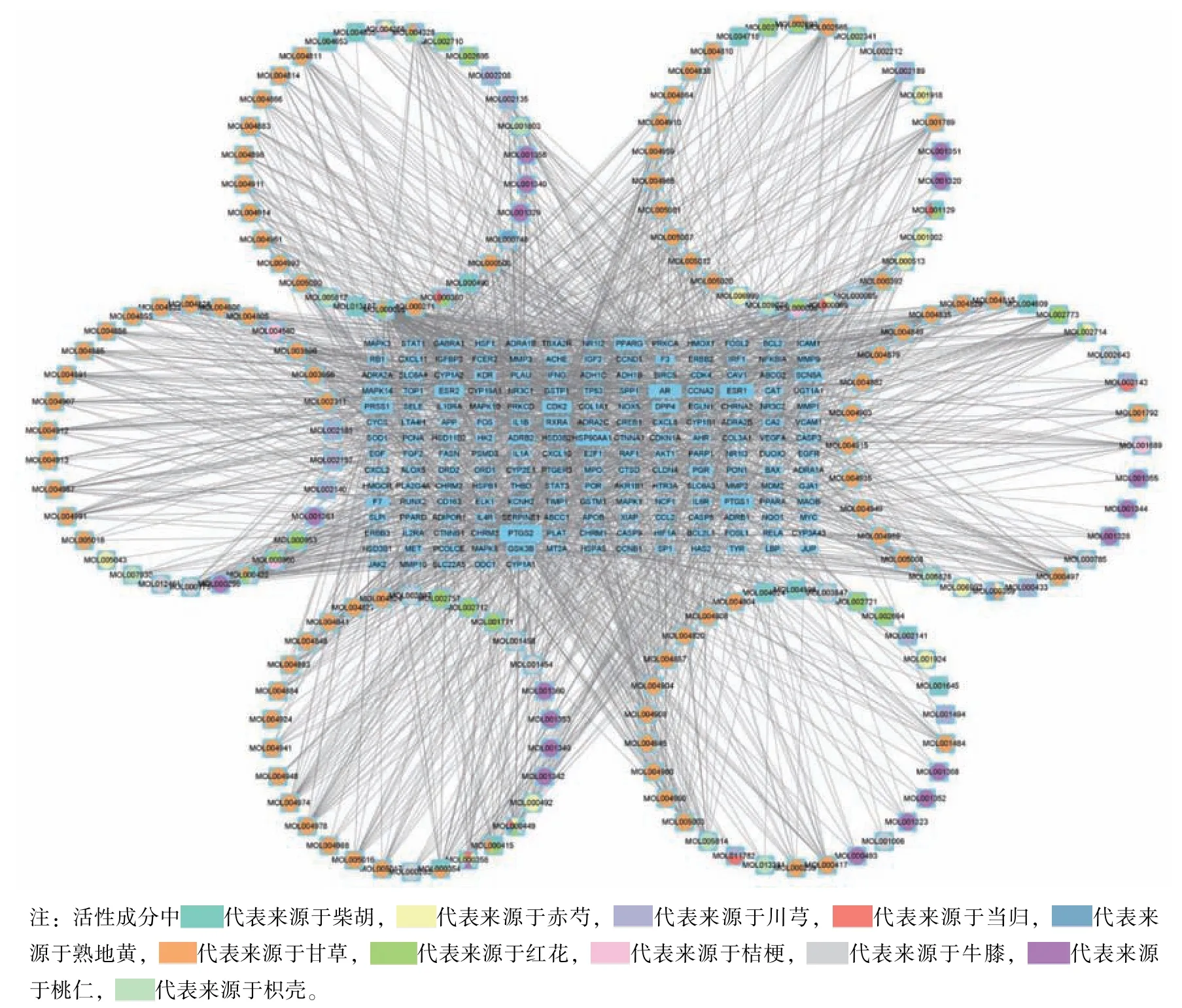
图2 血府逐瘀汤化潜在活性成分-靶点调控网络
2.3 血府逐瘀汤治疗IPF 核心靶点的筛选 基于关键靶点在STRING 数据库建立PPI 网络,于Cytoscape 软件中导出网络图 (图3A),使用Cyto NCA 插件计算各靶点的Betweenness、Closeness、Degree、Eigenvector、LAC、Network的中位值分别为55.20、0.09、12.00、0.03、4.00、5.04,得到所有参数值均大于中位值的靶点共计46 个,并建立子网络(图3B); 再次计算子网络各靶点的上述拓扑性质参数中位值分别为16.50、0.56、24.00、0.13、11.11、12.24,得到所有参数值均大于中位值的靶点共计20 个,以该20 个靶点作为核心靶点并建立核心网络(图3C)。
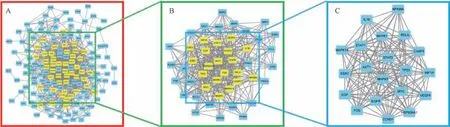
图3 血府逐瘀汤治疗IPF 核心靶点的筛选
2.4 GO 和KEGG 通路分析 将核心网络中的20 个靶点进行GO [包括分子生物学过程(biological process,BP)、分子功能 (molecular function,MF) 及细胞成分 (cellular component,CC) ] 和KEGG 通路富集分析,以P<0.05 为筛选标准,并以升序进行排列,分别取前10 和30 位进行分析。GO 富集分析表明,在生物学进程、分子功能和细胞成分上,核心靶点基因主要富集于DNA-结合转录因子活性的调控 ( regulation of DNA-binding transcription factor activity)、磷酸酶结合 (phosphatase binding) 和囊泡腔(vesicle lumen) 上(图4A)。KEGG 富集分析表明,在20个核心靶点基因中,有15 个基因富集于Kaposi’s 肉瘤相关疱疹病毒感染 ( Kaposi sarcoma-associated herpes virus infection) 通路,是富集最多的通路,其次分别为人类巨细胞病毒感染(human cytomegalovirus infection) 和丙型肝炎病毒(hepatitis C) 通路,分别有14 和13 个核心靶点基因富集(图4B)。

图4 血府逐瘀汤治疗IPF 关键靶点的GO (A) 和KEGG 通路(B) 富集分析
2.5 分子对接 将核心靶点按照Degree 值进行排名,取排名前10 位的靶点与相应的血府逐瘀汤化学成分进行分子对接。表2 为靶点蛋白与潜在活性成分对接结果,由此可知,各靶点蛋白与血府逐瘀汤中潜在活性成分的最低结合能均小于-5.0 kcal/mol。经可视化处理后发现,上述靶点和活性化学成分可自发结合,并可借助氢键等分子间作用力形成较为稳定的构象,见图5。

图5 分子对接模式示意图

表2 部分核心靶点蛋白与血府逐瘀汤潜在活性成分的分子对接结果
2.6 血府逐瘀汤对IPF 大鼠肺组织肺泡炎症和纤维化程度的影响 由图6、表3 可知,与正常组比较,模型组大鼠肺泡中出现大量炎性细胞浸润和蓝色胶原沉积,且HE 和Masson 染色评分均升高(P<0.01); 与模型组比较,吡非尼酮组和血府逐瘀汤各剂量组大鼠肺泡炎性细胞浸润程度缓解,蓝色胶原沉积减少,且HE 和Masson 染色评分均降低(P<0.01)。
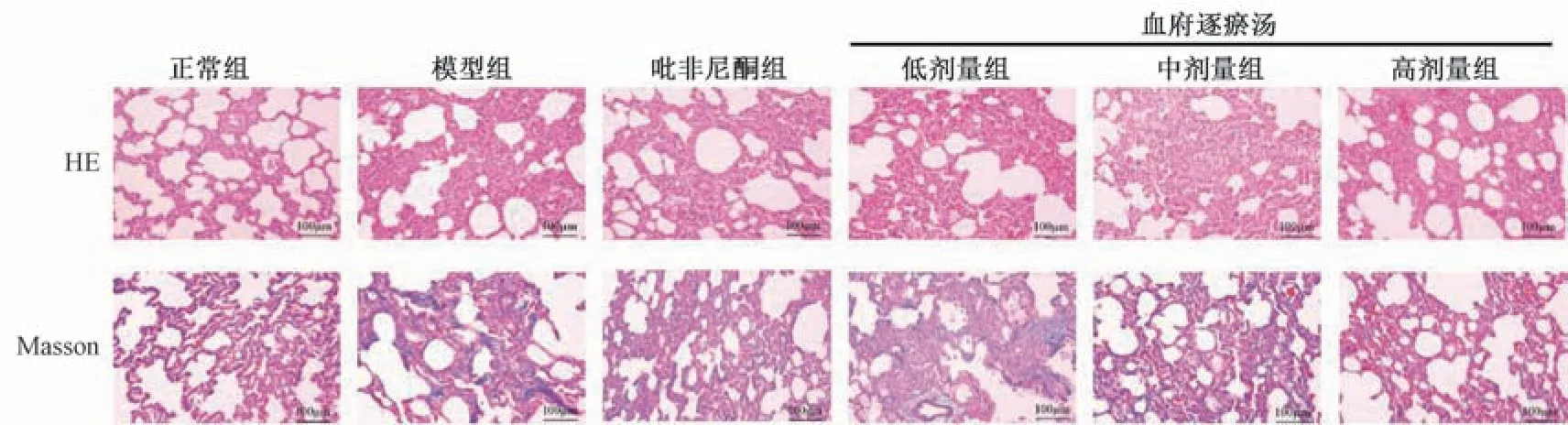
图6 各组大鼠肺组织HE 和Masson 染色(×400)
表3 各组大鼠HE 和Masson 染色评分比较(±s,n=10)

表3 各组大鼠HE 和Masson 染色评分比较(±s,n=10)
注: 与正常组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别剂量/(g·kg-1)HE 染色评分/分Masson 染色评分/分正常组—0.00±0.000.00+0.00模型组—3.61±0.51∗∗3.60±0.60∗∗吡非尼酮组0.052.23±0.28##2.35±0.35##血府逐瘀汤低剂量组3.92.50±0.48##2.41±0.62##血府逐瘀汤中剂量组7.81.88±0.45##2.00±0.43##血府逐瘀汤高剂量组15.61.72±0.34##1.55±0.19##
羟脯氨酸为胶原蛋白中的特有成分,是目前用于评价肺组织纤维程度的重要指标[15]。由图7 可知,与正常组比较,模型组大鼠肺组织羟脯氨酸水平升高(P<0.01); 与模型组比较,吡非尼酮组和血府逐瘀汤高剂量组大鼠肺组织羟脯氨酸水平降低(P<0.01)。
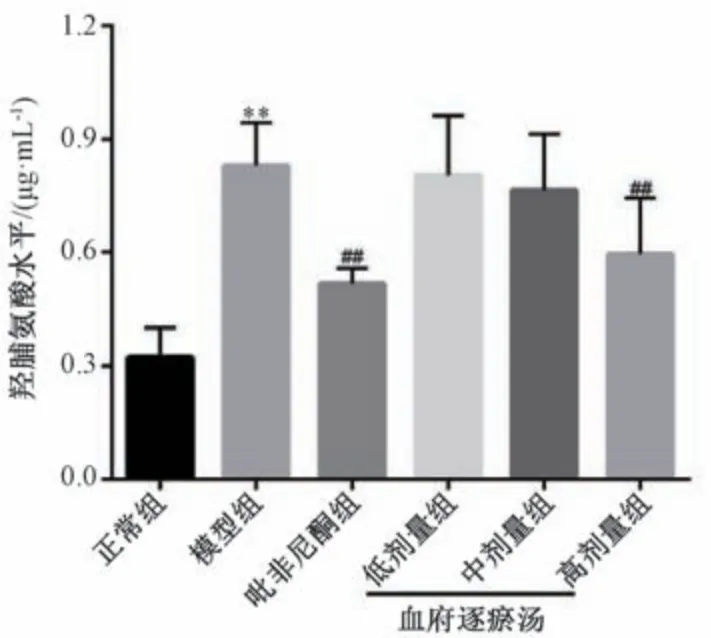
图7 血府逐瘀汤对大鼠肺组织羟脯氨酸水平的影响(±s,n=10)
2.7 血府逐瘀汤对IPF 大鼠肺组织Kaposi’s 肉瘤相关疱疹病毒感染信号通路中关键蛋白表达的影响 由图8 可知,与正常组比较,模型组大鼠肺组织STAT3、ERK 和TLR3 蛋白表达升高(P<0.01); 与模型组比较,吡非尼酮组和血府逐瘀汤各剂量组大鼠肺组织STAT3、ERK 和TLR3 蛋白表达表达降低(P<0.05,P<0.01)。
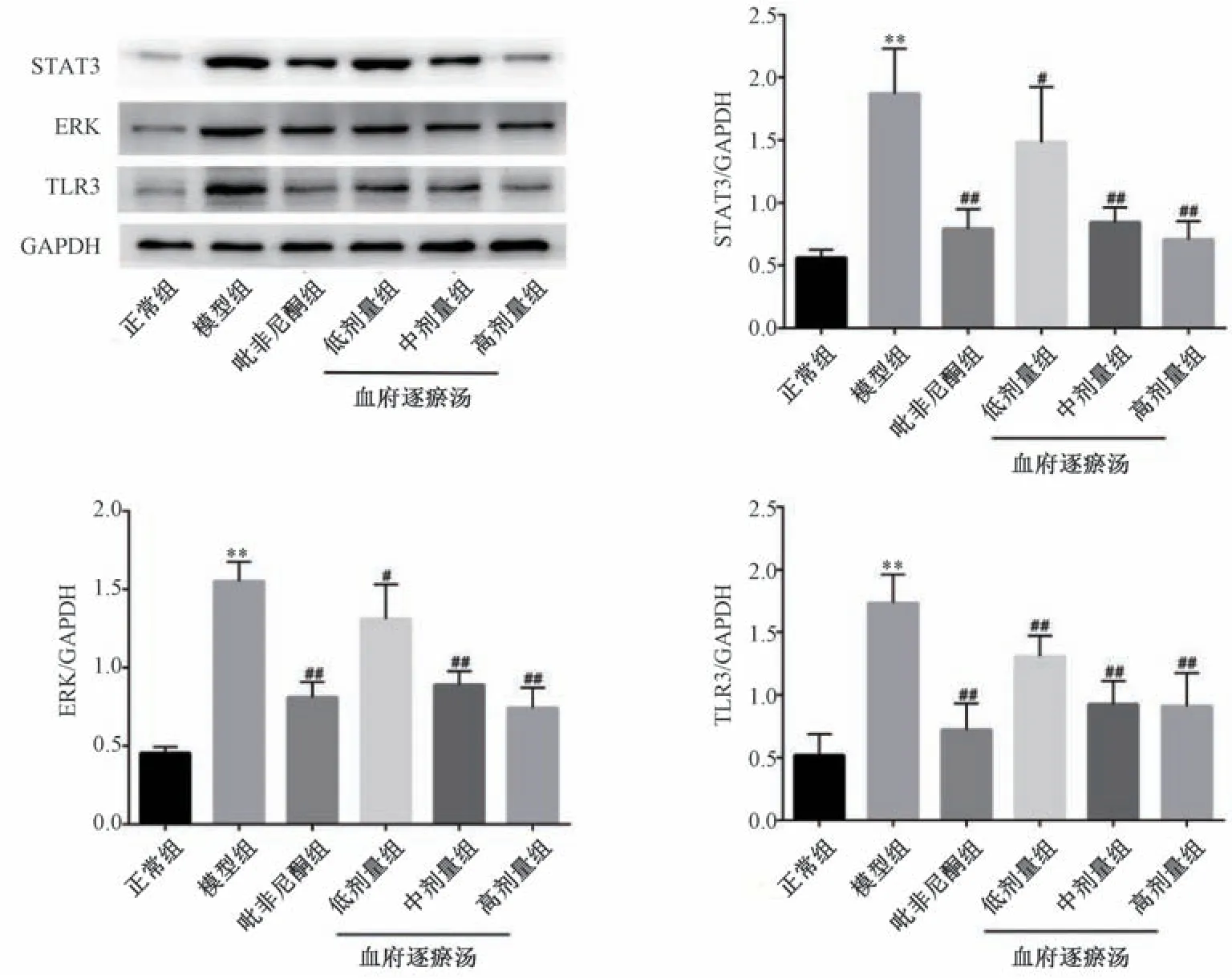
图8 血府逐瘀汤对大鼠肺组织STAT3、ERK 和TLR3 蛋白表达的影响(±s,n=10)
3 讨论
通过网络药理学分析,本研究共获得血府逐瘀汤治疗IPF 的175 个关键靶点。由活性成分-靶点调控网络模型可知,作用于IPF 靶点的主要活性成分为槲皮素和木犀草素,提示上述化合物可能在血府逐瘀汤抗肺纤维化的过程中发挥重要作用。研究发现,成纤维细胞衰老是IPF 的主要分子机制,而槲皮素可以通过上调FasL 和caveolin-1 表达,抑制Akt 活化,增强成纤维细胞衰老和凋亡的抵抗力,从而阻止IPF 病理进展[16-17]。此外,还有研究认为,槲皮素和木犀草素发挥抗肺纤维作用可能与抑制SphK1/S1P 信号传导[18]和成纤维细胞中TGF-β1 诱导的Smad3 磷酸化有关[16]。本研究进一步建立PPI 互作网络,并经拓扑分析获得核心靶点20 个。富集分析显示,核心靶点富集最多的通路为疱疹病毒感染、丙型肝炎病毒感染和人类巨细胞病毒感染方面,提示血府逐瘀汤很可能是通过影响上述信号转导通路发挥治疗IPF 的作用。
已有证据表明,病毒感染是IPF 的发病和急性加重的重要风险因素,尤其是持续性和慢性感染病毒如疱疹病毒和人类巨细胞病毒等可显著增加IPF 发病风险[19]。其中以疱疹病毒与IPF 发病的相关性最受关注。研究发现,96%的IPF 患者肺中疱疹病毒DNA 检测呈阳性,且可从肺泡上皮细胞发现疱疹病毒的潜伏证据[20]。此外,疱疹病毒感染可能还参与了IPF 的急性加重过程。Saraya 等[21]研究发现,疱疹病毒可增加IPF 患者急性加重风险,增加患者的短期死亡率。本研究进一步对KEGG 富集得到的疱疹病毒感染、丙型肝炎病毒感染和人类巨细胞病毒感染通路中的关键靶点进行分析发现,在上述通路中均包含了STAT3 蛋白。STAT3 是一种细胞质转录因子,在腺病毒介导的肺损伤中发挥重要作用[22],也是促进成纤维细胞衰老的重要因子[23]。Prêle 等[24]在2012 年即提出STAT3 蛋白表达异常可能是肺组织纤维化的核心致病机制。
本研究分子对接结果表明,获得的核心靶点可以与活性成分形成较为稳定的构象,这进一步验证了血府逐瘀汤对IPF 治疗作用的药效物质基础。动物实验发现,血府逐瘀汤可明显缓解IPF 大鼠肺泡内炎性细胞浸润程度,减少蓝色胶原纤维沉积,同时降低肺组织羟脯氨酸水平,这提示血府逐瘀汤可改善IPF 大鼠肺组织纤维化的病理情况。
Kaposi’s 肉瘤相关疱疹病毒感染信号通路是本研究中核心靶点富集率最高的通路。通过检索KEGG 数据库可知,该通路主要涉及MAPK、JAK-STAT 和Toll 样受体信号通路等。其中,ERK、STAT3 和TLR3 分别是上述3 个通路中的关键蛋白之一。既往研究发现,MAPK 信号通路与成纤维细胞的激活和增殖有关,而ERK 则是该通路的重要调节蛋白[25]。Liu 等[26]在关于IPF 的动物实验中,将ERK 作为主要目标蛋白进行分析。此外,Toll 样受体信号通路与IPF 的相关性已经得到证实[27]。其中,Toll 样受体3 (TLR3) 作为该通路中的关键调节蛋白,激活后可加强纤维增殖反应,并可引起IPF 大鼠肺功能下降,增加死亡风险[28]。因此,本研究将ERK、TLR3 和STAT3 作为目标蛋白,分析血府逐瘀汤治疗IPF 的主要机制。结果发现,血府逐瘀汤各剂量组STAT3、ERK 和TLR3 蛋白表达低于模型组,且血府逐瘀汤高剂量组与吡非尼酮组较为接近,提示血府逐瘀汤可通过抑制Kaposi’s 肉瘤相关疱疹病毒感染通路中STAT3、ERK 和TLR3 蛋白表达发挥抗IPF 的作用。
综上所述,本研究基于网络药理学和分子对接技术对血府逐瘀汤多成分、多靶点、多途径治疗IPF 的作用机制进行分析,并在此基础上进行了动物实验论证。结果表明,血府逐瘀汤可能通过疱疹病毒感染、丙型肝炎病毒感染和人类巨细胞病毒感染等信号通路发挥其抗纤维化的作用。

