马铃薯高效再生及遗传转化体系的优化
张薇



摘要 为优化马铃薯高效再生及遗传转化体系,研究鄂马铃薯3号茎段外植体在不同激素浓度配比下愈伤组织及分化情况,获得最佳愈伤组织及分化激素配比,再采用根癌农杆菌的遗传转化进行筛选,获得最佳转化体系,为马铃薯优质品种的基因工程育种提供依据。结果表明,不同激素浓度配比下愈伤组织及分化率差异较大,其中2.0 mg/L ZR+0.1 mg/L IAA 激素配比下可高效再生出芽,出芽率高达100%,芽长势粗壮。通过构建植物表达载体pCambia1301,以GV3101为介导菌株,预培养2~3 d,共培养2~3 d,350 mg/L羧苄青霉素,50 mg/L卡那霉素筛选浓度转化效果较好,转化效率可达65%,其中转化苗在0.8 mg/L IBA+0.2 mg/L NAA激素配比的培养基中可形成再生植株,再生率达80%,苗茎粗壮,根系发达。
关键词 马铃薯;茎段;激素;遗传转化;转化率
中图分类号 S532 文献标识码 A 文章编号 0517-6611(2024)03-0035-05
doi:10.3969/j.issn.0517-6611.2024.03.009
Optimization of High Efficiency Regeneration and Genetic Transformation System in Potato
Abstract In order to optimize the efficient regeneration and genetic transformation system of potato, the effects by using stem segment of Hubei potato No.3 as explants were studied in different hormone concentration ratios, and the optimal callus and differentiation hormone ratio were obtained. Then, the genetic transformation of Agrobacterium tumefaciens was used for screening to obtain the best transformation system, which provided the basis for genetic engineering breeding of high quality potato varieties. The results showed that the callus and differentiation rate were great different under the ratio of different hormone concentration. The hormone ratio of 2.0 mg/L ZR and 0.1 mg/L IAA could regenerate the buds efficiently, the germination rate was as high as 100%, and the bud growth was strong. By constructing expression vector pCambia1301 in plant, GV3101-mediated strain, pre-cultured for 2-3 days, and co-cultured for 2-3 days, and 350 mg/L carbenicillin, and 50 mg/L kanamycin to screen the concentration was better. The transformation efficiency could reach 65%. The transformed seedlings could form regenerated plants in the medium of 0.8 mg/L IBA and 0.2 mg/L NAA hormone. The regeneration rate could reach 80%, the stems were thick and the roots were developed.
Key words Potato;Stem segment;Hormone;Genetic transformation;Conversion rate
馬铃薯(Solanun tuberosum L.)为茄科茄属一年生草本块茎植物[1],是我国主要粮食作物之一,产量排在小麦、玉米、水稻之后占第四位[2]。马铃薯具有生长周期短、营养丰富、加工产品众多等特点,在农业生产及人民生活中占有重要地位。
马铃薯栽种常采用无性繁殖的方式[3],即块茎的种苗繁育方式。这导致许多品种发生退化,且随着栽培年限的延长更加严重。研究发现其原因在于各种病毒、细菌、真菌等对马铃薯块茎和种苗的侵染。采用植株组织培养的方式可连续产生优质种苗和无毒种薯。通过马铃薯茎尖的脱毒、叶片和茎段等器官的快繁都能达到较好的效果[4-6]。另外,通过基因工程技术培育抗病、抗虫及抗逆性强、品质改良的种薯[7-8]。
许多国内外研究者[9-12]对马铃薯再生体系进行了研究,MS为常用的基本培养基;茎尖、茎段、薯块等是再生途径中主要采用的外植体;实验常采用的激素有细胞分裂素6-BA和ZT,细胞生长素IAA、NAA、2,4-D、赤霉素。虽然马铃薯遗传转化体系已有报道,但由于适用的转化受体及外植体材料存在差异[13-15],转化过程也有从愈伤的间接再生体系和直接分化再生体系的存在[16-18],导致马铃薯试验所需试验条件及培养基组成等差异明显。笔者研究了不同激素配比对马铃薯品种鄂马铃薯3号茎段愈伤组织诱导及分化的影响,在此基础上优化了根癌农杆菌的遗传转化体系,为马铃薯优质品种的选育奠定基础。
1 材料与方法
1.1 试验材料
采用鄂马铃薯3号无菌瓶苗茎段作为外植体。
1.2 培养基
以MS培养基,附加不同6-BA、ZR、NAA、IAA、GA3激素,20 g/L蔗糖,8 g/L琼脂,pH 5.8,作为愈伤诱导及分化的基本培养基。以MS+30 g/L蔗糖+pH 5.8作为根癌农杆菌转化时侵染液。以MS+30 g/L蔗糖+8 g/L琼脂+pH 5.8,附加不同浓度IBA和NAA,作为转基因植株再生的基本培养基。以LB作为菌体培养的基本培养基,即5 g/L酵母提取物,10 g/L蛋白胨,10 g/L氯化钠,17 g/L琼脂,pH 7.0,附加50 mg/L利福平(Rifampin,以下简写为Rif)和50 mg/L卡那霉素(Kanamycin,以下简写为Kan)。
1.3 愈伤组织诱导及芽的分化
将苗龄15~20 d的马铃薯无菌瓶苗茎段切成长0.5~0.8 cm小段,接种于附加不同浓度6-BA、ZR、NAA、IAA、GA3的13种梯度培养基(表1)中,进行愈伤组织的诱导及分化,每个梯度3个重复。20~25 ℃光照培养,1 500~2 000 lx光照16 h,培养20 d后观察愈伤出愈情况及出芽率(出芽率=出芽的外植体数/外植体总数×100%)。
1.4 遗传转化体系的构建
1.4.1 农杆菌菌液制备。
构建植物表达载体pCambia1301,利用GV3101菌株,获得农杆菌菌液。农杆菌单菌落在附加50 mg/L Rif和50 mg/L Kan的LB液体培养基中28 ℃、200 r/min振荡过夜培养。4 000 r/min离心10 min,弃上清,收集菌体,加入MS(附加200 μmol/L乙酰丁香酮)液体培养基中重悬20~30 min,稀释至OD600=0.4~0.6,备用。
1.4.2 茎段的预培养。
将苗龄15~20 d的马铃薯无菌瓶苗茎段切成长0.5~0.8 cm小段,置于预培养基中,20~25 ℃,避光培养2~3 d。预培养基选用愈伤诱导效果较佳的2.5 mg/L ZR+1.0 mg/L IAA+0.20 mg/L GA3激素配比培养基(表1 10号梯度)。
1.4.3 侵染及共培养。
预培后的茎段放入无菌培养皿(90 mm×90 mm)中,倒入农杆菌菌液,期间不断振荡,侵染8 min,茎段转入吸干纸上吸干表面残留菌液,接种于垫有滤纸的共培培养基中,20~25 ℃,避光培养2~3 d。选用激素配比为2.5 mg/L ZR+1.0 mg/L IAA+0.2 mg/L GA3(表1 10号梯度)作为共培培养基,并附加200 μmol/L乙酰丁香酮。
1.4.4 转化茎段的筛选及抗性芽的获得。
共培后将茎段转入筛选培养基中,20~25 ℃光照培养,每15~20 d换一次板,直至分化出抗性芽。选用2.0 mg/L ZR+0.1 mg/L IAA激素配比培养基(表1 7号梯度)作为筛选培养基,附加抑菌剂350 mg/L羧苄青霉素和卡那霉素。利用浓度梯度试验确定Kan最适浓度,设立5个浓度梯度(0、25、50、75、100 mg/L),每个梯度3个重复。20~25 ℃光照培养16 h,每15 d换一次板,观察第40天时外植体的筛选及出芽情况。
1.4.5 转化抗性植株的再生。
转化苗再生培养基为MS+30 g/L蔗糖+8 g/L琼脂+pH 5.8,附加不同激素浓度的NAA和IBA进行配比,30 mg/L Kan 和350 mg/L羧苄青霉素,根据预试验的结果设置5个处理(表2),将已分化出1~2 cm小苗,从基部切下,插入生根培养基中,每瓶5棵生根苗,每个梯度3个重复。观察转化抗性植株生根率(生根率=已长根植株数/总植株数×100%)及根长势情况。
1.4.6 转化植物的PCR鉴定。
待转化植株生根后,采用CTAB法提取DNA。未转化生根野生苗基因组DNA为阴性对照,植物表达载体质粒为阳性对照,利用Kan抗性基因NPTII的2个特异引物(5′→3′)CGTTGTCACTGAAGCGGGAGGG和GAGCGGCGATACCGTAAAGCAC进行PCR扩增。PCR反应体系为94 ℃ 5 min,94 ℃ 30 s,60 ℃ 30 s,94 ℃ 5 min,72 ℃ 8 min,35个循环,反应结束后4 ℃保温。PCR反应条件为 10 μL Mix+7.4 μL ddH2O+0.3 μL引物-F+0.3 μL引物-R+2 μL DNA,反应结束后用1.2%琼脂糖凝胶电泳进行检测。对检测结果进行统计和分析,计算该转化体系下的转化效率(转化率 =已检出Kan抗性的阳性植株数/总再生植株數×100%)。
2 结果与分析
2.1 不同激素配比对愈伤组织诱导及芽分化的影响
使用细胞分裂素6-BA和ZR,细胞生长素NAA和IAA,以及赤霉素GA3 3类植物激素,并根据前人研究结果,设计了5种激素不同浓度配比的13个处理梯度。结果表明,鄂马铃薯3号茎段可直接分化出芽(梯度1~3号除外),不同激素配比下的愈伤诱导和芽分化情况差异明显(表1)。
2种激素配比下(梯度1~7号),出愈率较高的是3号(2.0 mg/L 6-BA+0.10 mg/L NAA)和7号(2.0 mg/L ZR+0.1 mg/L IAA)2个处理,外植体茎段伤口处长出愈伤组织,呈绿色。3种和4种激素配比下(8~13号),出愈率明显高于2种激素配比,外植体茎段各部位均有愈伤长出,伤口处较多,呈浅绿色。
6-BA与NAA激素配比下未分化出芽,且与GA3配合使用时出芽率极低,分化出的芽较细,无明显叶片,表明6-BA不利于鄂马铃薯3号茎段的分化,但对愈伤组织的诱导能够起到一定的作用。ZR与GA3、IAA和6-BA多种激素配比(梯度8~13号)下出芽率均达100%,但所出芽较细,无明显叶片,苗弱;ZR与IAA配比(梯度6~7号)时能得到较高的出芽率,分化出的芽较粗,叶片较大且呈深绿色,苗壮,其中7号(2.0 mg/L ZR+0.1 mg/L IAA)出芽率可达100%。结果表明,ZR和GA3这2种配比其他激素时,可以促进鄂马铃薯3号茎段的分化出芽,但ZR诱导产生的芽较壮,GA3诱导产生的芽较弱。考虑操作的方便性、芽生长的状态、试验成本等,鄂马铃薯3号茎段愈伤诱导及分化出芽的最佳激素配比为2.0 mg/L ZR+0.1 mg/L IAA。
2.2 遗传转化体系的建立
2.2.1 卡那霉素浓度对外植体出愈率和出芽率的影响。
在预培、侵染及共培后,将茎段置于含有不同浓度Kan(0、25、50、75、100 mg/L共计5个处理梯度)的培养基中,40 d后观察愈伤组织及出芽情况(图1)。当Kan浓度为0和25 mg/L时,不能有效抑制愈伤组织生长及芽的分化,无法进行有效的筛选,且增加了后期检测抗性植株的难度;当Kan浓度为50 mg/L时愈伤诱导率较低,出芽率为80%;當Kan浓度为75 mg/L时愈伤组织诱导率急剧降低且茎段外植体多数褐化,出芽率为27.8%;当Kan浓度为100 mg/L时茎段全部褐化坏死,且出芽率为零。因此,选取50 mg/L Kan是理想的筛选浓度,既能有效地抑制愈伤的诱导及芽的分化,又不致于细胞迅速死亡。
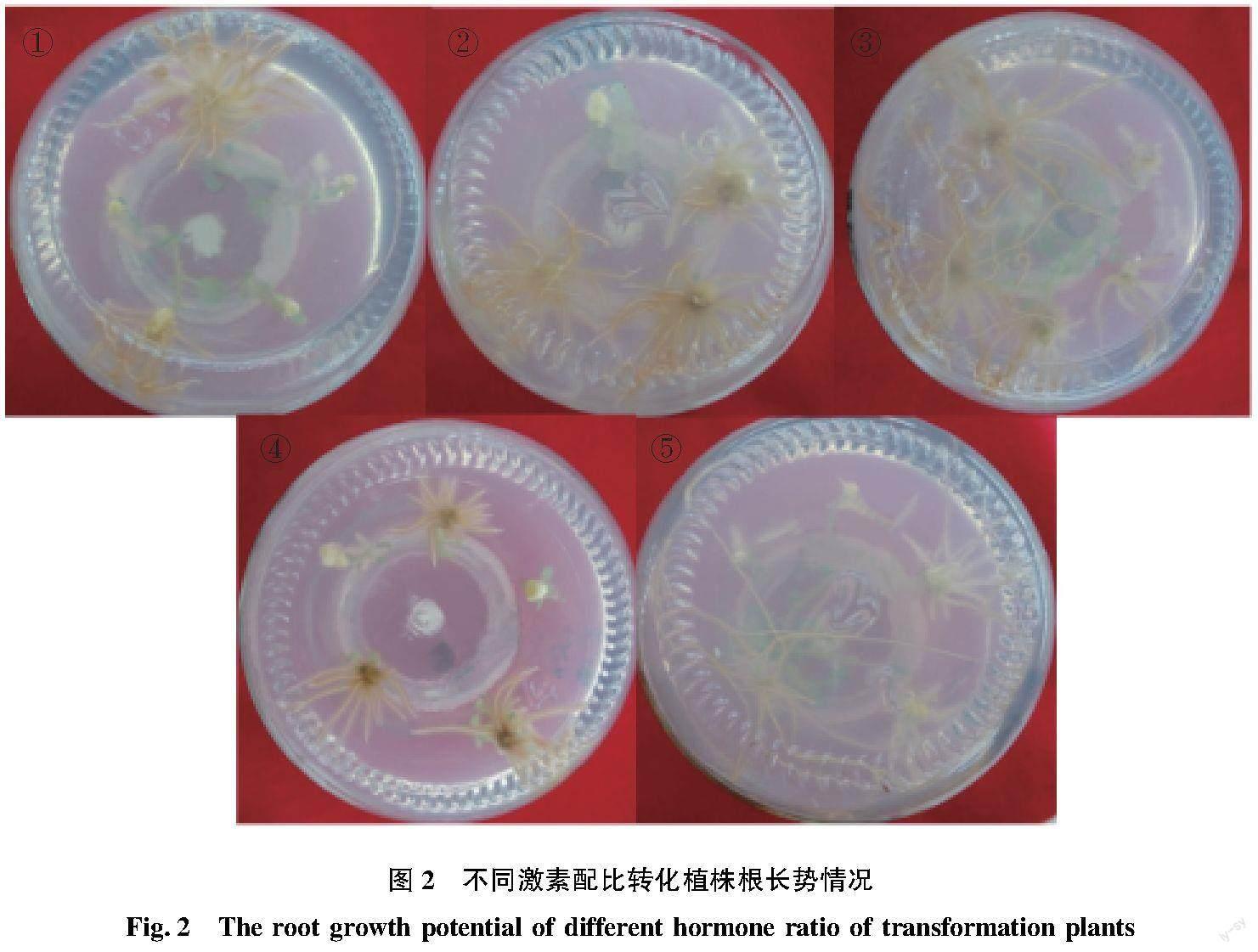
2.2.2 IBA和NAA配比对转化植株根诱导及再生的影响。
5个处理均能诱导出根,且所诱导出的根长势情况及诱导率均存在一定差异(表2和图2),根诱导率为处理③> 处理①(⑤)>处理②>处理①,生根率最高可达80%。2种激素(IBA和NAA)不论是单独使用还是配合使用均能诱导抗性苗长根,单一激素使用时(④和⑤),IBA诱导产生的根较长较细,NAA诱导产生的根较短较粗;2种激素配合(①~③)使用诱导产生的根比单独使用NAA时要长,比单独使用IBA时要粗,由此可知,2种激素配合使用对根的发育及生长更有利。表明选择处理③ 0.8 mg/L IBA+0.2 mg/L NAA作为转基因植株再生的培养基。
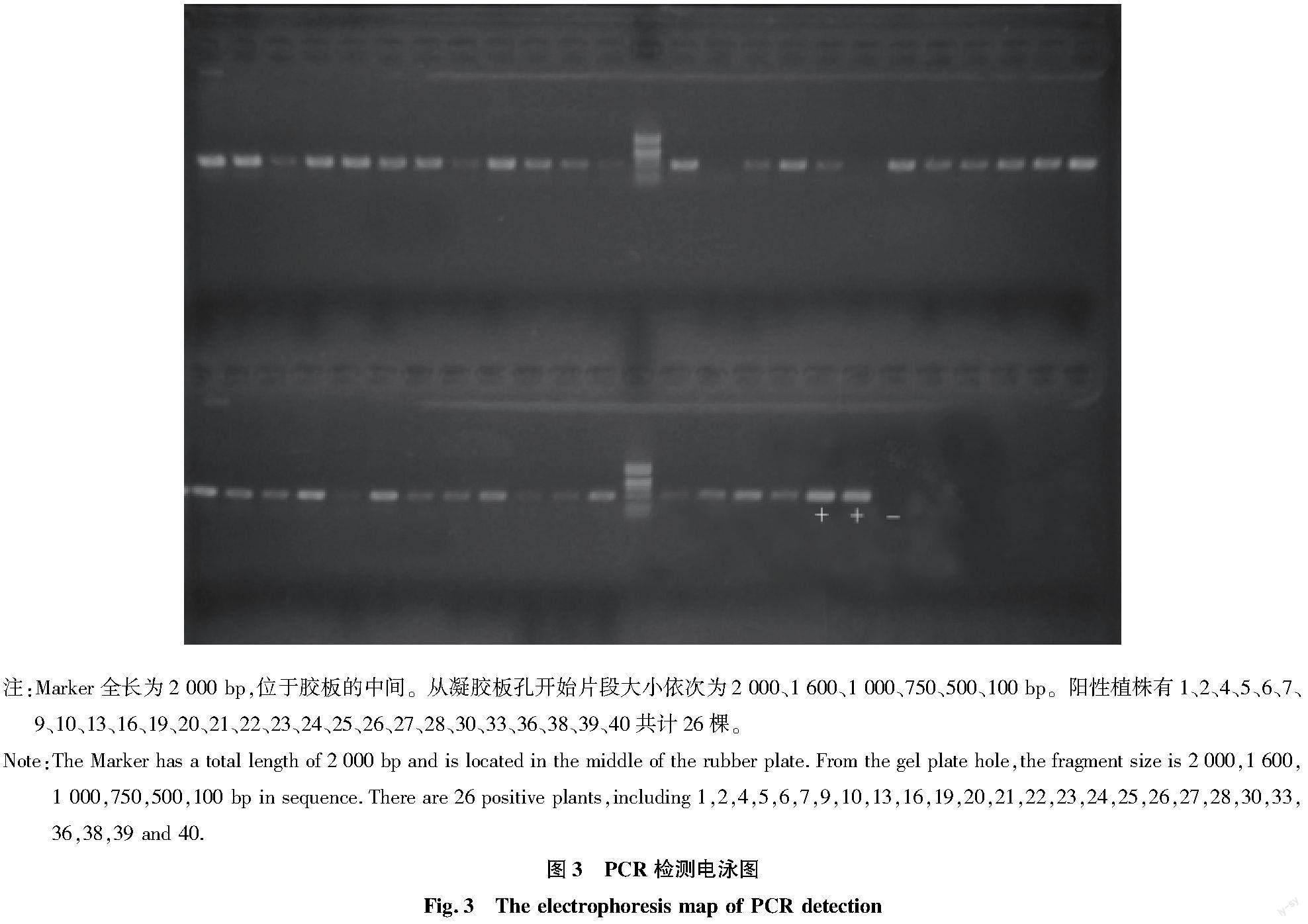
2.2.3 PCR检测转化效率。
对已获得的转化再生抗性植株进行PCR检测(图3),检测40棵抗性植株,有26棵具Kan抗性的抗性植株,转化效率为65%,其中还有少量呈现弱带的抗性植株,可能是DNA提取时DNA浓度较低或转化后的拷贝数较低导致。
3 结论与讨论
该研究表明,鄂马铃薯3号作为无性繁殖的作物,容易诱导愈伤组织、不定芽和再生植物,整个试验周期较短、出芽率高、再生植物粗壮,在此基础上进行根癌农杆菌的遗传转化研究也得到了较高的转化率(65%),是基因工程育种中优质种薯获得的来源。另外,受体系统的建立,关系到组织培养及基因转化的成败,该试验选用试管苗茎段作为外植体,进行组织培养,具有取材方便、不易污染等优点,成功建立和优化了该品种茎段外植体的愈伤组织诱导及分化培养体系,可以直接通过外植体一步分化出苗,出芽率达100%。
由于植物快繁过程中生长素和分裂素等激素的水平和配比,对诱发细胞的分裂、生长和分化起着决定性作用[19]。因此,该试验研究了5种激素水平下的13种处理方式茎段外植体愈伤组织诱导及分化试验,结果表明,在2 mg/L ZR+0.1 mg/L IAA激素配比下能够较好地进行愈伤诱导及芽的分化,分化率高达100%。在马铃薯组织快繁的研究中,研究者[20-22]常用激素NAA、6-BA、GA3 3种进行芽的分化,分化率都未达100%;王萍等[11]研究表明ZT是诱导马铃薯分化较为理想的激素,分化率达57.14%,很少用到激素ZR,而该试验尝试使用ZR,且表明ZR能够成功地诱导马铃薯愈伤组织及芽的分化,分化率高达100%,认为ZR是一种应用于马铃薯芽分化时较好的一种植物生长调节剂。
选用组培最佳试验结果的基础上进行根癌农杆菌遗传转化的优化,确定了鄂马铃薯3号茎段外植体的最佳Kan选择压为50 mg/L,再生抗性芽率达80%,转化植株阳性率达65%,使用0.8 mg/L IBA+0.3 mg/L NAA配比下转化芽再生植株根粗壮。试验选择压与薯块[23-24]Kan选择压相同,而叶片[25]的选择压为20 mg/L Kan,出现这一现象的原因可能是基因型和试验外植体选取的不同,后期需根据实际情况进行选择压敏感性试验,以获得最佳选择压。转化苗生根时使用激素IBA或NAA只能增强或减弱苗根的长势,Veale等[15]不添加激素直接进行生根,罗源[18]在转化苗生根时添加激素NAA,而该试验选用IBA和NAA配合使用获得较高的生根率,根长势粗壮。
参考文献
[1] 吴林科,郭志乾,王晓瑜.优质马铃薯生产技术[M].银川:宁夏人民出版社,2005.
[2] 王凯.冬作马铃薯氮磷钾营养特性与合理施肥的研究[D].广州:华南农业大学,2016.
[3] 刘俊秀.马铃薯组织培养基试管苗保存研究[D].呼和浩特:内蒙古农业大学,2015.
[4] 付雪娇,孟令文.马铃薯品种辽薯6号茎尖脱毒及快繁技术研究[J].辽宁农业科学,2017(5):85-87.
[5] 张玲.马铃薯组织培养技术研究[J].西南科技大学学报(自然科学版),2004,19(1):88-90.
[6] 王芳,黄坚,严成其,等.花旗马铃薯品种茎尖脱毒与快繁技术[J].浙江农业科学,2017,58(9):1577-1578,1583.
[7] 杨永智.农杆菌介导法马铃薯遗传转化体系的优化[J].江苏农业学报,2013,29(4):738-742.
[8] 丛培琳,卢翠华,邸宏,等.Bt-CryV基因对马铃薯的遗传转化[J].东北农业大学学报,2008,39(9):16-20.
[9] 蒲秀琴.3种青海省主栽马铃薯外植体的组织培养和植株再生[J].江苏农业科学,2014,42(4):52-54.
[10] 白云,马箭超,聂文丹,等.一种简易快速获得脱毒马铃薯幼苗的方法[J].河北师范大学学报(自然科学版),2017,41(2):169-171.
[11] 王萍,王罡,季静.马铃薯两个基因型不同外植体的组织培养与植株再生[J].中国马铃薯,2006,20(6):326-328.
[12] 罗源,陈耀锋,李春莲,等.马铃薯茎段愈伤组织培养体系的优化[J].西北农林科技大学学报(自然科学版),2007,35(10):159-162.
[13] HEERES P,SCHIPPERS-ROZENBOOM M,JACOBSEN E,et al.Transformation of a large number of potato varieties:Genotype-dependent variation in efficiency and somaclonal variability[J].Euphytica,2002,124(1):13-22.
[14] 康霞,徐刚,王玉萍.根癌农杆菌(Agrobacterium tumefaciens)介导的马铃薯高效遗传转化体系筛选及优化[J].中国沙漠,2016,36(1):225-231.
[15] VEALE M A,SLABBERT M M,VAN EMMENES L.Agrobacterium-mediated transformation of potato cv.Mnandi for resistance to the potato tuber moth(Phthorimaea operculella)[J].South African journal of botany,2012,80:67-74.
[16] 李璐.農杆菌介导的马铃薯遗传转化体系的优化及StNTP基因功能的验证[D].武汉:华中农业大学,2017.
[17] 程永芳,张丽,宋玉霞.马铃薯高效遗传转化受体体系的建立[J].西北农业学报,2016,25(9):1350-1357.
[18] 罗源.马铃薯再生体系的建立及HAL1基因遗传转化研究[D].杨凌:西北农林科技大学,2007.
[19] 颜昌敬.植物组织培养手册[M].上海:上海科学技术出版社,1990.
[20] 王宪.二倍体马铃薯再生体系建立及耐盐愈伤组织的筛选[D].哈尔滨:东北农业大学,2012.
[21] 栾雨时,徐品三,夏秀英,等.适于马铃薯茎段再生的植物激素配比选择[J].中国马铃薯,2004,18(3):143-144.
[22] 王桂梅,杨林栋.马铃薯茎尖组织培养方法优化研究[J].安徽农学通报,2012,18(9):48-49.
[23] 聂利珍.应用拟南芥CDPK1基因提高马铃薯抗旱性的研究[D].呼和浩特:内蒙古农业大学,2015.
[24] 李丹,尚菲.影响马铃薯遗传转化效率的因素探讨[J].陇东学院学报,2016,27(3):53-55.
[25] 王丹,朱常香,郑成超,等.根癌农杆菌介导的马铃薯遗传转化条件的优化[J].山东农业大学学报(自然科学版),2002,33(1):23-27.

