自主神经功能对卒中后抑郁患者运动功能的影响
张明兰, 张玲玲, 王丽莎, 刘莉, 高润, 饶江, 刘婉, 夏子安, 张传文, 程欣欣
1.南京医科大学附属脑科医院,a.物理诊断科心电图室;b.康复医学科,江苏南京市 210029
0 引言
卒中后抑郁(post-stroke depression, PSD)是指脑卒中发生后两年内出现的一种情绪障碍性疾病,主要表现为情绪低落、兴趣缺乏和精神运动迟滞[1-6]。研究表明,脑卒中导致的功能障碍与PSD 发病风险相关[7]。心率变异性(heart rate variability, HRV)主要反映自主神经功能的活性,能对支配心脏的交感神经和迷走神经的平衡性和张力进行定量评估[8]。Boissoneault 等[9]发现PSD 患者HRV 下降。Korpelainen 等[10]发现急性期脑卒中患者HRV各指标明显降低,自主神经昼夜节律改变。
有研究采用静息态磁共振成像(resting state functional MRI, rs-fMRI)研究PSD 患者脑功能改变,但对PSD 与运动功能之间关系的研究较少[11]。脑局部一致性(regional homogeneity, ReHo)是rs-fMRI 的测量指标之一,用于衡量神经同步性,间接反映局部自发神经元活动。本研究采用ReHo 分析PSD 患者脑区神经元活动的异常表现,探讨自主神经功能对运动功能的影响。
1 资料与方法
1.1 一般资料
2020年1月至12月,南京医科大学附属脑科医院康复医学科和神经内科住院或门诊的首发脑梗死患者60 例,其中无抑郁患者30 例,作为对照组;并发抑郁的患者30例,作为PSD组。
诊断标准:脑梗死的诊断标准参考中国各类脑血管疾病诊断标准要点2019[12],脑梗死后是否并发抑郁的诊断标准参考中国精神障碍分类与诊断标准(CCMD-3)[13]。
纳入标准:①经头颅CT 或MRI 扫描确诊为脑卒中;②首次发病,病程< 6 个月,生命体征平稳;③汉密尔顿抑郁量表(Hamilton Depression Scale, HAMD)评分7~24 分;④无精神疾病史;⑤单侧肢体偏瘫患者,无言语、认知、吞咽等功能障碍;⑥检测前未接受β-受体阻滞剂、西地兰等已知能影响自主神经功能活性的药物治疗。
排除标准:①短暂性脑缺血发作、腔隙性脑梗死,卒中后无运动功能障碍;②多次或多发脑梗死;③伴有Pusher 综合征或偏侧忽视症;④认知功能障碍,有交流障碍;⑤既往有影响自主神经活性的疾病,如冠心病、心肌梗死、心力衰竭等,有严重心律失常的心电图表现;⑥失语、意识不清、严重视力障碍、严重听理解障碍。
剔除与脱落标准:①病情加重;②不配合检查。
两组性别、年龄、病程、受损半球无显著性差异(P> 0.05)。见表1。

表1 两组基线资料比较Table 1 Comparison of baseline data between two groups
本研究经南京医科大学附属脑科医院伦理委员会审批通过(No.2017-KY038),并在中国临床试验注册中心注册(No.ChiCTR2300075408)。所有患者均签署知情同意书,且同意参与研究。
1.2 方法
选取2 名调查员统一培训并考核合格后,在同一时间进行评定,取平均值作为评定结果。
1.2.1 功能评定
Fugl-Meyer 评定量表(Fugl-Meyer Assessment,FMA):上肢33 项,下肢17 项,总分100 分。评分越高,运动功能越好。
改 良Barthel 指 数(modified Barthel Index, MBI):共10 项,总分100 分。评分越高,日常生活活动能力越好。
HAMD:采用17 项版本,总分52 分。< 7 分,无抑郁症状;7~24分,有抑郁症状。
1.2.2 HRV检测
采用BodyChecker 自主神经功能系统平衡检查仪〔吉泰永盛(北京)科技发展有限公司〕记录3 导联HRV,记录时间为5 min,获取连续正常的R-R 间期,分析HRV各频段的参数。
时阈指标:①24 h 正常R-R 间期标准差(standard deviation of normal-to-normal R-R intervals, SDNN):反映自主神经整体活性;②24 h 相邻R-R 间期差值的均方根值(the root mean square of successive differences between normal heartbeats over 24 hours, RMSSD),反映副交感神经活动;③24 h 相邻正常R-R 间期差值>50 ms 的心跳个数所占心搏数的百分比(the percentage of differences between adjacent normal R-R intervals over 24 hours that are greater than 50 ms, PNN50),反映副交感神经活动。
频域指标:①极低频功率(very low frequency,VLF):频率0.003~0.04 Hz,反映交感神经活动;②低频功率(low frequency, LF):频率0.04~0.15 Hz,反映交感神经和迷走神经影响的混合效应;③高频功率(high-frequency, HF):频率0.15~0.4 Hz,反映副交感神经活动;④低频功率与高频功率的比值(low-frequency/high-frequency ratio, LF/HF),反映交感神经和副交感神经之间的平衡;⑤总功率(total power, TP):< 0.4 Hz,为所有NN区间的方差,反映自主神经的整体活性。
1.3 rs-fMRI
采用随机数字表法,两组各选取10 例接受rs-fMRI 检查。采用SIEMENS 3.0 T Trio 磁共振扫描仪(MAGNETOM TRIO, SIEMENS, Erlangen, 德 国),标准头颅8通道线圈。患者平躺在检查床上,头部固定,戴上眼罩、耳塞减轻扫描机器噪音及光学干扰,闭眼,保持放松,避免主动头动,休息5 min 后开始扫描。常规头颅平扫后,行静息态BOLD-fMRI 数据采集,单次激发梯度回波(gradient-recalled echo-planar imaging, GRE-EPI)序列,TR 2000 ms,TE 30 ms,层厚4 mm,层间距0 mm,层数30 层,FOV 256 mm×256 mm,共采集251 个时相,采集时间约500 s。所有病例扫描均由同一名经验丰富的影像科医生完成。
使用MRIcro 软件,对受试者参数图像进行左、右翻转,使病灶均位于右侧大脑。采用MatLab2013b平台下的DPARSF (http://www.rest.restfmri.net)对rsfMRI 数据进行预处理:去除10 个时间点,时间层、头动校正,空间标准化处理,去线性漂移,0.01~0.08 Hz滤波。ReHo通过选定体素和其相邻的26体素在时间序列上的相似性来评估局部信号同步性,计算肯德尔和谐系数(Kendall's coefficient of concordance, KCC),用每一个体素的KCC 值除以全脑平均KCC 值,得到标准化ReHo 图。对标准化ReHo 图进行高斯核平滑,半峰全宽6 mm。采用加拿大蒙特利尔神经科学研究所(Montreal Neurological Institute,MNI)的自动解剖模板(Anatomical Automatic Labeling,AAL)分区法对存在显著性差异的脑区进行报告。
1.4 统计学分析
采用SPSS 22.0 进行统计学分析,计数资料以频数表示,组间比较采用χ2检验;计量资料符合正态分布,以(±s)表示,组间比较采用独立样本t检验;HRV 各指标、抑郁程度、FMA 和MBI 量表之间相关性采用Spearman相关性分析。显著性水平a= 0.05。
采用REST软件对ReHo进行统计学分析,组间比较采用独立样本t检验,使用GRF 校正法对结果进行校正,voxelP< 0.005,clusterP< 0.05(双尾),认为脑区存在显著性差异。
2 结果
2.1 功能评定
PSD 组HRV 时域指标SDNN、RMSSD、PNN50低于对照组(P< 0.05);频域指标TP、VLF、LF、HF、LF/HF低于对照组(P< 0.05)。PSD 组FMA、MBI评分显著低于对照组(P< 0.001);PSD 组HAMD 评分显著高于对照组(P< 0.001)。见表2和表3。

表2 两组HRV各指标比较Table 2 Comparison of parameters of HRV between two groups
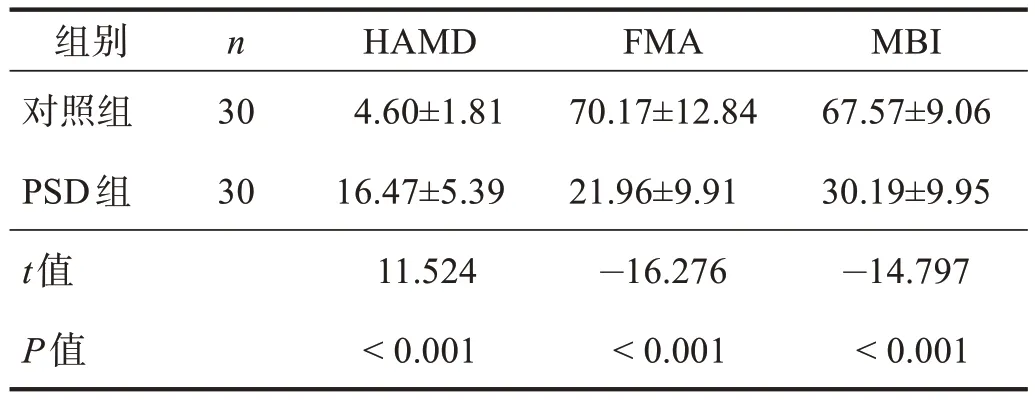
表3 两组HAMD、FMA和MBI评分比较Table 3 Comparison of scores of HAMD, FMA and MBI between two groups
2.2 相关性分析
PSD 组FMA 与SDNN、RMSSD、PNN50、TP、VLF 和LF 呈正相关(r> 0.394,P< 0.05),与HAMD 呈负相关(r= -0.952,P< 0.001)。见表4。
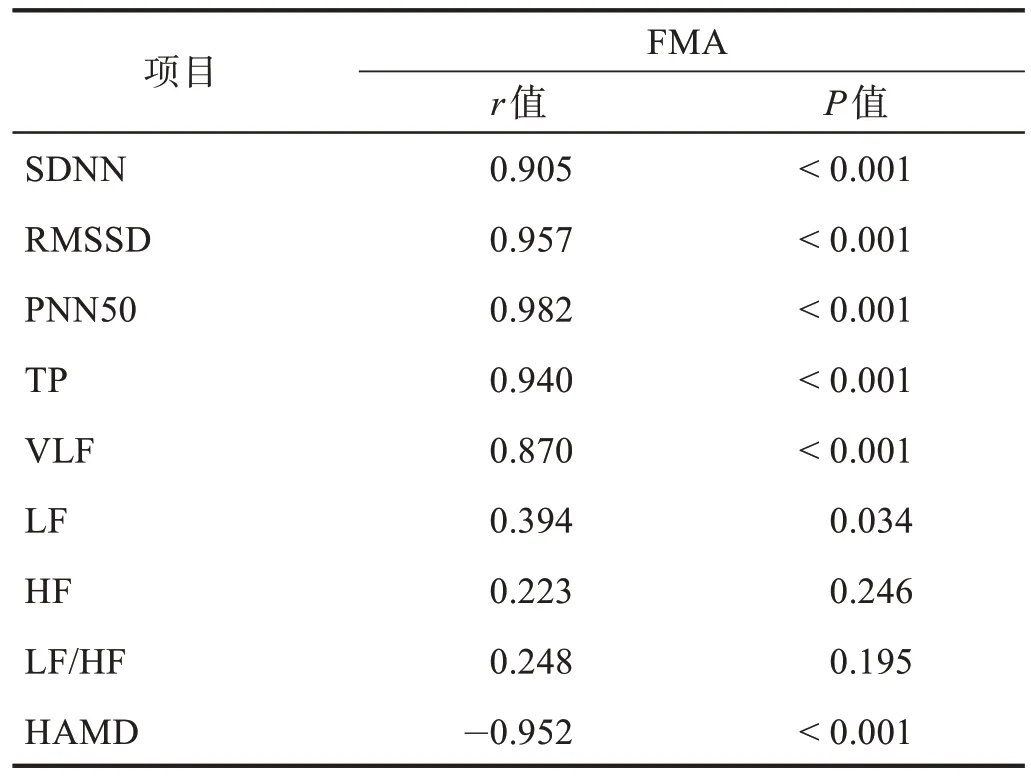
表4 PSD组FMA评分与HRV各指标和HAMD的相关性Table 4 Correlation of FMA score to HRV parameters and HAMD in PSD group
PSD 组MBI 与SDNN、RMSSD、PNN50、TP、VLF 和LF 呈正相关(r> 0.409,P< 0.05),与HAMD 呈负相关(r= -0.919,P< 0.001)。见表5。

表5 PSD组MBI评分与HRV各指标和HAMD的相关性Table 5 Correlation of MBI score to HRV parameters and HAMD in PSD group
PSD 组HAMD 与SDNN、RMSSD、PNN50、TP、VLF呈负相关(|r| > 0.769,P< 0.001)。见表6。未发现对照组HRV 各参数、HAMD、FMA、MBI评分之间的相关性。
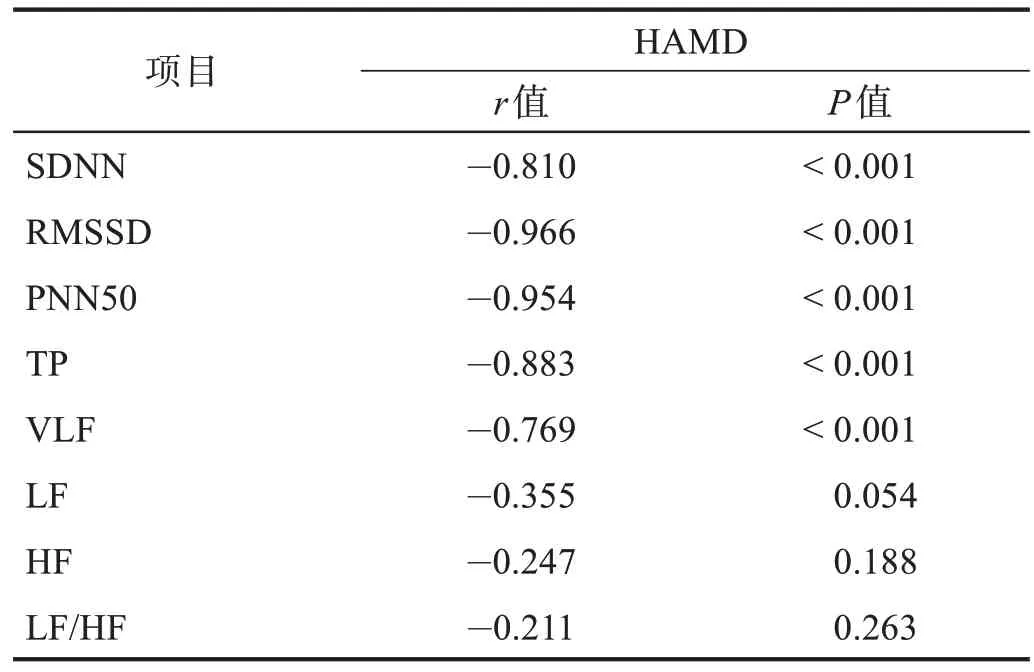
表6 PSD组HAMD评分与HRV各指标的相关性Table 6 Correlation of HAMD score to HRV parameters in PSD group
2.3 ReHo
ReHo值见表7和表8。

表7 PSD组ReHo增加的脑区Table 7 Brain regions with increased ReHo in PSD group
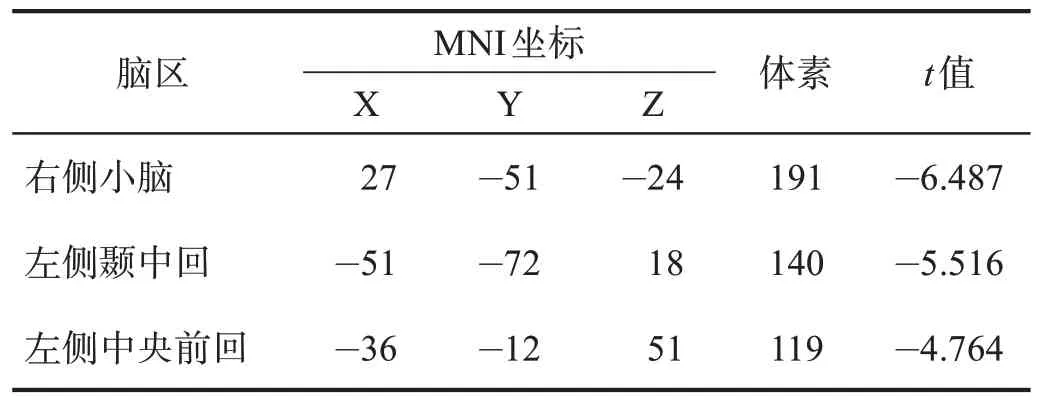
表8 PSD组ReHo减少的脑区Table 8 Brain regions with decreased ReHo in PSD group
与对照组相比,PSD 组的右侧直回(142 体素,t=6.575)、左侧内侧和旁扣带脑回(204 体素,t= 4.925)的ReHo 增 加(GRF 校 正,P-Voxel< 0.005,P-Cluster<0.05)。见图1。
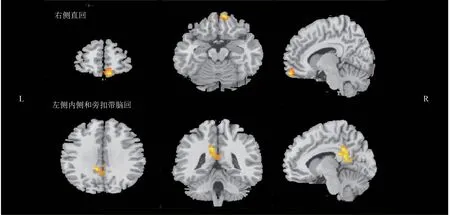
图1 PSD组ReHo增加的脑区Figure 1 Brain regions with increased ReHo in PSD group
PSD 组的右侧小脑(191 体素,t= -6.487)、左侧颞中回(140 体素,t= -5.516)以及左侧中央前回(119 体素,t= -4.764)的ReHo 减少(GRF 校正,P-Voxel<0.005,P-Cluster< 0.05)。见图2。
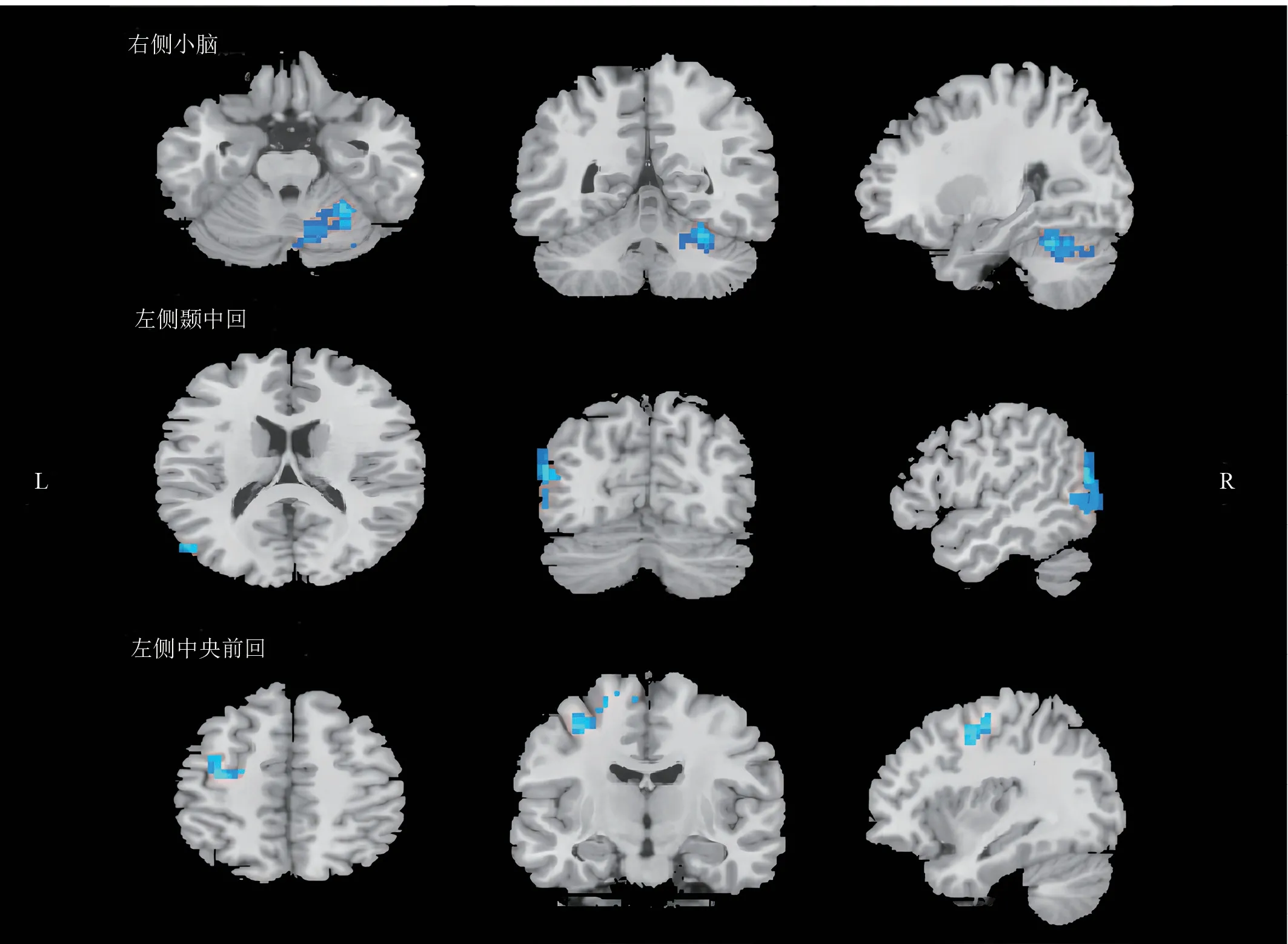
图2 PSD组ReHo减少的脑区Figure 2 Brain regions with reduced ReHo in PSD group
3 讨论
近30%的脑卒中患者可能出现PSD[2]。首次脑梗死3 个月后,PSD 的发生率约为41.1%[3]。PSD 多发病于脑卒中后6个月内。脑卒中后12个月,约20%幸存者可能发展为抑郁症[14-15]。在少数情况下,抑郁可能在卒中后持续3年以上[4-5],甚至达到5年[6]。
运动功能障碍是导致脑卒中患者产生情绪障碍的重要原因之一。脑卒中患者存在不同程度的肌力、平衡功能及步行能力减退,导致日常生活活动能力受限,叠加疾病导致的自我形象紊乱和自我评价降低,进一步加重应激反应[16-17]。PSD 患者容易出现消极的认知倾向,可能导致运动功能恢复不佳[18]。本研究中,PSD 患者FMA、MBI 低于对照组,HAMD 高于对照组,提示PSD 患者运动功能和日常生活活动能力与抑郁程度有关,与既往研究一致[19]。
相关性分析显示,HRV 各指标与FMA、MBI 评分存在相关性。其中,SDNN 是评价患者自主神经功能和受损程度的指标;RMSSD、PNN50 是评估迷走神经功能的指标,当迷走神经张力降低时,其值降低;TP 反应自主神经的总体活性,VLF 受副交感神经的调制,LF 代表交感神经活性,与压力感受器有关,下降预示着病情较重[20]。PSD 患者SDNN、RMSSD、PNN50 降低,提示交感神经张力过高和迷走神经张力降低;TP、VLF、HF、LF 的降低提示交感神经的张力升高,表明PSD 患者运动功能及日常生活能力缺损的程度与自主神经功能调节相关。
抑郁增加了交感神经张力,可能影响脑血管的舒缩反应、脑血流的自动调节和侧枝循环的建立,阻碍脑功能重组,导致运动功能恢复受限。由于自主神经的中枢位于中枢神经系统各级水平内,下丘脑、背侧丘脑、皮质、岛叶、边缘系统、脑干等均在自主神经功能的调节中起重要作用[21]。自主神经功能紊乱导致脑区的失代偿可能与运动功能障碍及日常生活活动能力缺损有关[22]。本研究未发现对照组中HRV各指标与FMA 和MBI 评分的相关性,可能与自主神经各级中枢的调节和代偿有关,与既往研究一致[23]。HAMD 与SDNN、RMSSD、PNN50、TP、VLF呈负相关,提示脑卒中后自主神经系统调节紊乱、交感神经与副交感神经的均衡性被破坏,抑制了神经元修复与代偿,导致PSD[24-25]。脑卒中和抑郁之间存在双向关联,脑卒中易导致抑郁,而抑郁的发生加重脑卒中的症状进而引发更严重的脑内神经递质等神经内分泌变化并加重神经功能缺损程度[26]。
ReHo 是rs-fMRI 的主要指标之一,能直接反应局部脑区神经元活动的时间同一性。ReHo 升高是局部脑区神经元活动在时间上趋于一致的体现,反之则提示局部神经元活动时间上趋于无序[27]。本研究中,PSD 组左侧内侧和旁扣带脑回、右侧直回的ReHo 增加。虽然有许多大脑区域参与自主神经的调控,但扣带回和杏仁核是最重要的,既往研究强调了扣带回和HRV 之间的相关关系[28]。扣带回参与情感反应的复杂环路系统的启动和调节,被认为与精神活动密切相关;左侧扣带回ReHo增加可能为机体的自适应过程,心理和生理状态调整时重新定向注意力和改变警惕状态,可能是抑郁情绪的产生机制[29]。右侧直回是前额叶皮质的一个子区域。前额叶是情感网络的关键脑区,研究显示前额叶皮质存在HRV 依赖的连接[30]。ReHo 增加,提示其对PSD 的情绪障碍有一定影响,可能是导致过度消极情绪等抑郁症状的病理基础[31]。Accolla等[32]研究显示,脑直回深部刺激可治疗难治性抑郁症,进一步支持本研究结果。
本研究中,PSD 组右侧小脑、左侧颞中回以及左侧中央前回ReHo 减少。小脑作为锥体外运动系统的主要中枢,通过丘脑调节运动皮质,形成运动输出[33];其ReHo 信号降低,表明在远离病灶的同侧小脑的运动学习和协调能力下降,而小脑对边缘-皮质-纹状体-苍白球-丘脑神经环路的影响可能在PSD 中发挥重要作用。交感/副交感神经传入后,与丘脑腹内侧直接连接,再将信息传递到更高层次的皮质区域[34],抑制运动脑区的激活。中央前回是控制躯体运动的高级中枢[35-37],也是脑梗死后脑功能重组及代偿的关键区域,在肢体运动障碍的恢复中起着重要的作用;ReHo 降低提示抑郁抑制了运动脑区,对侧运动相关脑区代偿较差。颞叶对情绪、记忆、思维等高级神经活动有显著影响,与情绪调节、语言形成、感知及输入等功能有关[38]。PSD 组左侧颞中回ReHo 减少,表明PSD 患者出现消极的认知偏向,情绪的调节障碍及自主神经的紊乱,导致语言网络整合语言信息、语言理解等功能下降,影响运动功能恢复。
综上所述,本研究通过观测HRV 各指标在PSD中的改变,发现PSD 患者自主神经功能调节与运动功能恢复相关,HRV对评估PSD后运动功能的恢复有一定价值。从ReHo 角度研究PSD 患者脑静息态功能的活动发现,自主神经对PSD 的影响不仅仅局限于同侧相关脑区,同时也影响病灶以远及对侧的认知、情绪及运动相关脑区。
本研究仅选取病程6 个月以内的PSD 患者,样本量较小,未进行随访,今后将扩大样本量,并进行随访。
4 结论
PSD 患者自主神经对情绪、认知和运动脑区的调节可能影响PSD后运动功能的恢复。
利益冲突声明:所有作者声明不存在利益冲突。

