含砷中药复方为主治疗骨髓增生异常综合征中医证型及用药规律研究
毛悦 ,靳楠 ,刘健 ,唐旭东
1.北京中医药大学,北京 100029;2.中国中医科学院研究生院,北京 100700;3.中国中医科学院西苑医院,北京 100091
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组起源于造血干细胞(HSC)的异质性髓系克隆性疾病,其特点是髓系细胞发育异常,主要表现为无效造血、难治性血细胞减少及向急性髓系白血病转化[1]。本病主要发生于老年人,而我国患者发病中位年龄约56岁[2],西医治疗主要包括支持治疗、免疫调节剂、免疫抑制剂及去甲基化药物等[1]。异基因HSC移植为MDS唯一治愈性疗法,但由于MDS异质性、患者特征及移植后并发症,大部分患者可能在移植后出现移植相关性死亡与复发[3]。本病属中医学“髓毒劳”,主要病位在脾肾,病机主要为正气虚损而感受邪毒,邪毒伏于骨髓且因毒致瘀、毒瘀互结,属正虚邪实、虚实夹杂之证,治疗多以补脾益肾、益气养阴活血、解毒化瘀为治疗法则[4-5]。中药复方是适应现代药物学认识范畴对多组分化学特征中药方剂的通称,现在方剂学复方有以二方或数方结合使用的含义[6]。砷制剂指含As2O3的砒霜及含As2S2、As4S4的雄黄[7]。青黄散始载于《奇效良方》,是由青黛、雄黄组成的含砷中药古方[8],中国中医科学院西苑医院血液科治疗MDS应用多年,并在联合健脾补肾中药中取得良好疗效[9]。除以健脾补肾为基础外,病情不同,具体用药也不同,但均属青黄散与一方或二方加减变化而成,故可称含砷中药复方。本研究探索门诊中含青黛、雄黄与其他中药组合的含砷复方治疗MDS的中医证型与组方规律。
1 资料与方法
1.1 资料来源
从医院信息系统中提取2014年4月2日-2021年10月31日就诊于中国中医科学院西苑医院血液科门诊并明确诊断为MDS的患者病案。
1.2 诊断标准
西医诊断与分型标准参考《骨髓增生异常综合征诊断与治疗专家共识》[10]与《骨髓增生异常综合征中国诊断与治疗指南(2019年版)》[1]。中医诊断标准参考《中西医结合治疗骨髓增生异常综合征专家共识》[11]与《骨髓增生异常综合征中西医结合诊疗专家共识(2018年)》[4]。
1.3 纳入标准
①中西医诊断明确,按《骨髓增生异常综合征中西医结合诊疗专家共识(2018年)》[4]辨证为气阴两虚、毒瘀阻滞证,脾肾两虚、毒瘀阻滞证与邪热炽盛、毒瘀阻滞证3种证型。②规律用院内制剂青黄散。③连续就诊于本科室,其中2014-2019年就诊次数≥60次且记录明确者纳入首末次处方2首;2020-2021年就诊次数≥36次,若处方≥18首则纳入首末处方2首,若处方记录<18首或就诊次数≥36次但仅有2~3首处方则纳入末次就诊处方1首。④药物组成及剂量明确。
1.4 排除标准
①诊断中包含其他疾病;②药物组成<4味;③患者、年龄、性别等基础信息不全。
1.5 数据库建立及整理
按照以上纳排标准筛选处方,对2次纳入证候一致者只记录一次。采取双人录入,提取信息包含:①患者就诊ID、性别、年龄、出生年月等基础信息;②患者住院信息,如入院诊断、出院诊断、住院时长、住院用药、住院次数、血型等;③患者就诊于本院的心脏超声、头颅CT、心电图、血常规、肝功能等检验及检查结果;④门诊处方、就诊次数、就诊时间、开具处方医师等。将以上信息录入Excel2019,并根据2020年版《中华人民共和国药典》[12]对药物名称进行规范,“药典”中未收录者则参考《中华本草》[13]、《中药大辞典》[14]及《中药学》[15]进行规范,如生菟丝子规范为菟丝子,红参片规范为红参,北败酱草规范为败酱草。对炮制后药物功效差异明显者分别录入,如生地黄、熟地黄,甘草、炙甘草,白术、麸炒白术,山萸肉、酒萸肉等。
1.6 数据规范及分析
将规范数据批量导入古今医案云平台2.3.5,将中药处方导入“分析池”,对年龄、性别、中医证候、中药频次、性味归经进行频次统计。设置支持度≥0.5、置信度≥0.8,对中药-中药进行关联规则分析;设置支持度≥0.05、置信度≥0.6,对证型-中药进行关联规则分析。选择lance距离,以最长距离法对频次前30位中药进行聚类分析。设置边权重为418,进行中药复杂网络分析,并应用Cytoscape3.8.0软件进行可视化。
2 结果
2.1 患者基本信息
2.1.1 性别与年龄
根据纳入及排除标准,最终纳入患者457例,其中男性207例、女性250例,未见明显差异。年龄<10岁1例,10~19岁14例,20~29岁19例,30~39岁67例,40~49岁65例,50~59岁74例,60~69岁91例,70~79岁67例,80~89岁57例,≥90岁2例,中位年龄为58岁,以60~69岁占比最大。
2.1.2 中医证型
457例患者证型结果为脾肾两虚、毒瘀阻滞证413例,气阴两虚、毒瘀阻滞证44例。
2.2 方剂分析
2.2.1 高频中药分布
819首治疗MDS处方中涉及346味中药,统计排名前20位中药,青黛与雄黄共列首位,其后为茯苓、麸炒白术、熟地黄、菟丝子、山药,见表1。

表1 819首治疗MDS处方高频中药频次(前20位)
2.2.2 性味归经分析
346味中药药性以平、温、寒为主,药味以甘、辛、苦为主,归经多属肾经、肝经、脾经,见表2~表4。

表2 819首治疗MDS处方中药药性分布
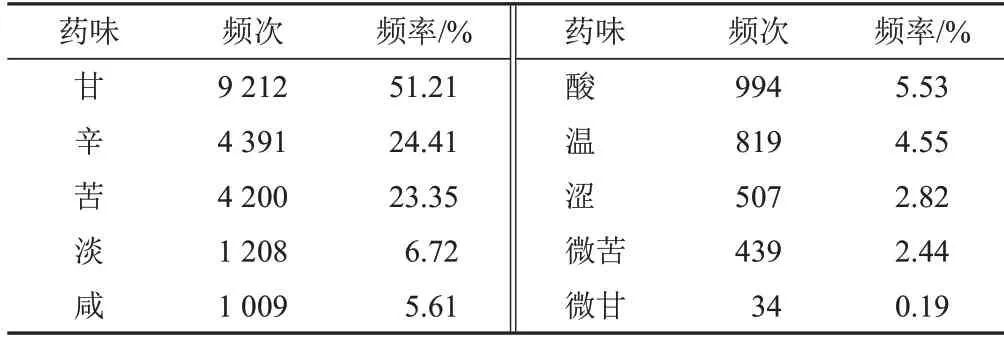
表3 819首治疗MDS处方中药药味分布
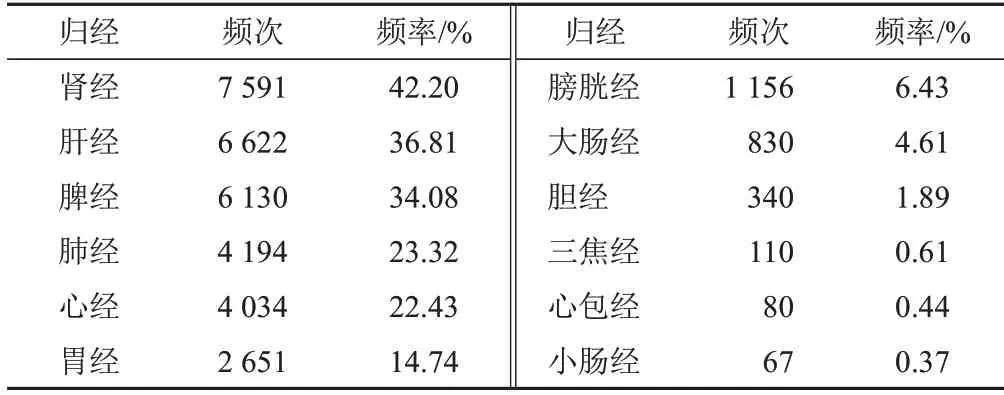
表4 819首治疗MDS处方中药归经分布
2.2.3 中药关联规则分析
对819首处方进行关联规则分析,支持度≥0.5、置信度≥0.8,得到中药关联规则51条,其中提升度排名前20位组合为菟丝子-补骨脂、山药-酒萸肉、锁阳-熟地黄、山药-熟地黄、熟地黄-酒萸肉等,见表5、图1。

图1 819首治疗MDS处方中药关联规则分析(支持度≥0.5,置信度≥0.8)
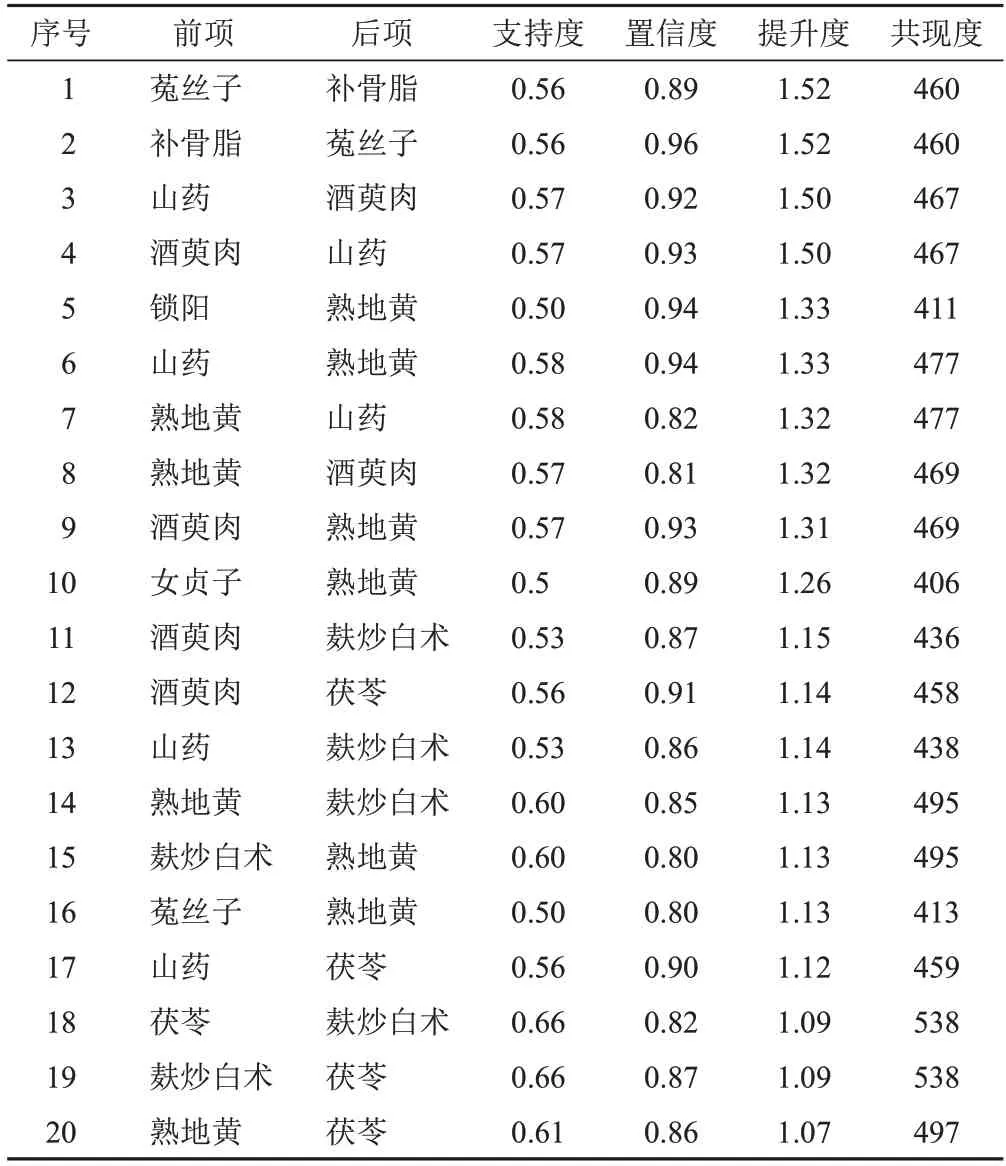
表5 819首治疗MDS处方中药关联规则(支持度≥0.5,置信度≥0.8)
2.2.4 证型-中药关联规则分析
设置支持度≥0.05、置信度≥0.6,得到证型-中药关联规则9条,其中脾肾两虚证代表脾肾两虚、毒瘀阻滞证,气阴两虚证代表气阴两虚、毒瘀阻滞证,提升度前3位的组合为气阴两虚证-茯苓、脾肾两虚证-菟丝子、脾肾两虚证-熟地黄,见表6、图2。
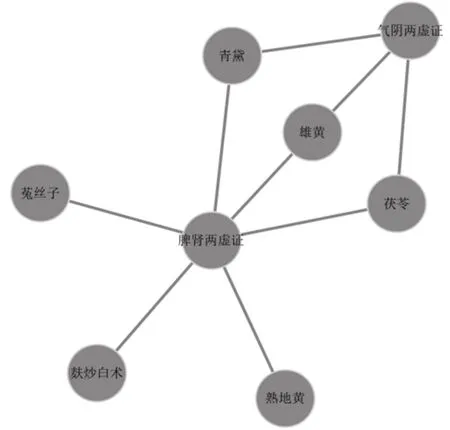
图2 819首治疗MDS处方证型-中药关联规则分析
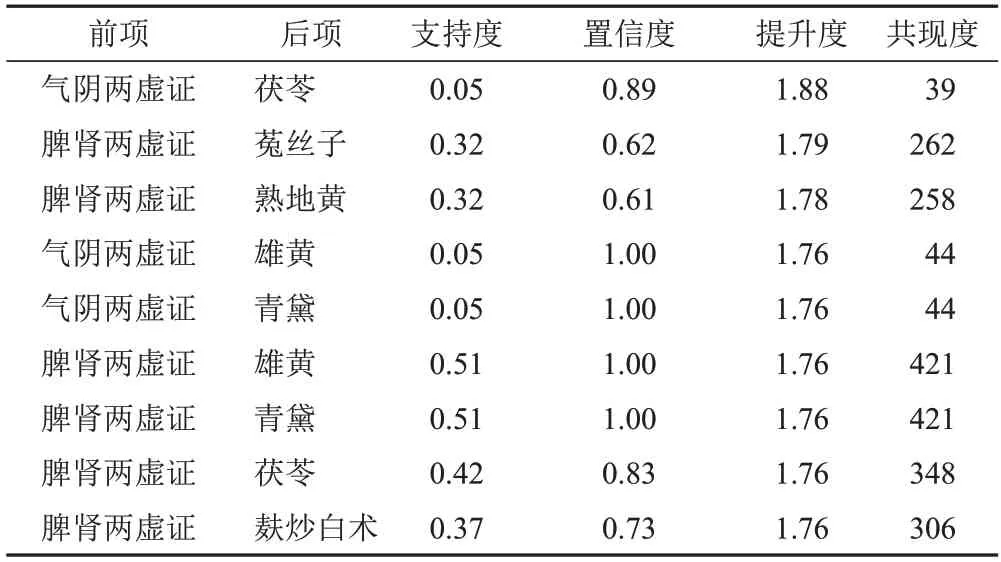
表6 819首治疗MDS处方证型-中药关联规则(支持度≥0.05,置信度≥0.6)
2.2.5 高频药物聚类分析
对使用频次前30位中药进行聚类分析,距离类型选择Lance距离,聚类方法选择最长距离法,得到4个处方组合,组1:炙黄芪、当归、陈皮;组2:炙淫羊藿、党参、炙甘草、桂枝、白芍;组3:生姜、大枣。组4所含药味多,进一步分为3个小类,类1:太子参;类2:泽泻、菟丝子、补骨脂、熟地黄、麸炒白术、茯苓、雄黄、青黛;类3:锁阳、巴戟天、枸杞子、何首乌、生地黄、桑葚、绵萆薢、女贞子、牡丹皮、山药、酒萸肉,见图3。从聚类分析结果看,组成为青黄散、四君子汤、六味地黄汤等的类方。
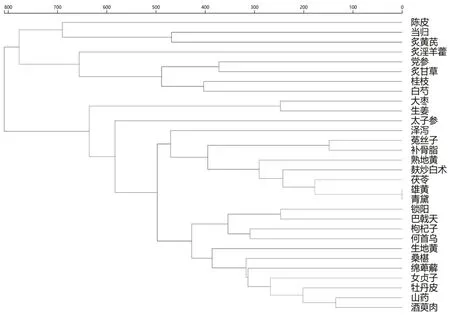
图3 819首治疗MDS处方高频药物聚类分析
2.2.6 中药复杂网络分析
设置边权重为418,网络中节点代表中药,“节点度”表示各节点中药相连边的数目,生成中药复杂网络,得到1个核心处方,包含青黛、雄黄、熟地黄、麸炒白术等22味中药,见表7。利用Cytoscape3.8.0进行可视化,见图4。
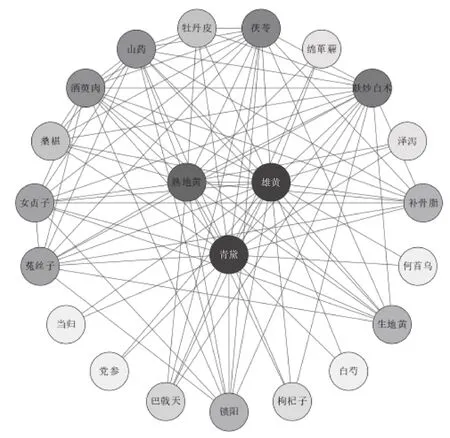
图4 819首治疗MDS处方中药复杂网络(边权重≥418)
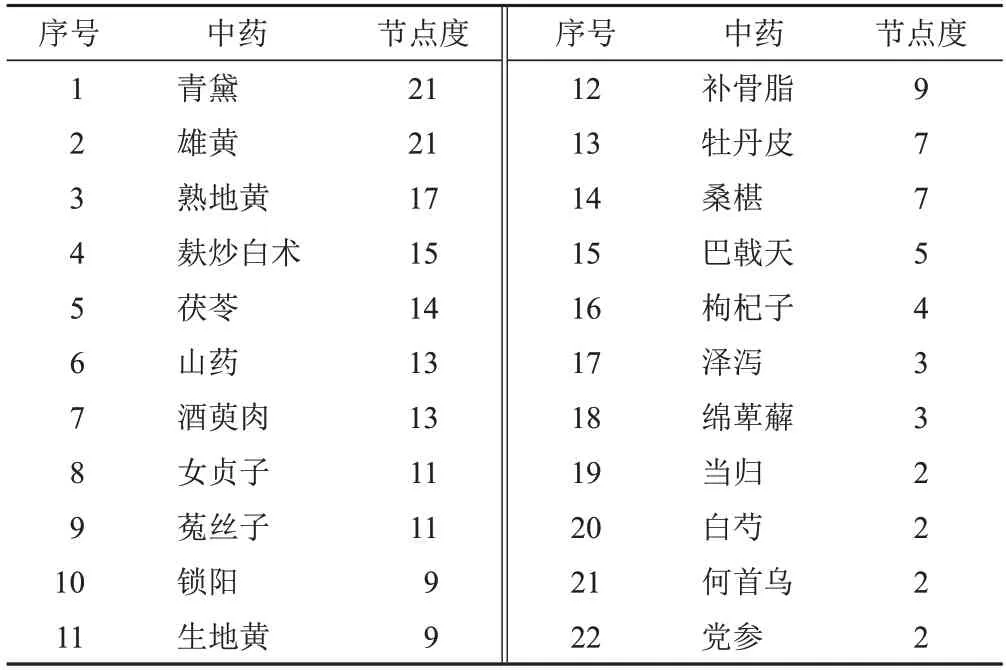
表7 819首治疗MDS处方中药-节点度
3 讨论
3.1 正气为本,助体抗邪
MDS以脾肾两虚为本,正虚无以抗邪使邪毒内侵伏于骨髓,虚、毒、瘀并存,基本病机以正虚为主、毒瘀互结,表现出脾肾两虚、气阴两虚、邪毒炽盛的不同证型。“正气存内,邪不可干”,故扶正固本为治疗MDS的重要策略。从中药频次统计结果可见,以麸炒白术、熟地黄、菟丝子、山药、补骨脂等补脾益肾类中药应用为多,从用药性味可见,以补益之甘味居首,且多归肾经、肝经及脾经,前30位中药聚类所得4类组方以六味地黄汤、四君子汤类方为主,体现了治疗MDS重视补益脾肾、扶助正气。地黄经炮制后生熟异治,生地黄性寒,长于清热凉血、养阴生津,熟地黄则寒性减弱,偏于温补,长于滋阴补血、益精填髓。药理研究表明,二者虽存在功效差异,但均可起到调节免疫、改善外周血象的作用[16-17]。白术可益气健脾、燥湿利水、止汗安胎,临床中常以麸炒后入药,可减弱燥湿作用而增强健脾功效。药理研究发现,麸炒白术可增加白术内酯Ⅰ、Ⅱ、Ⅲ含量,且以白术内酯Ⅰ含量升高最为明显[18],而在白血病细胞中白术内酯Ⅰ可发挥细胞毒性作用,又可诱导细胞凋亡与分化[19]。
3.2 辨病辨证,整体调节
含砷中药包括雄黄与砒霜两类,MDS 为正虚邪实、虚实夹杂之证,虽正虚为本,但毒邪与瘀血贯穿疾病全程,且是病机演变的关键因素,是治疗本病的关键切入点。青黄散可针对MDS毒邪用雄黄以毒攻毒,用青黛凉血、解毒、化瘀,两药合用共奏解毒祛瘀之效[8],切合MDS毒瘀互结的病机。药理研究表明,青黄散可改善MDS异常甲基化[20],联合应用补脾益肾中药可通过影响DACT1基因甲基化及缺氧诱导因子-1α水平产生临床疗效[21-22]。用药频次中青黛与雄黄共居首位,中药与证型关联规则中青黛与雄黄分别与脾肾两虚、毒瘀阻滞证及气阴两虚、毒瘀阻滞证密切相关,中药复杂网络分析中青黛与熟地黄共为核心节点,也验证了青黄散治疗MDS的重要作用。气血以通调为和,聚类中可见桂枝、白芍、炙甘草等,其中以桂枝-白芍经典药对调和营卫气血、通达血管内外[23],解毒化瘀兼调和气血、整合内外。
MDS存在多种基因突变共同作用驱动,由此导致异质性克隆性HSC疾病,而HSC主要存在于由破骨细胞、骨细胞、脂肪细胞、交感神经元、调节性T细胞、树突状细胞、自然杀伤细胞、单核细胞、巨噬细胞、T细胞、B细胞、浆细胞及肿瘤坏死因子-α、白细胞介素-1等多种成分组成的高度有序化,且处于稳态的骨髓微环境(BMME)中,炎症在其病程中起重要作用。在衰老、感染、化疗等多种因素作用下引起BMME炎症稳态的破坏,骨髓内形成炎症微环境可引起功能受损HSC数量增加、自我更新减少及偏向于髓系分化[24-25],在BMME中NLRP3炎症小体复合物、半胱氨酸蛋白酶-1与Wnt/β-catenin诱导增殖等多种炎症因素的激活也成为MDS形成的重要驱动因素[26]。整体微环境变化增加了单靶点治疗MDS的难度,中药多靶点则具有重要优势。用药频次统计中茯苓居第3位,且关联规则分析中与不同证型均存在较强相关性,药理研究中,经茯苓酸b处理的细胞内肿瘤坏死因子-α、白细胞介素-1β与白细胞介素-6可产生剂量依赖性减少现象而产生抗炎作用[27]。此机制可能与中药多靶点治疗MDS有关。故在用药中除针对毒瘀阻滞以青黄散解毒散瘀外,又多与补脾益肾、健脾化湿、益气养血、调和气血中药配伍,多角度治疗MDS。

