失代偿期肝硬化患者动脉血乳酸水平与肝肾综合征的关系
陈建辉
萍乡市人民医院检验科 (江西 萍乡,337000)
肝肾综合征(HRS)是肝硬化、肝衰竭等肝脏疾病进展至终末阶段的主要并发症之一,即各类肝脏疾病发展至终末阶段所引起的肾功能损害,通常不伴有肾脏的实质性损伤,故又称之为功能性肾衰(FRF)[1]。HRS的发病机制主要为内脏器官的血管床扩张,回心血流量减少,引起心输出量下降、动脉压下降,肾脏灌注不足,导致肾小球滤过率下降[2,3]。HRS发生率波动在60%~80%,是失代偿期肝硬化患者最主要的死因之一[4]。失代偿期肝硬化患者一旦并发HRS,临床治疗难度极大,且预后差,死亡率80%以上[5]。HRS早期的肾功能损害主要为功能性改变,及早干预治疗有助于恢复患者肾功能。因此早期识别HRS具有重要的临床价值。乳酸是葡萄糖无氧糖酵解的最终代谢产物,乳酸主要代谢场所为肝脏,50%~70%的乳酸经肝脏代谢后由肾脏排泄,动脉血乳酸水平是肝肾功能的综合体现[6-10]。本研究旨在探索失代偿期肝硬化患者动脉血乳酸水平及HRS的关系,为早期识别HRS提供临床依据。
1 资料与方法
1.1 研究对象 回顾性分析本院2020年1月至2022年1月初次诊治的失代偿期肝硬化患者54例,其中男37例,女17例,平均年龄53.13岁。所有患者均接受标准化内科综合治疗。依据2007年美国肝脏疾病学会推荐的诊断标准[3]HRS判定,①肝硬化合并腹水;②血肌酐水平>133 μmol/L;③暂停使用利尿剂2 d以上,使用白蛋白扩充血容量后血清肌酐浓度仍未下降(未下降至133 μmol/L以下),白蛋白推荐使用剂量为1 g/(kg·d),使用总量不超过100 g/d;④排除各种类型的休克;⑤短期内未服用过扩血管药或者肾毒性药;⑥排除肾脏的实质性病变,如尿蛋白浓度>500 mg/d,镜下尿红细胞>50个/高倍视野和(或)各类影像学辅助检查未提示肾脏疾病。
1.2 纳入及排除标准 纳入标准:①初诊的失代偿期肝硬化患者;②无原发性肾脏疾病患者。排除标准:①合并恶性肿瘤患者;②合并感染性休克患者;③合并其他严重性疾病患者;④临床数据不完整者。本研究已获得本院伦理审查委员会审批。
1.3 研究方法 患者入院后第1、3、5、7天常规检测动脉血乳酸值及血清肌酐浓度。采用紫外酶动力学方法测定动脉血血清乳酸浓度(正常范围为0.5~2.2 mmol/L)。血肌酐浓度测定采用肌氨酸氧化酶法(正常范围为53~115 μmol/L)。生化指标采用贝克曼AU5800生化分析仪检测,血气分析采用NOVA血气分析仪进行。初次诊治的肝硬化患者,依据有无并发HRS分为HRS组及非HRS组,分别对比两组患者基线特征、不同时间点动脉血乳酸浓度、入院肌酐浓度等。分析不同时间点动脉血乳酸浓度与HRS的相关性。根据患者住院当天动脉血乳酸浓度分为低乳酸组(<4 mmol/L)及高乳酸组(≥ 4 mmol/L),对比两组患者肝功能情况以及HRS的发生情况。按乳酸水平、是否并发HRS分为低乳酸-非HRS组(35例)、高乳酸-非HRS组(38例)、低乳酸-HRS组(5例)、高乳酸-HRS组(11例),分别观察各组患者90 d死亡率。

2 结果
2.1 HRS组与非HRS组患者基线情况比较 HRS组患者与非HRS组患者在年龄、性别以及疾病病因等方面差异无统计学意义(P>0.05)。见表1。

表1 HRS组与非HRS组患者基线情况比较
2.2 动脉血乳酸水平与HRS的关系 两组患者的入院第1天、入院第7天动脉血乳酸水平,以及入院第1天血肌酐浓度比较见表2,图1。
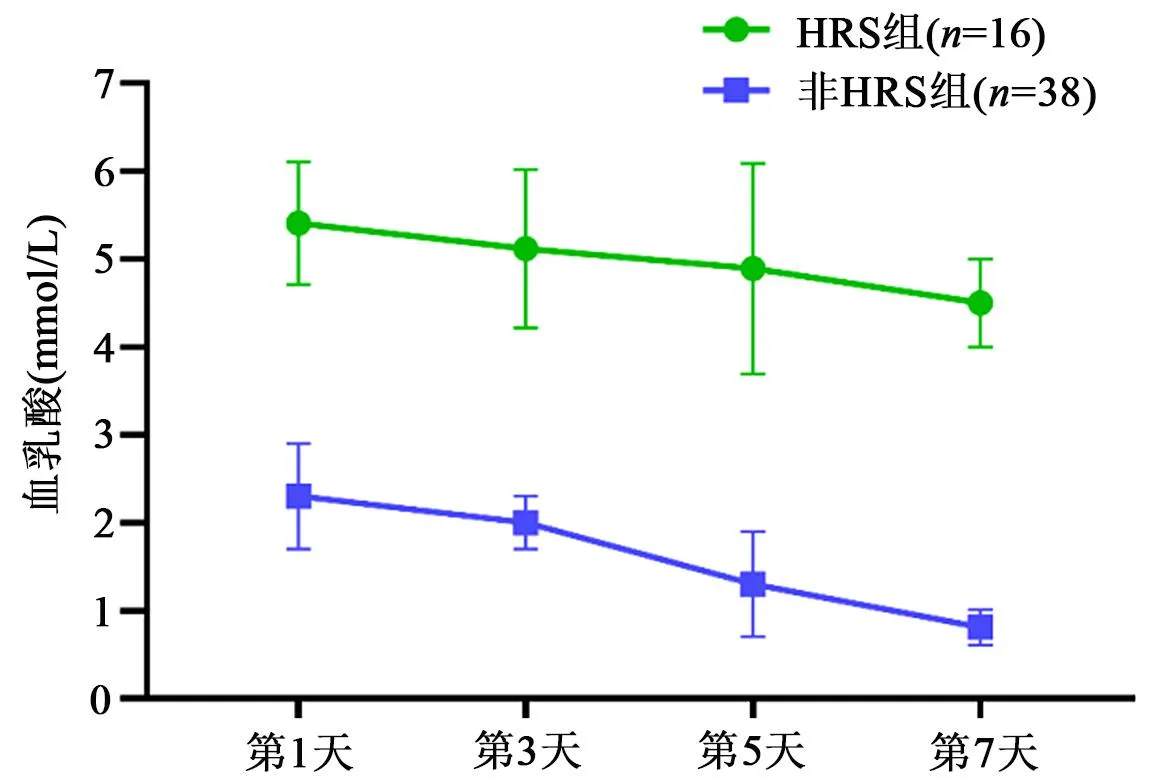
图1 HRS组与非HRS组患者不同时间点动脉血乳酸浓度变化
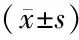
表2 HRS组与非HRS组患者不同时间点动脉血乳酸、血肌酐浓度比较
2.3 动脉血乳酸水平与HRS的相关性分析 对患者入院后不同时间点动脉血乳酸浓度与HRS的关系进行相关性分析,入院第1、3、5、7天患者动脉血乳酸浓度均与HRS发生呈现强相关(r=0.871,r=0.843,r=0.801,r=0.789,P<0.01),入院第1天动脉血乳酸浓度的相关性最强(r=0.871,P<0.01)。
2.4 不同程度动脉血乳酸水平的肝肾功能对比 依据研究设定的标准,低乳酸组患者40例(动脉血乳酸浓度<4 mmol/L),高乳酸组患者14例(动脉血乳酸浓度≥ 4 mmol/L)。低乳酸组患者肝功能Child-Pugh分级主要为B级(62.5%),而高乳酸组肝功能Child-Pugh分级主要为C级(71.4%),差异均有统计学意义。高乳酸组患者HRS的发生率比低乳酸组高66.0%(P<0.01)。见表3。
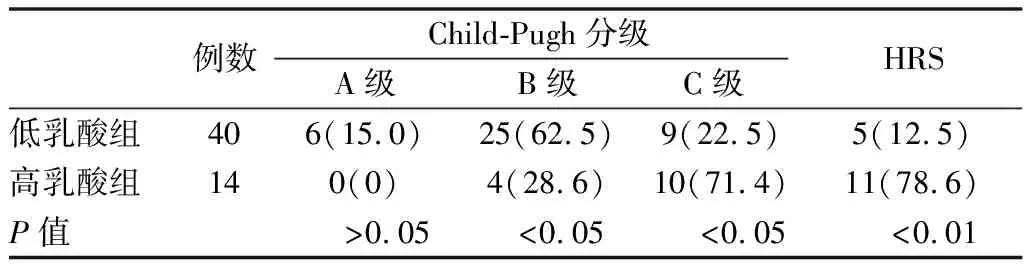
表3 不同程度动脉血乳酸水平的肝肾功能对比 [例(%)]
2.5 不同乳酸水平及HRS患者3个月生存情况对比 低乳酸-非HRS组、高乳酸-非HRS组、低乳酸-HRS组、高乳酸-HRS组患者3个月死亡分别为6例(17.1%),0例,1例(20.0%),8例(72.7%)。HRS患者合并高乳酸血症时,患者3个月死亡率最高,可高达72.7%。见图2。
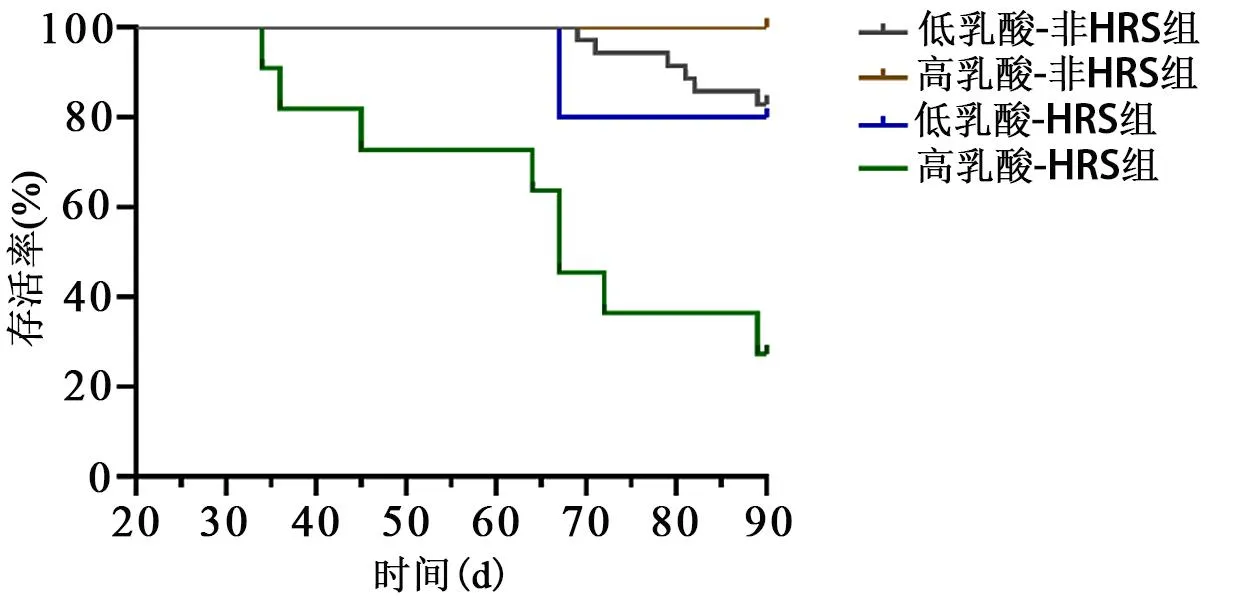
图2 不同乳酸水平及HRS患者3个月生存情况对比
3 讨论
本研究证明了失代偿期肝硬化患者动脉血乳酸水平与HRS的发生呈强相关,识别出HRS并发高乳酸血症这一高危肝硬化人群,同时提出乳酸是早期识别肝硬化患者发生HRS的重要指标。
乳酸作为无氧糖酵解的终末产物,主要生成于骨骼及肌肉软组织、脑细胞以及红细胞等场所,大部分形成的乳酸经人体消化器官-肝脏代谢后,再通过泌尿系统的肾脏分泌并排泄。导致乳酸升高的因素很多,如剧烈运动、呼吸衰竭、细胞中毒、重度贫血、重症感染等,均可以引起组织细胞的缺氧,组织细胞无氧代谢强度增加,无氧糖酵解的终末产物血乳酸随之增加[11]。已有研究证实,病理状态下的高乳酸血症,是微循环障碍、组织缺氧和细胞无氧代谢增强的反应[12-14]。
肝脏是糖类、脂肪及蛋白质三大基本营养物质的核心代谢器官,正常人群中,由于无氧代谢增强导致的乳酸增加,可以通过良好的肝肾功能清除体内过多的乳酸,其中肝脏代谢清除60%的乳酸,肾脏清除25%~30%的乳酸,两者短时间内可将乳酸水平降到正常,然而肝硬化患者残存的肝细胞摄取、转化、利用能力显著下降,不能代偿清除过多的乳酸。三大物质代谢障碍,造成无氧酵解增多,无氧糖酵解的产物乳酸水平升高[15]。肾脏是乳酸分泌排除的主要场所,肝硬化进展为肝肾综合征时进一步加重高乳酸血症。体内乳酸水平是肝肾功能状态的综合体现。因此,理论上HRS患者同时存在肝、肾双重器官功能障碍,该类患者的乳酸水平与疾病的严重程度息息相关[17]。本研究证明了失代偿期肝硬化患者动脉血乳酸水平与HRS的发生呈强相关,第1天动脉血乳酸水平≥4.0 mmol/L的初诊肝硬化失代偿期患者比<4.0 mmol/L组患者HRS的发生率升高66.0%。此外本研究还发现并发HRS的失代偿期肝硬化患者,如果动脉血乳酸水平≥4.0 mmol/L,患者3个月死亡率显著提升。本研究识别出HRS并发高乳酸血症这一高危肝硬化人群,同时提出乳酸是早期识别肝硬化患者发生HRS的重要指标。
本研究是回顾性观察研究,与前瞻性随机对照试验相比,仍然存在缺陷和不足,虽然HRS组与非HRS组患者年龄、性别及肝脏疾病病因等方面特征无差异,但其他指标仍然可能存在组间差异,可能产生偏倚而影响研究结论,未来仍需前瞻性研究消除或均衡对比各组之间的差异,提升研究质量。其次,本研究为单中心、小样本的研究,如生存分析部分,HRS患者并发高乳酸血症时3个月生存率明显下降,但未见统计学差异。因此,仍需进一步扩大样本量、开展多中心合作来验证本研究结果。

