三氯生和双酚A 对斑马鱼神经毒性的比较研究
韩晓雯,徐婕妤,王伟伟,钱秋慧,王慧利* (.苏州科技大学环境科学与工程学院,江苏 苏州 5009;.温州医科大学检验医学院生命科学学院,浙江 温州 35035)
三氯生(TCS)是一种高效的广谱抗菌剂,被广泛应用于牙膏、洗涤剂等生活用品及医疗器械中[1].TCS 生产及使用过程中被释放到环境,由于目前现有的常规污水处理方式难以完全除去TCS,导致TCS 对水生生态系统产生持续性污染影响[2-4].在水生系统中,TCS 的浓度从低到高,从纳克水平到10000 倍不等, COVID-19 以来,大量含TCS 消毒剂的使用导致部分地区儿童TCS 预估每日摄入量(EDI)已超过每日可接受摄入量(ADI)[5-6].由于其具有较长的半衰期,并且具有蓄积作用,TCS 极易对生物机体的正常生长发育造成影响,并通过生物累积作用,导致人体暴露和健康影响,从而对环境和人类造成潜在的健康风险[4-5,7].有研究显示,TCS 在母体羊水、尿液、脐带血清和母乳样本中广泛检出,对胎儿产生潜在的健康影响[8].与TCS 类似,双酚A(BPA)也因具有高效、低耐久性的优点而作为一种塑料合成材料广泛应用于人类的日常用品中,例如食品贮存容器、医用器械、供水管道与防护涂料中[9].已有研究表明,在海洋和淡水水体收集的多种鱼类体内,可检测到浓度范围为0.2~13000μg/kg 的BPA[10].已有的体内和体外实验研究表明,环境中低剂量TCS和BPA 长期作用于水生系统,对鱼类和高等脊椎动物的生殖、免疫系统、肌肉功能造成不良毒性影响以致威胁到生物安全[7,9].然而,探究人类或其他生物早期TCS 和BPA 暴露与神经发育之间的关系及其机制的相关研究较少,对TCS 和BPA 进行生物毒性相关研究和评估具有一定必要性.因此,本研究探讨与比较环境内分泌干扰物TCS 和BPA 的致毒机理,旨在为“污染性疾病”的认识、生态安全评价与环境健康维护提供参考.
1 材料与方法
1.1 实验动物
本实验以斑马鱼为模型生物,主要使用野生型AB 品系斑马鱼与转基因斑马鱼Tg(elavl3:EGFP)以及Tg(fli1:EGFP),所用斑马鱼购于国家斑马鱼资源中心,按照标准斑马鱼养殖手册饲养于斑马鱼养殖系统,雌雄成鱼分缸饲养,系统水温维持在(28.5±0.5) ℃,pH 值为6.8~7.5,光暗周期为14h 光照和10h黑暗,每日早晚分2 次投喂新鲜孵育丰年虾,并清理饲料残渣与排泄物.
1.2 实验试剂及仪器
实验试剂:三氯生(CAS No.3380-34-5, 99.9%),双酚A(CAS No.201-245-8,99.9%),均购于Sigma-Aldrich 公司(St.Louis, USA).药品溶剂为丙酮(Acetone,99.9%),购于浙江中星化工试剂有限公司.基因逆转录试剂盒购于北京宝日医生物有限公司;第一链cDNA 合成试剂盒、Trans Start@ Greenq PCR SuperMix 试剂盒来源于北京全式金公司, AO染色试剂盒以及乙酰胆碱酯酶活性检测试剂盒购于北京索莱宝科技有限公司.
实验仪器:斑马鱼养殖系统(上海海圣生物实验室有限公司)、体式显微镜(Cover-015,日本奥林巴斯)、台式低温高速离心机(Gentrifuge5424R,德国Eppendorf 公司)、制冰机(IBS-20,宁波特朗普仪器有限公司)、涡旋混合器(XW-80,上海医科大学仪器厂)、F6/F10 手持式高速匀浆机(上海净信科技公司)、Step OnePlus™ Real-Time PCR System((48 孔)美国thermofisher 科技公司).
1.3 斑马鱼胚胎的收集、染毒和饲养
基于BPA 的环境检测浓度在ng/L~mg/L 水平不等,在工业废水中甚至可以达到370mg/L[11],而TCS 的环境监测浓度在0~1000ng/L 不等,在畜牧水产养殖等特殊环境中,其监测浓度高达mg/L 级别[12].通过实验测定拟合二者对120hpf斑马鱼幼鱼的LC50 值分别为9.06 和0.51mg/L[13],本研究中BPA 和TCS 的浓度均选择250μg/L,分别不足其LC50 的1/36 和1/2.目的是使斑马鱼暴露于亚致死剂量下,以便捕捉和统计其幼鱼的表观发育畸形,运动行为异常,潜在的分子变化及深入探索潜在的分子机制.实验前一天晚上将斑马鱼按照雌雄比2:2放入产卵器中,使用透明隔板分隔雌鱼及雄鱼,次日早上开灯刺激产卵,2h 后收集胚胎.挑选优质胚胎孵育至 6h 后进行暴毒实验.设置对照组(CTR 0.01%丙酮)和药物处理组(TCS 250μg/L、BPA 250μg/L 处理组),加入预先配制的TCS 与BPA 溶液开始暴毒,每间隔24h 换液一次以保持染毒浓度,连续暴毒120h 后,进行后续实验.
1.4 幼鱼AO 凋亡染色
胚胎暴露3dpf 后,分组收集于1.5mL 离心管,加入1mL PBS 低速震荡漂洗2 次,吸去PBS 残液后,避光加入AO 凋亡染液,避光染色15min 后吸去AO 染色液,避光加入PBS 漂洗胚胎3 次.将幼鱼移至载玻片,加入鱼酚麻醉剂,于体视荧光显微镜下成像记录.
1.5 幼鱼行为学分析
将对照组、TCS 处理组以及BPA 处理组暴露5dpf 的斑马鱼幼鱼移至96 孔无菌培养板后移入Noldus(荷兰)行为分析仪观察箱,参考之前的行为学分析方法[14],利用EthoVisionXT 软件设定实验程序进行运动轨迹采集,统计运动指标.
1.6 乙酰胆碱酯酶活性检测
分别从对照组、TCS 处理组以及BPA 处理组吸取暴露5dpf 的幼鱼于FP 管中, PBS 清洗两次,吸取RIPA 液超声匀浆,2500r/min 速度下离心 15min,吸取上清液待测.样本蛋白质浓度根据碧云天BCA 蛋白浓度试剂盒操作流程进行测定.使用乙酰胆碱酯酶(AChE)测定试剂盒(北京索莱宝科技有限公司)测定乙酰胆碱酯酶(AChE)的活性.
1.7 RT-qPCR
根据制造商说明从不同处理组暴毒5dpf 幼鱼中提取总RNA,根据逆转录体系将总RNA 逆转录合成cDNA.根据TransStart Green qPCR Super Mix 试剂盒操作要求配制样本反应液,在ABI7500 仪器上运行程序进行 RT-qPCR 分析.
1.8 生物信息学分析
从有机小分子活性数据库 PubChem(https://pubchem.ncbi.nlm.nih.gov/)获取TCS 及BPA 的结构式,导入 Pharm Mapper 在线数据库(http://lilabecust.cn/pharmmapper/)对靶点进行预测,将筛选得到的药物靶蛋白导入 STRING 在线数据库(https://cn.string-db.org/),进行 String 转化,利用Metascape 数据库(https://metascape.org)及微生信在线平台(https://www.bioinformatics.com.cn)分析转化结果.
1.9 数据分析方法
数据以(平均值±标准差)(SD)表示,实验组间比较在 Tukey 排序检验之后进行单向方差分析(ANOVA),所有统计分析均以SPSS 18.0 软件(芝加哥,美国)进行,显著性水平记录为P<0.05(*),P<0.01(**),P<0.001(***).
2 结果与分析
2.1 TCS 和BPA 对斑马鱼发育的影响
为了对TCS和BPA 对斑马鱼幼鱼发育的影响作整体评价,把胚胎分为对照组、TCS 处理组和BPA 处理组,进行连续120hpf 的连续暴毒.结果发现,与对照组相比,在TCS 和BPA 暴露下,幼鱼的形态在观察下表现出多种明显表观畸形.72hpf 在TCS 和BPA 处理后幼鱼开始出现卵黄囊肿,尤其是暴露到120hpf 时TCS 处理组和BPA 处理组幼鱼畸形现象极为显著,出现例如心包水肿、脊柱弯曲和游囊发育迟缓等发育畸形现象(图1(a)).图1(b)和图1(c)量化了TCS 及BPA 的致畸率,其中BPA 组畸形率为31.6%(P<0.05),而TCS 组畸形率高达43.7%(P<0.001).

图1 TCS 和BPA 暴露对斑马鱼胚胎发育的影响Fig.1 The effects of embryo development under TCS and BPA exposure
2.2 TCS 和BPA 对斑马鱼运动行为的影响
运动行为是神经功能最直观的体现形式,且行为学检测具有普适性、稳定性和易操作性的优点,因此,神经行为检测在神经毒性的高通量筛选中被较为广泛应用[15].为探究TCS 和BPA 对幼鱼神经运动行为的影响,通过自主运动、光暗节律和声刺激实验评价TCS 及BPA 暴露对幼鱼运动行为的影响.在自主运动实验中,如轨迹示踪热图(图2(a))所示,与对照组相比,TCS 处理组和BPA 处理组幼鱼运动轨迹更单一稀疏,多为短距离游动,行为热度下降.自主运动显示(图2(b)),TCS 处理组及BPA 处理组运动距离显著降低(P<0.05).同时,TCS 及BPA处理组幼鱼移动速度也显著降低(P<0.01) (图2(c)),此外,与BPA 相比,TCS 处理组移动距离和移动速度略低,但不具有显著性.表明TCS 及BPA 暴露可导致幼鱼自主运动迟缓和活力下降,对斑马鱼的运动神经系统造成不良影响,且TCS 对斑马鱼的影响更大.
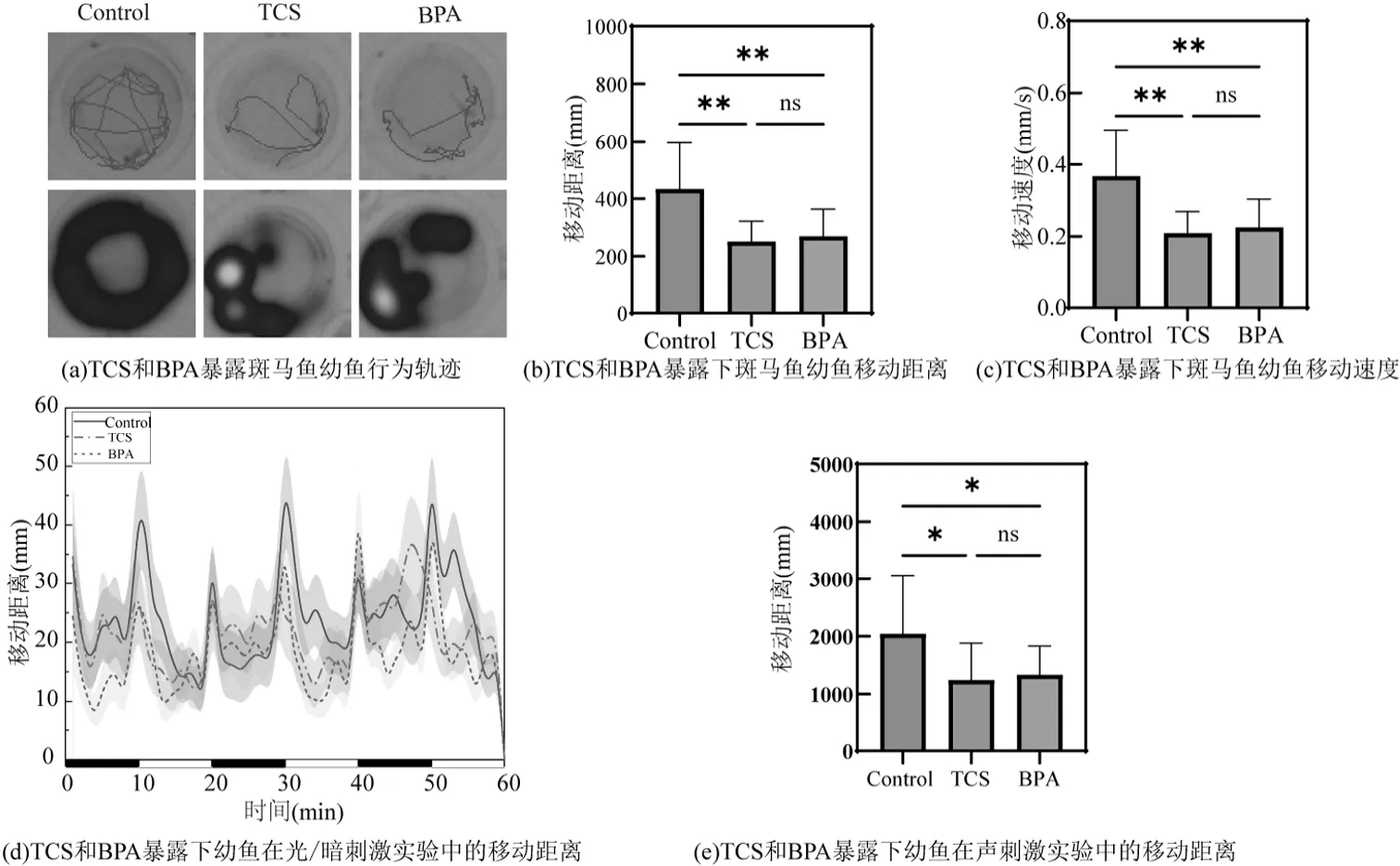
图2 TCS 和BPA 暴露下对斑马鱼幼鱼行为的影响Fig.2 Effects of TCS and BPA exposure on the behavior of zebrafish larvae
在光暗节律实验中(图2(d)),TCS 处理组和BPA处理组幼鱼对光暗交替瞬间的反应较对照组更为迟钝,行为变化较弱,且游动距离有小于对照组的趋势,运动行为活力下降,证实TCS 和BPA 暴露对幼鱼的光暗感知能力产生破坏且对相关神经有损害作用.在声刺激状态下(图2(e)),与对照组相比TCS 处理组和BPA 处理组幼鱼运动活力降低(P<0.05),表明TCS 及BPA 暴露对幼鱼听觉相关神经功能产生影响,导致幼鱼对声音刺激的敏感度和应激反应受到抑制,造成听觉功能受损.
2.3 TCS 和BPA 环境暴露对斑马鱼神经系统发育的影响
为了探究TCS 和BPA 暴露对斑马鱼幼鱼神经系统发育的影响以及它们对神经网络形成与分化的影响,对Tg(elavl3:EGFP)神经转基因斑马鱼和Tg(fli1:EGFP)血管转基因斑马鱼进行暴露.作为神经系统发育的重要标志基因,elavl3 在神经元分化中发挥重要作用,利用Tg(elavl3:EGFP)品系转基因斑马鱼可以有效观察斑马鱼神经元生长情况[16];基因fli1在血管生成中发挥作用,因此可以通过观察Tg(fli1:EGFP)转基因斑马鱼研究TCS 和BPA 对斑马鱼血管发育的影响[17].如图3(a)所示,对照组幼鱼脑部的绿色荧光清晰,而经过120hpf 暴毒的TCS 处理组和BPA 处理组幼鱼脑部荧光强度及面积下降,且出现间脑与后脑间隙模糊的情况(图3(a)白色箭头),表明TCS 和BPA 暴露后会使新生神经元细胞的数量减少,导致斑马鱼的早期神经发育受到抑制.Tg(fli1:EGFP)血管转基因斑马鱼的结果显示(图3(b)),与对照组相比,在TCS 和BPA 的暴露处理下,斑马鱼幼鱼身体和脑部血管发生消融,且脑部血管排列无序.

图3 TCS 和BPA 暴露下对斑马鱼神经系统发育的影响Fig.3 The effects of TCS and BPA exposure on the development of the nervous system of zebrafish
利用吖啶橙(AO)染色以研究TCS 及BPA 暴露对细胞凋亡的影响.结果表明,暴露至120hpf 时,对照组幼鱼脑部存在少量自然凋亡情况而TCS 处理组和BPA 处理组幼鱼脑部可观察到明显致密浓缩的绿色荧光碎片颗粒(图3(c)白色箭头),荧光强度及数量较对照组显著增强,表明TCS 和BPA 可诱导脑部细胞凋亡,影响斑马鱼的神经系统发育.
2.4 TCS 和BPA 暴露对斑马鱼幼鱼神经相关功能基因和生物标志物的影响
为了进一步探究TCS 和BPA 对斑马鱼幼鱼神经毒性的影响机制,本研究筛选了4 个神经相关功能基因(elavl3、gfap、ngn1、gap43)进行RT-qPCR验证.结果显示(图4(a)~(d)),与对照组相比,TCS 处理组及BPA 幼鱼的elavl3、gfap、ngn1、gap43 基因表达均受到抑制,其中elavl3、gfap和ngn1 表达水平显著下降,而gap43 基因表达没有显著差异,表明TCS 和BPA 都能对与神经发育相关基因的表达产生抑制作用.而乙酰胆碱酯酶(AChE)结果显示(图4(e)),与对照组相比,TCS 处理组AChE 显著增加(P<0.01),而BPA 组AChE 表达略有提升但不具有显著性.

图4 TCS 和BPA 暴露下对斑马鱼幼鱼神经发育相关基因以及生化指标的影响Fig.4 The effects of TCS and BPA exposure on neurodevelopment-related genes and biochemical indicators in zebrafish larvae
2.5 TCS 和BPA 作用靶基因的功能分析
基于上述TCS 和BPA 暴露对斑马鱼产生的神经毒性作用,为进一步分析TCS 和BPA 对生物产生毒性作用的机制和作用途径,本文通过生物信息学分析预测TCS 和BPA 的作用靶基因,并对其进行基因本体(GO)和京都基因与基因组百科全书(KEGG)分析.图5 展示了TCS 及BPA 富集排名前10 的GO terms(P<0.05),以及排名前 20 的 KEGG 途径(P<0.05).

图5 TCS 及BPA 作用的靶基因GO 功能富集与KEGG 通路富集Fig.5 GO functional classification and KEGG pathway analysis of TCS and BPA target genes
GO 分析显示(图5(a)-(b)),生物过程(Biological process)方面,TCS 的靶基因主要富集在“细胞氨基酸代谢过程(Cellular amino acid metabolic process)”、“有机酸分解代谢过程(Organic acid catabolic process) ”和“羧酸分解代谢过程(Carboxylic acid catabolic process)”等生物过程,其中“有机酸分解代谢过程”和“羧酸分解代谢过程”可以富集较多的BPA 靶基因.在细胞组成(Celluar component)方面,TCS 主要富集在“Sin3 复合体(Sin3complex)”和“线粒体基质(Mitochondrial matrix)”中,而BPA 在“线粒体基质”中也存在较多富集的靶基因.此外,BPA 的靶基因还在“过氧化物酶体(Peroxisome)”以及“微体(Microbody)”中富集.在分子功能(Molecular function)方面,TCS 主要富集在“核受体活性(Nuclear receptor activity)”和“配体激活的转录因子活性(Ligand-activated transcription factor activity)”,而BPA 则富集在“维生素结合(Vitamin binding)”和“有机酸结合(Organic acid binding)”.其中,TCS和BPA 的靶基因均可在“维生素结合”,“核受体活性”以及“类固醇结合(Steroid binding)”功能中富集.
KEGG 分析发现(图5(c)~(d)),TCS和BPA 在“癌症相关通路(Pathways in cancer)”、“碳代谢(Carbon metablism)”、“辅因子的生物合成(Biosynthesis of cofactors)”以及“谷胱甘肽代谢(Glutathione metabolism)”通路富集.值得注意的是,TCS 在“帕金森病(Parkinson disease)”、“药物代谢-其他酶(Drug metabolism-other enzymes)”和“Wnt 信号通路(Wnt signaling pathway)”富集,而BPA 在“胰岛素信号通路(Insulin signaling pathway)”、“PPAR 信号通路(PPAR signaling pathway)”、“HIF-1 信号通路(HIF-1signaling pathway)” 以及“色氨酸代谢(Tryptophan metabolism)”、“酪氨酸代谢(Tyrosine metabolism) ”、“ β- 丙氨酸代谢(Beta-Alanine metabolism)”等代谢相关通路富集,表明TCS 和BPA均能诱导神经毒性,但其诱导神经毒性的作用机制和途径可能不同.
为了比较TCS 和BPA 作用靶基因对生物的毒性作用,利用Cytohubba 对TCS 及BPA 作用靶基因的关键基因(Hub基因)进行筛选,其中TCS组排名前十的Hub 基因(图5(e))分别为EP300、RXRB、RXRG、THRB、MUC1、E2F1、BIRC5、CALML3、GCDH、ARHGEF7.其中,EP300 是自闭症谱系障碍相关蛋白和基因相互作用网络的关键枢纽,研究发现EP300在 lnc MEG3 对 CDH2 的调控中发挥重要作用,MEG3 可以通过与EP300 相互作用,上调CDH2,从而导致海马神经元的凋亡和细胞凋亡[18].Shimizu 等[19]的一项研究则证实EP300 可以调控斑马鱼视神经顶盖成体神经发生和再生神经发生过程中神经干细胞的增殖与分化,抑制EP300 的表达可以在生理条件下促进神经上皮样干细胞新生神经元的生成.BPA 组排名前十的Hub 基因(图5(f))分别为AR、PA2G4、CCNA2、MUC1、SMARCA4、HMGCS1、CLPP、INSR、HIBCH、ALK.其中PA2G4可以与受体、激酶以及一些细胞调节因子相互作用,与细胞周期调节和癌症有关,研究证实PA2G4 敲降减少神经嵴中凋亡细胞的数量,也导致有丝分裂细胞的减少,表明PA2G4 在控制神经板,神经嵴和颅板结构域的大小方面发挥关键作用[20].值得注意的是MUC1在TCS 和BPA 作用的靶基因中均发挥重要作用.MUC1 是一种跨膜粘蛋白样糖蛋白,是Toll 样受体(Toll-like receptor,TLR)信号传导的负调节因子,可以抑制TLR 激活引起的促炎反应,抑制TLR 介导的NF-κB 活化[21].NF-κB 可以激活细胞增殖和炎症等细胞生物学过程,有研究证实NF-κB 可以调节星形胶质细胞中促炎因子的分泌,调控星形胶质细胞活化标志物GFAP 的表达[22].
综上所述,TCS 和BPA 可以通过作用于神经相关的Hub 基因诱导神经毒性作用,其中抑制神经元发育和诱导细胞增殖或凋亡异常是TCS 和BPA 诱导神经毒性的重要方式.基于生信分析本文对TCS和BPA 诱导神经毒性的作用途径和机制进行分析和比较,而在之前的实验中,本文也证实了TCS 和BPA 急性暴露会诱导斑马鱼神经元的发育异常和细胞凋亡增加.这些发现有利于进一步的了解TCS和BPA 诱导的神经毒性效应和作用机制的异同.
3 讨论
作为典型的环境内分泌干扰物,TCS 和BPA的亲脂性和较强的生物蓄积能力导致其极易对生物造成毒性作用,越来越多的实验证实了TCS 和BPA 对免疫、生殖、神经以及内分泌系统的影响.基于斑马鱼 (Daniorerio)转基因品系丰富和中枢神经系统在功能上与人类神经系统高度相似等特点[23],本研究选择环境中常见的两种典型内分泌干扰物TCS 和BPA 为对象,以斑马鱼为模式生物,探究TCS 和BPA 对斑马鱼神经发育和运动行为的影响.
为了评价TCS 和BPA 对斑马鱼胚胎发育的影响,本研究统计了亚致死剂量暴露下TCS 和BPA 诱导胚胎及幼鱼的畸形情况,发现TCS 和BPA 暴露会导致幼鱼的形态出现多种明显表观畸形,如卵黄囊肿、心包水肿、脊柱弯曲及游囊闭合发育迟缓的情况,且与BPA 处理组相比,TCS 处理组幼鱼畸形情况更为严重,表明TCS 和BPA 具有明显的致畸反应.在Sun 等[24]的研究中发现TCS 和BPA 对斑马鱼幼鱼均有较为明显的致畸作用,大部分发育异常的斑马鱼出现两种或两种以上的畸形情况,主要表现为卵黄囊肿、心包水肿和脊柱弯曲,这与本研究的发现相似.此外,其研究发现BPA 暴露导致的畸形率略高于TCS 暴露诱导的畸形率,而在本研究中TCS 致畸率更高,这可能是本研究与其研究暴露浓度不同导致.脊柱弯曲和头部畸形与神经细胞失调有关[25],因此需要进一步研究TCS 和BPA 暴露对神经发育的影响.
斑马鱼幼鱼行为模型可以检测大脑和神经系统的功能变化,例如空间和社交学习、记忆、焦虑以及由神经递质驱动的社交或疾病行为,斑马鱼对光暗刺激和声音做出反应的游泳则是一种反射反应,可以反应对光照及声刺激的敏感性和感知神经的功能[15].在本研究中斑马鱼幼鱼对外界刺激的反射行为以及运动能力发生了改变.自主运动、光暗节律和声刺激行为学实验显示,TCS 和BPA 暴毒可导致幼鱼运动距离和游动速率降低,运动行为活力下降,并损伤幼鱼对光暗刺激和声音刺激的感知神经功能,对斑马鱼幼鱼运动行为有明显抑制作用.Ling等[25]研究了TCS 对斑马鱼运动行为的影响,证实TCS 会导致斑马鱼自主运动活力下降并破坏斑马鱼幼鱼的昼夜节律;Heredia-García 等[26]则对BPA诱导的行为障碍进行研究,发现BPA 暴露浓度为220μg/L 时会扰乱斑马鱼的运动行为,具体表现为移动距离的降低,这与本研究的结果相似, 表明TCS和BPA 会导致运动神经系统和感知神经功能障碍,且与BPA 相比,TCS 对神经行为的影响更大.
基于上述TCS 和BPA 暴露对斑马鱼幼鱼大脑发育和运动行为的影响,考虑到运动行为的改变可能与神经元结构以及神经传递有关,本研究分析了TCS 和BPA 暴露对斑马鱼神经元发育的影响[27].在斑马鱼早期神经发育过程中,elavl3 基因承担十分关键的作用,elavl3 基因缺位会导致视觉神经系统缺陷,伴随神经系统发育不良,是神经系统发育的重要标志基因[16].由于脉管发育与神经系统发育密不可分,而fli1 基因在血管生成中起着重要作用[17].转基因斑马鱼幼鱼的绿色荧光观察结果表明,TCS 和BPA具有神经毒性作用,会抑制中枢神经发育和血管生成,导致中枢神经元细胞荧光强度和面积下降,血管消融和头部血管排列杂乱无序,证实TCS 及BPA 暴露会对斑马鱼神经元发育和血管发育产生影响.在之前.Wang等[29]证实TCS暴露浓度为250 μg/L时会导致大脑神经元数量减少,后脑和间脑间隙模糊不清[28].血管生成是一个较为复杂的过程,血管发育对维持大脑功能具有重要作用.在本研究中发现TCS和BPA 暴露会导致头部血管无序分布,出现血管消融的情况,这与之前的研究相似[29].据报道,TCS 可诱导神经元细胞凋亡,Szykowski 等[30]研究发现TCS激活了芳香烃受体(AhR)依赖性细胞凋亡,并影响了小鼠新皮质神经元原代培养物中细胞色素P450 酶Cyp1a1 和Cyp1b1 的表达;Qi 等[31]的研究发现BPA会以浓度依赖性方式降低细胞活力并诱导细胞凋亡,在暴露于50 和70 μmol/L BPA 的细胞中观察到细胞凋亡引起的细胞死亡,这与本文的研究结果一致.在本研究中TCS 和BPA 暴露下均出现了细胞凋亡信号增加的情况,表明TCS 和BPA 可通过诱导脑部细胞凋亡,对斑马鱼产生神经毒性作用.
为了从分子层面探究TCS 和BPA 对斑马鱼神经发育的影响,本研究通过RT-qPCR 分析了TCS 及BPA 急性暴露对斑马鱼的四种神经相关基因(elavl3、gfap、ngn1、gap43)的表达水平的变化.elavl3、gfap、ngn1、gap43 基因都是与斑马鱼神经系统发育具有较强关联性的基因,在神经元发育、神经细胞的细胞命运、神经元轴突生长与再生过程中发挥重要作用,对评价神经系统发育具有重要意义[32].elavl3 基因和ngn1 基因是神经元发育的标记基因,elavl3 基因表达的缺失会引起视觉神经系统损伤,并导致神经发育损伤[16].ngn1 基因与神经轴突生长有较强关联,ngn1 也在神经细胞的细胞命运过程中发挥作用[33].研究发现gfap是一种在中枢神经系统的成熟星形胶质细胞的骨架中表达的中间丝蛋白,该基因可作为一种生物标记物分析斑马鱼神经毒性,gfap基因表达量的下调表明神经胶质细胞可能受到损伤[34].gap43 基因与神经元轴突生长和再生有关,在神经受损重新生长时诱导轴突再生长,当神经元轴突再生发育时表达量上升[35].郭子一等[13]探索了三种内分泌干扰物对斑马鱼神经毒性效应和机制,发现elavl3、ngn1 和gfap在Hub 基因和神经标志功能基因蛋白间的互作网络发挥重要作用.本研究RT-qPCR 结果证实,TCS 和BPA 暴露会改变与斑马鱼幼鱼神经发育相关基因的表达水平,导致elavl3、gfap和ngn1 表达下降而对gap43 的表达没有显著影响,且TCS 对这几个神经相关基因的表达水平的影响更大.基于TCS 及BPA 处理下神经发育相关基因表达水平的变化可以推测,TCS 和BPA 暴露通过抑制elavl3、ngn1 和gfap的表达,影响神经细胞的生长,造成神经系统损伤,且亚致死剂量下TCS 比BPA 对神经系统的损伤更严重.
乙酰胆碱酯酶(AChE)具有催化神经突触间隙中乙酰胆碱水解的功能,在神经系统信号传递过程中起到非常关键的作用,可作为生物标志物来检测发育性神经毒性,且与运动行为具有关联性,其活性变化可作为衡量神经毒性的重要指标之一[36].已有研究表明,TCS 可以通过调控AChE 的表达,造成运动行为障碍并诱导神经毒性[27];Murugan 等[37]则证实BPA可以通过改变AChE 活性和诱导氧化应激对斑马鱼诱导神经毒性作用.本研究中AChE 结果表明,TCS 和BPA 暴露会影响神经冲动的正常传递,且TCS 组对神经传递的影响更大.
为进一步分析TCS 和BPA 诱导神经毒性的机制,基于生物信息学对TCS 和BPA 的作用靶基因在功能和富集通路上的异同进行分析,结果显示TCS与BPA 在功能和涉及的通路上具有一定的相似性.值得注意的是,尽管TCS 和BPA 的靶基因在影响神经发育相关通路均有富集,但其诱导神经毒性的作用通路存在一定差异.TCS 靶基因在“配体激活的转录因子活性”以及“Wnt 信号通路”富集.芳香烃受体(AhR)是一种配体激活的转录因子,可以调控外源化合物代谢和控制细胞周期[38].之前的研究表明TCS 可以通过与芳香烃受体相互作用,降低大脑皮质层神经元中NF-κB 蛋白的表达,诱导神经毒性和细胞凋亡[30,39].最近的一项研究证实TCS 可能充当内分泌干扰物,影响小鼠神经元中Sirt1、Sirt3和AhR蛋白的表达,从而影响大脑中的神经激素平衡[40].Wnt 通路与胚胎发育、突触生成与神经发生密切相关,Wnt 信号通路激活可抑制病理性神经炎症的发生[41].BPA 的靶基因在胰岛素信号通路、PPAR 信号通路、HIF-1 信号通路以及色氨酸代谢等代谢相关通路富集.PPAR 信号通路可以调节脂质代谢,最近的研究表明PPARs 的一种亚型PPARγ 具有抗氧化和抗炎功能,主要通过影响Wnt 信号通路、NF-κB信号通路等调控突触可触性,发挥神经保护作用[42].色氨酸是人体必需氨基酸之一,与神经递质和蛋白质的产生密切相关,在中枢神经系统疾病和自身免疫疾病的发生和发展中发挥重要作用[43].TCS 和BPA 结构的区别可能是造成作用靶基因及基因富集通路不同的重要因素.TCS 可以通过影响生物的合成与代谢产生神经毒性,而BPA 则通过影响色氨酸、络氨酸等氨基酸代谢以及PPAR 通路诱导神经炎症的发生,产生神经毒性.Hub 基因筛选发现TCS和BPA 均能直接或间接作用于神经相关的Hub 基因,抑制神经元发育和诱导细胞异常增殖和凋亡,从而诱导神经毒性,这与之前的研究及我们实验得出的结果相符.这些发现有利于进一步的了解TCS 和BPA 诱导的神经毒性效应和作用机制的异同.
4 结论
4.1 TCS 和BPA 可诱导斑马鱼幼鱼产生卵黄囊肿、心包水肿、脊柱弯曲等畸形情况, 此外,与对照组相比,TCS 暴露组致畸率为43.7%(P<0.001),而BPA 致畸率为31.6%(P<0.05),表明TCS 和BPA 暴露诱导斑马鱼幼鱼发育畸形,且相同剂量下TCS 对幼鱼发育的影响更大.
4.2 行为学分析发现,TCS 和BPA 暴露导致幼鱼运动活力下降,表现为移动距离和移动速度显著降低(P<0.05、P<0.01);此外,光暗周期和声刺激实验发现TCS 和BPA 暴露损伤幼鱼对光暗刺激和声音刺激的感知神经功能,导致斑马鱼幼鱼对光暗刺激和声刺激敏感性降低.
4.3 TCS 和BPA 暴露影响斑马鱼神经和血管发育,减少中枢神经元的表达,并造成血管分布杂乱和血管消融.此外,TCS 和BPA 暴露还会导致头部凋亡细胞数量增加,且TCS 比BPA 对神经和血管发育以及细胞凋亡的影响更大.抑制中枢神经元细胞的表达并导致血管发育障碍血管消融,且这种抑制可能是通过细胞凋亡诱导的.
4.4 生化指标检测发现TCS 和BPA 通过影响斑马鱼幼鱼体内乙酰胆碱酯酶活性,对神经传导产生影响.RT-qPCR 结果显示,TCS 和BPA 会降低与斑马鱼幼鱼神经发育相关基因的表达水平,减少elavl3、gfap和ngn1 的表达,而对gap43 的影响不显著,表明TCS 和BPA 影响乙酰胆碱酯酶以及elavl3、gfap、ngn1 和gap43 的表达,且TCS 对这些神经发育相关基因和乙酰胆碱酯酶的影响更大.
4.5 针对靶基因的GO 和KEGG 分析则说明TCS和BPA 作用的靶基因富集的功能和通路有一定相似性,均会对神经系统发育和功能产生影响,但TCS的内分泌干扰有关基因功能富集更为显著,但二者涉及相关神经发育的代谢通路有所不同,TCS 可能通过内分泌干扰诱导神经毒性,而BPA 则可能通过影响氨基酸的合成与代谢诱导神经炎症和神经疾病的发生.此外,诱导神经元发育异常和细胞增殖和凋亡异常也是TCS 和BPA 诱导神经毒性的潜在机制.

