基于生信分析纳米银对斑马鱼的毒性和机制
范子怡,宋 杰,杨 正,冯 晨,葛文浩,王慧利,钱秋慧 (苏州科技大学环境科学与工程学院,江苏 苏州 215009)
纳米银具有独特的光学性质、抗菌性能以及导电能力,因此在生物医疗、化学和电力工程等领域被广泛地应用[1].据报道,约有30%的商用纳米银会进入淡水环境,浓度达到约0.1g/L,而废水和受污染河流中的浓度则更高[2].由于纳米银粒径较小,它们极易进入生物体内并对其产生毒性作用,例如,当纳米银浓度达到1.9×10-10mol/L 时,斑马鱼胚胎就会遭受严重损伤[3].
纳米银的毒性效应与其粒径和表面涂层密切相关.纳米银的粒径可以影响细胞对其的摄取率,这是因为纳米银的粒径决定了其比表面积,进而影响纳米银进入细胞或生物体的途径以及对生物体的毒性作用[4].例如,相较于20nm 和70nm 粒径的纳米银,4nm 粒径的纳米银在人巨噬细胞U937 中表现出明显的细胞毒性和氧化应激反应[5].相似地,Kim 等[6]也证明20nm 粒径的纳米银比110nm 的纳米银对斑马鱼胚胎具有更强的毒性.Lee 等[7]进一步揭示了纳米银毒性与粒径关系的可能机制,发现粒径较小的纳米银(30~72nm)可以通过绒毛膜通道被动进入斑马鱼胚胎,进而干扰其正常的发育过程.以上研究证实了纳米银的毒性效应具有粒径依赖性,其中较小粒径的纳米银显示出更强的毒性效应.此外,表面涂层对稳定溶液中的纳米银起到重要作用,常见的表面涂层有柠檬酸钠(CIT)、聚乙烯吡咯烷酮(PVP)、多糖和表面活性剂等,其中PVP 和麦芽糖两种涂层的纳米银因其优异的稳定性和生物相容性被广泛研究和使用.一些研究还表明,纳米银的表面涂层在其毒性中发挥了重要作用.研究表明,涂层材料的不同导致了生物体对纳米银不同的毒性效应和积累方式.具体来说,使用支化聚亚乙基亚胺(BPEI)作涂层的纳米银显示出对母鼠的肝脏和大脑的毒性,且这种影响有可能延伸至后代[8].此外,斑马鱼在暴露于麦芽糖涂层纳米银后,在其鳃、肝脏和肠道中银的积累量显著增加,并在鳃部位出现炎症和增生现象[9].CIT 和PVP作为涂层的纳米银能够在大鼠体内引起严重的呼吸系统炎症[10].在比较CIT 和PVP 作为涂层时,研究发现CIT 涂层的纳米银对斑马鱼产生了更强的神经[11]、鱼鳃和肠道毒性[12],进一步强调了不同涂层材料对纳米银毒性影响的差异.上述研究表明,纳米银的毒性效应与其粒径和表面涂层密切相关.
斑马鱼因其体积小、易于培养、胚胎透明度高、繁殖周期短、与人类高达87%的基因相似度[13],以及肝脏中众多与哺乳动物同源的脂质代谢酶等特点,在毒理学研究中发挥着重要作用[14].这些特性不仅使其成为评价水生生物毒理学的理想模型,也提供了模拟人类生物响应的有效平台.斑马鱼对外源化学物质的防御机制,包括酶的诱导和氧化应激反应等,与哺乳动物相似,进一步增强了其作为研究模型的价值.
随着环境污染物研究的深入,特别是新型纳米污染物如纳米银的生物安全性和环境毒理效应成为科学界关注的热点.纳米银因其独特的理化特性及复杂多变的环境行为,对生物体可能产生的影响备受关注.本研究采用生物信息学方法,对不同粒径和涂层的纳米银对斑马鱼胚胎发育的毒性影响进行分析,探索其可能的毒性机制.通过整合和深入分析GEO 数据库中的相关数据集,全面比较纳米银的毒性特性,揭示其作用于生物体的具体机理.这种结合斑马鱼这一毒理学模型生物和生物信息学技术的方法,为纳米银的毒性评估提供了新的视角.
1 材料与方法
1.1 芯片数据获取、质控和差异基因筛选
从NCBI(www.ncbi.nlm.nih.gov)的GEO 数据库下载基因芯片数据集:GSE50718、GSE61186 和GSE89653,对这些数据集进行一系列分析,包括表达量箱式图、PCA 主成分分析和聚类分析.使用R 软件的Limma 包进行差异基因筛选.GSE50718 数据集[15]来源于韩国NEXBIO 公司,公开于2016 年1 月,试验生物为斑马鱼幼鱼.在GSE50718 数据集中,选择了对照组(Control)、PVP 组(PVP,0.1mg/L)、150nm PVP 涂层纳米银组(PVP-AgNPs-150nm,1mg/L)、50nm PVP 涂层纳米银组(PVP-AgNPs-50nm,1mg/L)和银离子组(AgNO3,20μg/L),一共15 个幼鱼样本,其中空白对照组3 个样本,四种处理组各有3 个样本.空白对照组即未做任何处理的斑马鱼幼鱼,PVP 组的浓度依据PVP 涂层纳米银组的PVP 含量(10%)所设,银离子组的浓度约为纳米银暴露在介质中所测得的浓度.将72-hpf 幼鱼暴露于上述各组药物中96h 后,提取RNA 进行转录组学分析.除了暴露药物不同,所有组均在同一实验条件下进行.GSE61186数据集[16]来源于卢森堡科技院,公开于2015 年1 月,试验生物为斑马鱼幼鱼.在GSE61186 数据集中,选择了对照组(Control)和 20nm 无涂层纳米银组(AgNPs,10μg/L),一共9 个幼鱼样本,其中空白对照组6 个样本,处理组3 个样本.空白对照组即未做任何处理的斑马鱼幼鱼,除了暴露药物不同,所有组均在同一实验条件下进行.GSE89653 数据集[17]来源于巴斯克大学,公开于2018 年7 月,试验生物为斑马鱼成鱼.在GSE89653 数据集中,选择了暴露时间为21d的对照组(Control)和20nm 麦芽糖涂层纳米银组(Maltose-AgNPs,10μg/L),一共9 个成鱼肝脏样本,其中空白对照组4 个样本,处理组5 个样本.将4 月龄成鱼暴露于上述药物中21d 后,提取RNA 进行转录组学分析.空白对照组即未做任何处理的斑马鱼成鱼肝脏,除了暴露药物不同,所有组均在同一实验条件下进行.本文将数据集中的对照组与其他处理组进行差异分析.差异分析结果通过以下的阈值条件进行筛选:P<0.05,|log2FC|>1.接着将筛选出的差异基因进行交集,以探索不同粒径和涂层的纳米银暴露组差异基因的不同.
1.2 差异基因功能富集分析
使用R 中的clusterProfile 包对各组筛选后的差异基因进行GO 和KEGG 功能富集分析,并进行全基因集的GSEA-KEGG 富集.富集分析物种类型选择斑马鱼,设定P阈值为0.05,使用BH 方法进行多重检验校正.GO 分析用于注释目标基因的细胞组分、分子功能和生物过程.KEGG 分析用于预测和分析基因富集的生物学通路.
1.3 差异基因相互作用分析
将各组筛选后的差异基因导入在线数据库STRING(https://string-db.org),设定综合分数阈值为0.4,筛选出相互作用关系较强的基因.然后,利用Cytoscape3.9.0 软件进行可视化分析,通过生物分子相互作用网络的形式,将高通量基因表达数据和分子状态信息有机整合在一起.在Cytoscape 中,利用CytoHubba 插件中的最大团中心度(MCC)算法进行计算,寻找关键的hub 基因,以构建纳米银/银离子与斑马鱼胚胎基因蛋白质的互作网络.
1.4 差异基因合并分析
由于GSE61186 数据集中的无涂层AgNPs 和GSE89653 数据集中的Maltose-AgNPs 具有相同的粒径和浓度,本文将这两个数据合并进行分析,进而通过质控、差异基因筛选和功能富集分析以揭示涂层对纳米银毒性的影响.
2 结果与分析
2.1 数据集质控
考虑到数据的可靠性,针对GSE50718数据集数据的质量情况进行了检查,如图1 所示.箱式图显示,数据的分布趋势基本一致,表明数据经过了一定标准化处理.通过PCA 主成分分析,发现数据具有一定的区分度.聚类分析也展示了相关组别的分类与联系.尽管有一组PVP 样本被聚类到了对照组,以及一组 PVP-AgNPs-150nm 样本被聚类到了 PVPAgNPs-50nm 组,但总体上聚类结果的区分度较高,数据具有一定的可重复性.

图1 GEO 芯片数据质控图(GSE50718)Fig.1 Quality control chart for GEO microarray data (GSE50718)
2.2 差异基因表达分析
针对GSE50718 数据集,根据筛选条件(P<0.05,|log2FC|>1)进行了差异基因表达分析.结果显示,与空白对照组相比,PVP(0.1mg/L)处理的斑马鱼幼鱼共有171 个基因的表达被改变,其中126 个基因上调,45 个基因下调;在PVP-AgNPs-150nm (1mg/L)处理组中,共有300 个差异基因,其中239 个上调,61 个下调;在PVP-AgNPs-50nm (1mg/L)处理组中,共有1224 个差异基因,其中1106 个上调,118 个下调;在AgNO3(20 μg/L)处理组中,共有969 个差异基因,其中603 个上调,366个下调.随后,使用R 软件中的ggplot2包绘制了相应的差异基因火山图,如图2(a~d)所示,并使用pheatmap包绘制了前50个差异基因的热图(图2(e~h)),以进行可视化的差异基因表达分析.
2.3 各组调控差异基因分析
对以上4 组以P<0.05 和|log2FC|>1 筛选条件筛选出的差异基因进行交集分析,并通过韦恩图进行可视化,如图3 所示.结果显示,PVP 和纳米银处理组(PVP-AgNPs-50nm、PVP-AgNPs- 150nm)大部分差异基因呈现上调趋势,AgNO3组的上调和下调基因数量相近.其中,PVP 与PVP- AgNPs-150nm 组共有40 个交集差异基因,PVP 与PVP-AgNPs-50nm 共有90个交集差异基因,PVP- AgNPs-150nm与PVPAgNPs-50nm 共有 172 个交集差异基因,PVPAgNPs-50nm 与AgNO3共有219 个交集差异基因(图3a).为了进一步说明交集差异基因的调控情况,本文对各组的上调和下调差异基因分别进行了交集分析.PVP 与PVP-AgNPs-50nm 共有87 个上调、3 个下调交集差异基因,分别占两组总基因数的8%和2%;PVP- AgNPs-50nm 与AgNO3共有190 个上调、20 个下调交集差异基因,分别占两组总基因数的13%和4%;PVP-AgNPs-150nm 与PVP-AgNPs-50nm 共有153 个上调、19 个下调交集差异基因,分别占两组总基因数的13%和12%;PVP 与PVPAgNPs-150nm 共有26 个上调、13 个下调交集差异基因,分别占两组总基因数的8%和14%(图3(b~i)).上述结果表明PVP- AgNPs 和AgNO3可能在许多生物过程中发挥各自的作用,并且对斑马鱼幼鱼基因表达改变的程度:PVP- AgNPs-50nm > AgNO3>PVP-AgNPs-150nm.

图3 各处理组DEGs 的韦恩图Fig.3 Venn diagram of DEGs in each treatment group
2.4 差异基因功能富集分析
为深入评估上述差异基因的生物学特性,使用R 包对差异基因进行功能富集分析,并对相关基因及其参与的生物过程进行注释,如图4(a~d)所示.
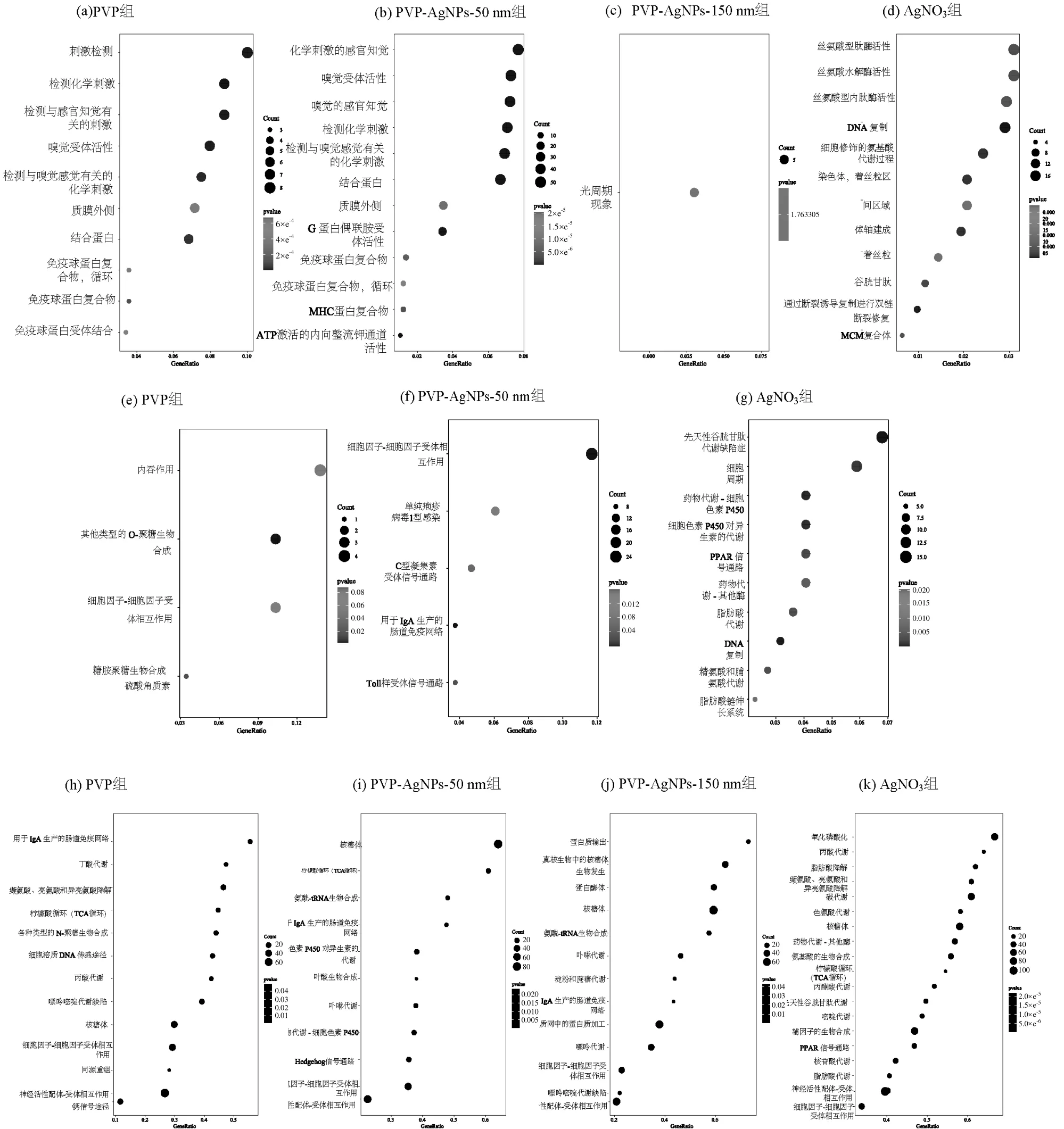
图4 各处理组DEGs 的GO、KEGG 和GSEA 富集分析Fig.4 GO, KEGG and GSEA enrichment analysis of DEGs in each treatment group
结果显示PVP 组的差异基因显著富集在化学检测、感官神经和免疫蛋白影响等生物过程;PVPAgNPs-150nm 组的差异基因主要在光周期现象相关的生物过程中得到富集;PVP-AgNPs-50nm 组的差异基因主要富集的生物过程与PVP 组类似,而AgNO3组的差异基因主要富集在氨基酸代谢、胚胎发育、DNA 损伤以及氧化应激等生物过程.AgNO3和PVP-AgNPs-50nm 组的差异基因都富集了12 个生物过程,而PVP 组和PVP-AgNPs- 150nm 组的差异基因分别在10个与1个生物过程中得到富集.此外,还进行了差异基因的KEGG 通路富集分析,如图4(e~g)所示.结果显示,PVP 组的差异基因显著富集在内吞作用和细胞因子相互作用; PVP-AgNPs-150nm组的差异基因未富集到相关的KEGG 通路;PVPAgNPs-50nm 组的差异基因主要富集在细胞因子相互作用、肠道免疫功能和Toll 样受体信号等通路上;而AgNO3组的差异基因主要富集在氨基酸代谢、脂质、氧化应激、异物检测和代谢以及PPAR 信号通路等.在GO 和KEGG 通路分析中,AgNPs 处理组中未发现与AgNO3暴露相关的生物过程.这一发现可能表明纳米银具有不同于AgNO3的独特基因毒理学特征.为了准确描述各处理组对斑马鱼胚胎的影响,本文采用了GSEA 全基因集富集分析,结果如图4(h~k)所示.PVP、PVP-AgNPs-150nm 和PVP-AgNPs-50nm 组的基因都显著富集在氨基酸代谢、核糖体、用于生产IgA的肠道免疫通路和细胞因子-细胞因子受体相互作用等通路,且富集通路数量相近.而AgNO3主要富集在氧化磷酸化、碳代谢、核糖体和氨基酸代谢等通路,且富集通路数量为20 条,显著多于其他3 组纳米银暴露组.
2.5 蛋白质互作和关键基因分析
通过STRING数据库和Cytoscape对差异基因进行蛋白质相互作用网络的构建,并利用Cytoscape 中Cytohubba 模块计算分析相互作用,从差异基因中筛选出具有代表性的关键基因(Hub 基因).考虑到PVP 和PVP-AgNPs-150nm 的差异基因较少,而其他两组的差异基因较多,为了得到相互作用程度最高的基因,因此本研究将PVP 组与PVP-AgNPs- 150nm 组的Hub 基因设置为12 个,其余组的Hub 基因设置为20 个,根据PPI网路分析确定的各暴露组Hub 基因如图5(a~d)所示.
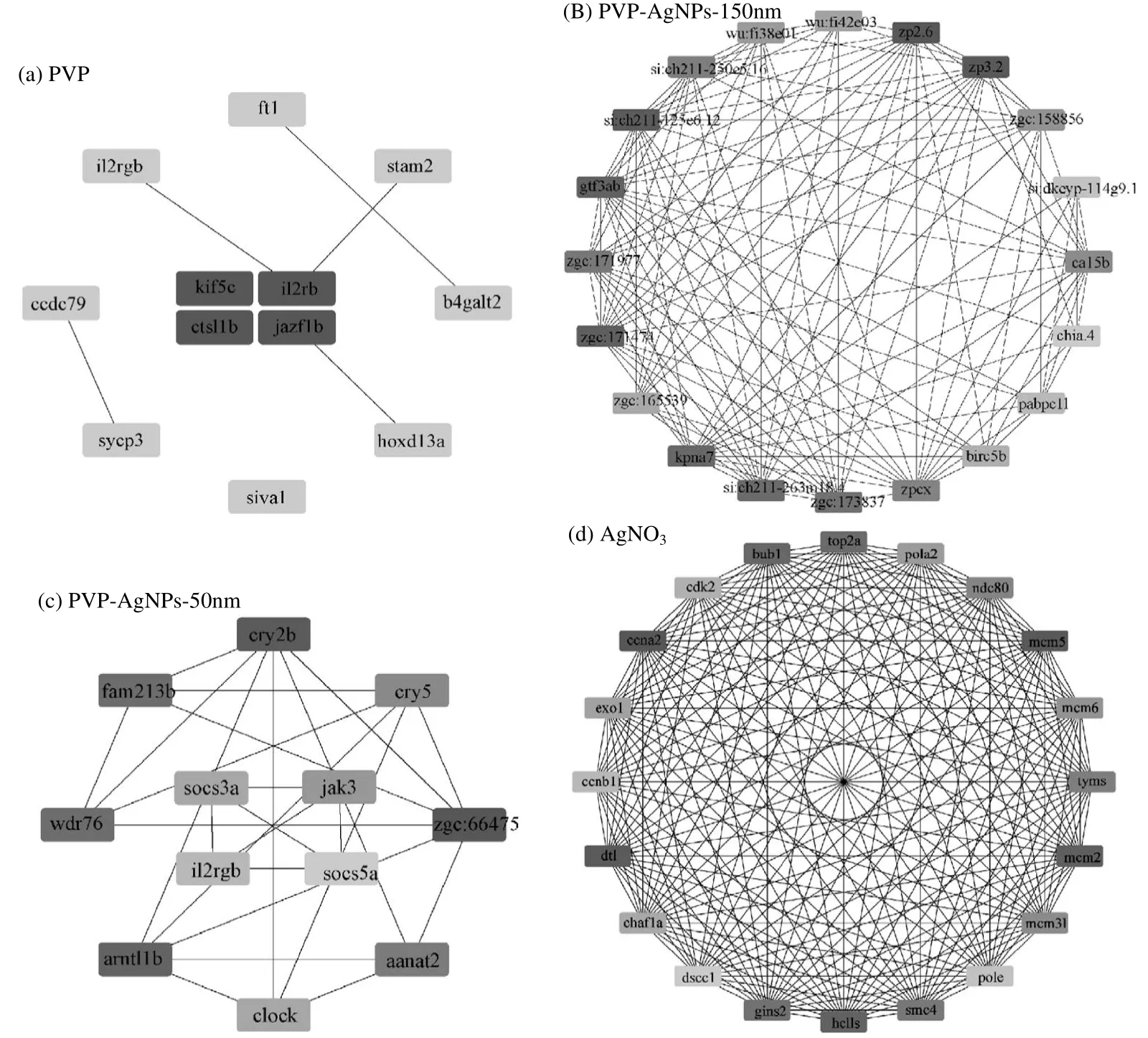
图5 各处理组Hub 基因网络图Fig.5 The network diagram of Hub genes in each treatment group
2.6 纳米银涂层对差异基因的影响
为了深入探讨涂层对纳米银毒性的潜在影响,本研究综合分析了GSE61186 数据集和GSE89653数据集.在这两组数据中,均涉及到粒径为20nm 的无涂层 AgNPs 和麦芽糖涂层 AgNPs(Maltose-AgNPs).为确保结果的准确性,选择将这两组数据整合后进行分析.首先,对合并后的数据进行了质量评估,如图6(a~d)所示.

图6 GEO 芯片数据分析(GSE89653)Fig.6 Analysis of GEO microarray data (GSE89653)
图6(a)和(c)分别为整合后数据的箱式图和PCA成分分析图,图6(b)和(d)分别为图6(a)和(c)校正后的质控图.箱式图反映出数据在各组间展现出一致的分布趋势,说明数据经过了恰当的标准化处理.PCA 主成分分析进一步证实了数据之间的区别.整体而言,这些分析确保了数据的高度一致性与可靠性.进一步,本文选定P<0.05 和|log2FC|>1 为筛选标准,对差异基因进行了交集分析,结果如图6(e)和(f).无涂层AgNPs组中,共有215 个显著差异基因,包括110 个上调及105 个下调基因;而Maltose-AgNPs 组则有302 个显著差异基因,其中148 个为上调基因,163 个为下调基因.通过两组的交集分析,本文识别到了3 个上调共有基因及5 个下调共有基因.
为了对上述识别出的差异基因的生物功能进行更为深入的探究,本文采用R 软件包进行了功能富集分析,并对这些基因及其涉及的生物过程进行了详尽的注释,如图6(g)和(h)所示.分析结果显示,无涂层AgNPs 组的差异基因主要集中于核糖核蛋白复合物和核糖体等关键生物过程中,而Maltose- AgNPs 组的差异基因则主要集中在内切蛋白酶活性、丝氨酸蛋白酶活性、昼夜节律以及精子与卵子的相互识别等生物过程中.进一步地,通过KEGG 通路富集分析,本文观察到无涂层AgNPs 组的差异基因在核糖体、过氧化物酶体、肌醇合成以及聚糖代谢等生物通路中有显著的聚集现象.而Maltose- AgNPs 组的差异基因则在驱动蛋白、细胞衰老、氨基酸与核苷酸糖代谢,以及类固醇生物合成等关键通路中呈现出显著富集(图6(i),(j)).值得注意的是,两组中的差异基因都在糖代谢通路中表现出了显著的富集,这暗示了两者在毒性作用机制上存在一定的相似性.
3 讨论
在PCA 主成分分析中观察到, PVP-AgNPs-50nm 组和AgNO3组与Control 组之间有明显的区分,而PVP 组和PVP-AgNPs-150nm 组与Control 组之间的区分度较小.聚类分析的结果也与上述结果相类似.聚类分析结果显示,Control 组与PVP、PVPAgNPs-150nm 的基因表达更为相似,而AgNO3组的基因表达与其他组有明显的差异.因此,结合各组差异表达基因的数量,推测不同纳米银和银离子暴露对斑马鱼胚胎基因的影响从大到小的顺序为:PVP-AgNPs-50nm>AgNO3>PVP-AgNPs-150nm.
研究认为,纳米银的致毒机制主要涉及到“特洛伊木马机制”,即纳米银被细胞摄取后,在细胞内释放高水平的有毒阳离子[18].这种“特洛伊木马”效应使得纳米银颗粒能够进入细胞和有机体,提高其渗透性和生物可利用性[19].然而,银离子在培养基中不易溶解且传输途径受限,从而导致细胞难以大量吸收银离子.因此,当将相同原子浓度的纳米银和银离子与细胞一起孵育时,纳米银处理下的细胞内银离子含量可能高于银离子处理的细胞.这种细胞内银离子浓度的差异可能是导致其毒性差异的原因.此外,某些研究中指出,纳米银的毒性可能是由于其“颗粒特异性”所致.例如,Beer 等[20]发现纳米银对A549 细胞展现了颗粒特异性效应,与纳米银处理相比,银离子处理的细胞在细胞防御基因的表达上受到了更大的干扰.然而,目前未有研究从基因水平上去探究纳米银和银离子毒性差异的主要原因.在本研究中,差异基因表达分析结果显示,PVPAgNPs-50nm 组的显著差异基因数量多于AgNO3组,并且交集基因的上、下调数量不一致.在蛋白质相互作用和关键基因分析中,PPI 网络的关键基因也不相同.功能富集分析显示,纳米银更多地富集在与免疫相关的通路上,而AgNO3主要影响细胞周期和代谢等方面.通过对比两种暴露条件下斑马鱼的差异基因表达,推断纳米银的毒性效应并非仅仅来源于其释放的银离子,更关键的是其独特的颗粒特异性,这在基因调控过程中发挥了决定性作用.一些研究表明,纳米银和银离子都能破坏脑部的突触结构,导致突触小泡向神经纤维网释放、突触结构退化,但与银离子相比,纳米银引起的海马区域突触结构退化更为严重[21].此外,在无细胞毒性的低浓度暴露实验中,纳米银还能通过诱导星形胶质细胞增加释放多种炎症因子,促进细胞产生炎症反应,而银离子则没有观察到这种现象.此外,Xiu 等人[22]的研究显示,纳米银展现出明显的“颗粒效应”.具体而言,随时间的延长,由纳米银导致的细胞内银浓度明显高于来自离子形态的银.这或许能为PVP-AgNPs-50nm 相对于AgNO3的毒性稍高提供一个解释.Autrup 等[23]进一步揭示,当使用相同的银原子浓度进行孵育时,纳米银诱导的A549细胞中的ROS水平远超过银离子,这为纳米银的“颗粒效应”提供了进一步的证据.因此,纳米银自身的性质在其毒性作用中扮演着重要的角色.
纳米银的表面修饰对其理化性质有着重要的影响,包括表面电荷、亲疏水性、极性等,从而影响其生物学效应.其中,PVP 是一种非离子型高分子化合物,可以有效抑制纳米银的团聚和银离子的释放.同样地,麦芽糖因其良好的生物相容性而常被用于纳米银的表面修饰,从而显著提高纳米银的分散性[24].在本研究中,对Maltose-AgNPs 与无涂层AgNPs 暴露下斑马鱼的转录组学数据进行了比较.在控制粒径和剂量一致的条件下,Maltose-AgNPs 组的差异表达基因数量显著多于无涂层AgNPs 组.在进一步的差异基因功能富集分析中,Maltose-AgNPs 组与无涂层AgNPs 组在生物进程和相关通路的影响呈现相似性.这一发现暗示,在相同粒径的情况下,麦芽糖涂层对细胞摄取纳米银的能力并未产生显著影响,从而导致生物效应的相似性.综合分析两组样本的差异基因表达特征,可以推断Maltose-AgNPs 对斑马鱼的毒性效应可能略高于无涂层AgNPs.尽管涂层本身并无生物毒性,但有研究认为纳米银被涂层后的细胞毒性会显著增强,并且对DNA的损伤能力更强.这主要归因于涂层限制了纳米银的团聚,使其具有更高的分散性.高度分散的纳米银相较于团聚的纳米银具有更大的相对比表面积,表现出更高的反应性和生物利用度,从而发挥更高的细胞毒性[25-26].这与本文中分散性较好的Maltose-AgNPs相比无涂层AgNPs 显示更高的毒性相吻合.
此外,纳米银的粒径也是影响其生物毒性的重要因素之一.较小粒径的纳米银具有更大的比表面积,更高的细胞渗透能力和银离子释放速率,从而增加了其对细胞的毒性和细胞损伤的可能性.一般认为,纳米银粒径越小,越容易通过生物屏障,并且对生物体的毒性影响也更大.斑马鱼对纳米银的摄取率受到纳米银的粒径影响,这是由于纳米银的粒径决定了其比表面积,而比表面积又能够影响纳米银进入生物体或细胞的效率,从而进一步影响对生物体的毒性作用[5].这一现象在PVP-AgNPs-150nm 和PVP-AgNPs-50nm 组的基因变化中也得到了证实.PVP-AgNPs-50nm 组的显著差异基因数量显著多于PVP-AgNPs-150nm 组,并且在功能富集分析中,PVP-AgNPs-50nm 组影响的GO 项目和KEGG通路也显著多于PVP-AgNPs-150nm组.此外,PPI网络分析也证实了这一点.因此,纳米银颗粒对斑马鱼胚胎的毒性效应具有粒径依赖性,粒径越小,毒性越大,同时也更容易引发氧化应激、炎症和DNA 损伤等反应.这主要是由于小粒径纳米银具有更高的细胞摄取效率,并且释放银离子的能力也比大粒径的纳米银更强[27].小粒径的纳米银进入细胞后,由于其较高的比表面积和生物活性,会产生更高程度的氧化应激、细胞免疫等生物效应[28].然而,本研究只是通过生物信息学手段分析纳米银的毒性作用及其机制,还需要通过进一步的实验验证推论.
4 结论
4.1 研究表明,纳米银的粒径越小,其毒性越大.具体来说,相较于 PVP-AgNPs-150nm 组, PVPAgNPs-50nm 组的显著差异基因数量更多,富集到更多的GO 项目和KEGG 通路.
4.2 纳米银组(150 和50nm)在斑马鱼中主要影响代谢和免疫相关的基因表达,暗示可能对鱼类的生长和发育造成损害.同时,全基因集富集分析的结果也显示,AgNO3和纳米银在斑马鱼体内引发的基因表达变化主要集中在代谢相关通路.这表明纳米银的毒性不仅仅与释放的银离子有关,而且与其颗粒特性密切相关.
4.3 相较于无涂层纳米银,麦芽糖涂层的纳米银在斑马鱼中导致更多差异基因的表达,暗示麦芽糖涂层可能增加纳米银的毒性.

