胃底腺黏膜型腺癌4例临床病理特征
孙晓宇,薛晓伟,周炜洵
2019版WHO消化系统肿瘤分类中纳入了泌酸腺腺瘤(oxyntic gland adenoma, OGA)和胃底腺型腺癌(gastric adenocarcinoma of fundic-gland type, GA-FG)两种病变,两者均属于低度异型的胃底腺起源肿瘤[1],病变局限于黏膜或黏膜下层,较少发生转移和深层次浸润,患者预后良好[2]。最初胃底腺来源的肿瘤描述包括主细胞增殖、胃底腺息肉亚型、胃固有腺超高分化腺癌等。后期日本学者提出泌酸腺肿瘤的另一个成员——胃底腺黏膜型腺癌(gastric adenocarcinoma of fundic-gland mucosa type, GA-FGM),并将胃型腺癌分为:(1)胃小凹上皮型;(2)胃底腺型;(3)胃固有黏膜型。同时将胃固有黏膜型进一步分为:(1)胃底腺黏膜型(胃底腺+小凹上皮型);(2)幽门腺黏膜型(幽门腺+小凹上皮型);(3)胃底腺-幽门腺黏膜混合型(胃底腺+幽门腺+小凹上皮型)。他们认为,与GA-FG相比,GA-FGM恶性度更高。2021年,Ueyama等[3]提出将胃底腺分化的肿瘤更加系统地分为3大类:OGA、GA-FG和GA-FGM。GA-FGM主要呈泌酸腺分化,但同时具有胃小凹上皮分化,这与OGA、GA-FG的肿瘤成分仅有泌酸腺分化不同,且预后较差;由于GA-FGM中两种分化的细胞异型性较低,活检诊断非常困难,需予以重视。目前国内尚无GA-FGM的相关报道,本文回顾性分析4例GA-FGM的临床病理学特征和免疫表型,旨在提高对该肿瘤的认识水平。
1 材料与方法
1.1 临床资料收集2021~2023年中国医学科学院北京协和医院病理科存档的4例GA-FGM标本。通过电子病例系统收集患者的就诊信息(包括年龄、性别)和临床信息(症状、病变部位、内镜表现)。所有病例的HE和免疫组化切片,均由两名擅长诊断消化道早期癌的高年资病理医师复核诊断。
1.2 方法活检标本常规包埋制片,内镜黏膜下剥离术(ESD)标本按照胃ESD标本规范化处理流程制作常规HE切片。标本均经10%中性福尔马林固定,2 mm间隔全部取材,组织条按顺序石蜡包埋,常规切片,HE染色,镜下观察。免疫组化染色采用EnVision法,使用的一抗是黏蛋白(MUC5AC、MUC6)。试剂盒购自Dako公司。
2 结果
2.1 GA-FGM临床特征(表1)4例患者中,男性3例,女性1例,男女比为3 ∶1,发病年龄范围40~58岁。4例合计获得5处病变组织(其中例1有2处病变),4处病变获得ESD标本,1处病变(例3)仅获得活检标本。病变所在部位:胃体3处,胃底2处。肿瘤最大径范围7~24 mm,中位最大径13 mm。按巴黎分型,Type 0~Ⅱa型占4处(80.0%),Type 0~Ⅱa+Ⅱc型仅1处(20.0%)(图1、2)。

图1 例1:胃底白光可见Type 0~Ⅱa+Ⅱc病变,黏膜发红,边界清晰

表1 4例胃底腺黏膜型腺癌的临床特征
2.2 GA-FGM的病理特征和免疫表型(表2)GA-FGM的组织学特点是向胃底腺黏膜全部成分分化,主要包括肿瘤性小凹上皮、胃底腺成分(主细胞和壁细胞),还可有少量的颈黏液细胞和幽门腺成分。小凹上皮成分由高柱状上皮构成,呈乳头状或管状排列,胞质多保留黏液帽,但有时缺乏成熟分层或黏液帽消失,免疫组化标记MUC5AC阳性。胃底腺分化成分主要向主细胞和壁细胞分化,免疫组化标记MUC6阳性。主细胞分化成分胞质略嗜碱性或淡染,细胞核圆形或椭圆形,位于细胞偏基底,略微增大,常见明显核仁。壁细胞胞质红染颗粒状,细胞体积较大,细胞核位于细胞中央。无论是何种成分,均可见细胞拥挤,细胞核增大、上浮,部分区域复层排列(图3、4)。肿瘤腺管有明确的结构异型性,常见腺管扩张、大小不等,复杂的分支和乳头,腺管扭曲融合。局灶也可见小团细胞浸润间质中无腺管结构。肿瘤的不同成分可分层排列,保留原始黏膜的相对结构:小凹成分在表面或中心,胃底腺成分在深层或周围包绕(图5)。各种成分也可混杂分布,不同成分相互穿插排列,可经免疫组化染色明确区分。MUC5AC和MUC6分别在不同成分中表达,呈现互补显示的图像(图6A、B)。肿瘤常见浸润黏膜下层,例1的2个病灶和例2均浸润黏膜下层,最深达黏膜下2 150 μm;例4肿瘤限于黏膜内。
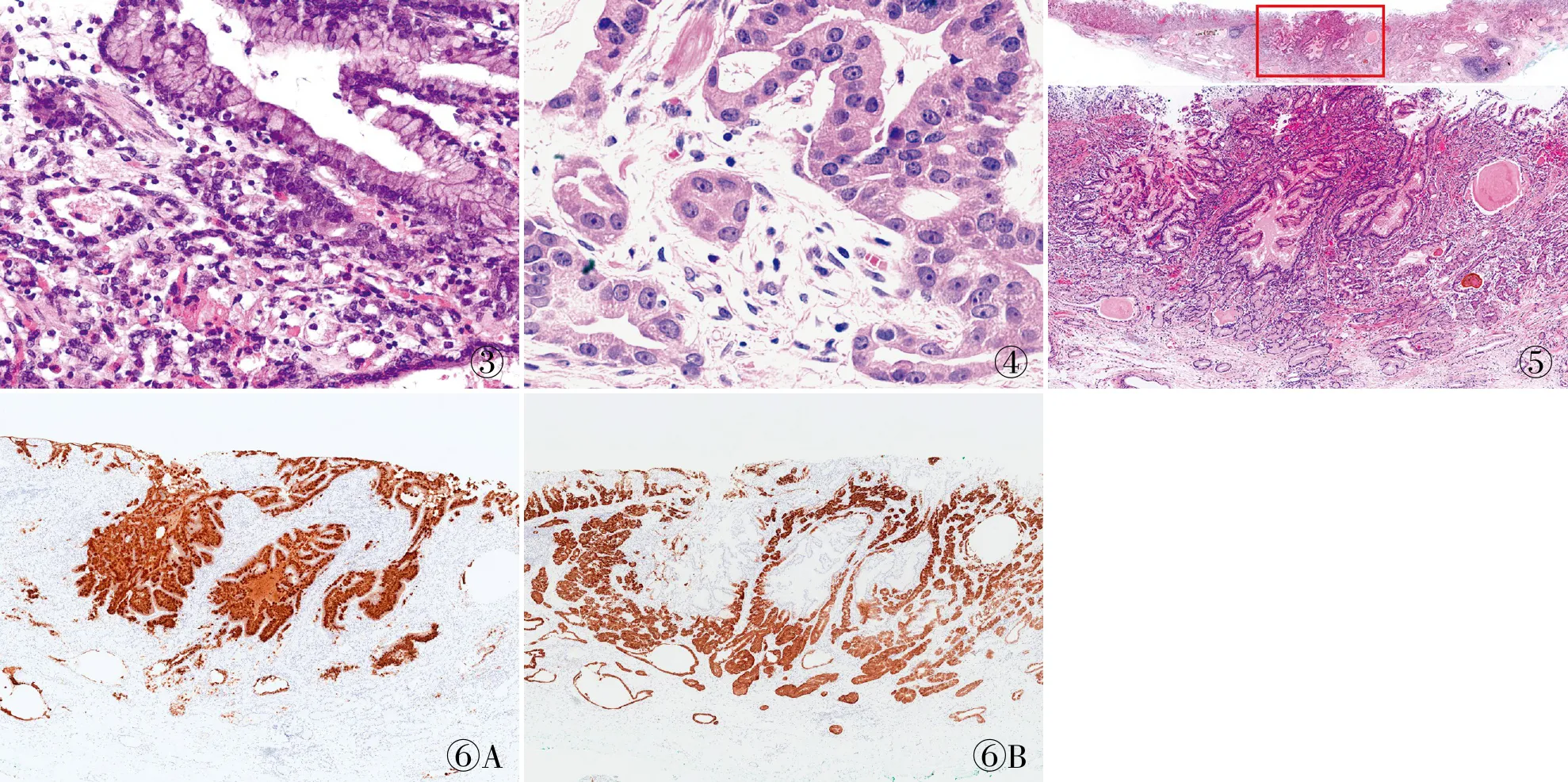
图3 HE染色示右侧上方区域肿瘤由高柱状上皮构成呈管状排列,胞质保留黏液帽,部分缺乏成熟分层,为胃小凹上皮分化;左侧下方区域胞质红染,结构扭曲,为胃底腺分化

表2 胃底腺黏膜型腺癌组织学亚型和浸润深度
3 讨论
回顾本组4例GA-FGM的临床病理特征,发现GA-FGM好发于中年人,男性多发,病变部位主要位于胃上部,肿瘤最大径范围7~24 mm,巴黎分型以Type 0~Ⅱa为主,这与以往文献报道相符合[4-5]。形态学上GA-FGM具有胃小凹上皮和泌酸腺双重分化的特点,细胞异型性较小,但与其他胃底腺分化的肿瘤相比,其预后较差。因此在诊断时需仔细鉴别,但活检病理明确诊断非常困难,需加强认识。
Ueyama等[3]在以往研究的基础上对GA-FGM进行了详细报道,并根据胃小凹上皮和胃底腺成分在黏膜结构中的分布不同,将GA-FGM进一步分为3种亚型:1型(分层暴露型):肿瘤虽累及黏膜全层,但保留正常的胃底腺黏膜分层结构关系,肿瘤的小凹分化区域(MUC5AC阳性)在表层,胃底腺分化区域在深层,肿瘤表面暴露于胃腔腔面;2型(混杂暴露型):肿瘤累及黏膜全层,小凹分化区域和胃底腺分化区域混杂交错分布,肿瘤表面暴露于胃腔腔面;3型(混杂非暴露型):肿瘤仅累及黏膜深层,表面被覆正常的小凹上皮,肿瘤内小凹分化区域和胃底腺分化区域混杂交错分布。胃镜下对肿瘤性病变进行观察,重点关注微血管和微腺管的紊乱,表面暴露的肿瘤微腺管更为混乱,在胃镜下较易识别。但非暴露的肿瘤表面被覆正常小凹上皮,可能掩盖结构紊乱的肿瘤,给胃镜下识别带来困难。组织学上,1型和3型大致保留了两种分化成分的结构关系,肿瘤细胞又与正常黏膜形态相似,诊断较为困难。因此分型有助于了解病变的不同表现,提升对病变的理解和认识。文献报道2型预后相对更差[3],我们认为GA-FGM发病率低,明确诊断较难,日常诊断中尚不需要进一步区分GA-FGM亚型。本组病例中,肿瘤组织形态特点与文献报道符合,其中1型(分层暴露型)1例,2型(混杂暴露型)1例,3型(混杂非暴露型)2例。例2为3型,因其表面被覆正常的小凹上皮,胃镜检查诊断为黏膜下隆起病变。病理诊断也首先考虑GA-FG,经与内镜医师讨论并行免疫组化染色才明确诊断,这提示本组病变较难识别和诊断。
OGA和GA-FG纳入WHO后,我们对胃底腺分化肿瘤的认识越来越多,并且了解OGA和GA-FG的预后较好,因而认为胃底腺分化的肿瘤预后均较好。但文献报道GA-FGM易多发,有多个病例浸润黏膜下层和发生脉管累及,有些GA-FGM可与其它非特殊的腺癌混合存在,因此GA-FGM有更差的预后[3]。本组例1为同时多发性(2个部位)GA-FGM,2个病灶均侵犯黏膜下层,浸润深度分别为黏膜下2 150 μm和520 μm,例2侵及黏膜下层740 μm。这些均提示GA-FGM发展较快,与GA-FG差异较大,需要我们仔细鉴别并准确诊断。
GA-FGM虽属于胃底腺分化肿瘤,但与胃底腺息肉、泌酸腺腺瘤、胃底腺型腺癌形态学有差异,必须仔细鉴别。胃底腺息肉是一种良性胃上皮病变,典型表现为胃底腺扩张、胃小凹发育不全和顶部增生。仅少数病例胃底腺息肉的小凹上皮呈低级别异型增生,但胃底腺成分腺体无扭曲,细胞正常无异形。OGA是单纯向胃底腺分化的肿瘤,由混合的肿瘤性主细胞和壁细胞组成。肿瘤由黏膜深层发生,表面被覆正常的胃小凹上皮,为非肿瘤成分。肿瘤腺管结构拥挤、紊乱、扭曲,部分可融合、共壁,细胞核圆形或椭圆形,较为一致温和,但与背景正常胃底腺相比,细胞核仍有增大,核/质比略增高,表现为低异型性的肿瘤性病变。免疫组化标记MUC6和pepsinogen-1阳性。GA-FG和OGA的组织学有相同的改变,两者主要区别在于有无黏膜下浸润[1,4]。GA-FGM则向胃底腺全部黏膜成分分化,包括肿瘤性的小凹上皮、泌酸腺成分即主细胞、壁细胞,还可以混有颈黏液细胞和部分幽门腺分化的成分[3]。各种成分均可出现结构异型性,即腺管大小不等、扭曲、分支;也会出现细胞异型性,即细胞核增大、核仁清晰,细胞核向腔缘分布、复层分布等。虽然GA-FGM分化较好,胞质保留胃黏膜各成分的特点,多数细胞核染色仍匀细,但与正常胃底腺差异较大,也比GA-FG的细胞异型性大。3型GA-FGM因表面保留了正常小凹上皮的被覆,与GA-FG更难鉴别。重要点是证实肿瘤内小凹分化和泌酸腺分化的成分混杂存在,可通过免疫组化染色发现MUC5AC和MUC6阳性成分分别混杂存在来协助诊断GA-FGM。本组例2属于3型GA-FGM,活检时发现扭曲的泌酸腺,诊断首先考虑为GA-FG,但ESD标本镜下观察发现多数成分为泌酸腺,且有较大的异型性,浸润深度较深,与GA-FG相比有所不同,再次结合临床内镜和免疫组化结果最终证实为GA-FGM。因此,诊断为胃底腺分化的肿瘤时,MUC5AC、MUC6的免疫组织染色观察和判读十分重要。
此外GA-FGM还需与胃错构瘤性内翻息肉(gastric hamartomatous inverted polyps, GHIP)和深在性囊性胃炎(gastritis cystica profunda, GCP)相鉴别。GHIP是由腺体增生和囊性扩张、成纤维细胞、平滑肌、神经组织等内翻进入黏膜下层而形成的病变,细胞均无异型[6-7]。GCP是指胃黏膜内的腺体向黏膜肌层以下生长并扩张成囊的一种病变,可能与外科手术史相关,细胞均无异型,部分文献报道GCP可伴有不同程度的异型增生或恶变[8-9]。GHIP和GCP均出现腺管在黏膜下层分布,腺管常有扩张、大小不等的不规则表现,部分上皮可出现反应性增生改变,易误认为肿瘤,并与GA-FGM混淆。GHIP强调整体的结构性,虽然也有文献报道其可分为不同的形态学类型[10],但均需要伴随的黏膜肌组织与上皮组成较清楚的轮廓,有清晰的分层结构。GCP的黏膜下陷无固定的形态,但腺管以扩张为主,常伴有固有膜结构,易有炎症等继发性改变。最为重要的是,两者均为非肿瘤性病变,细胞形态正常无异型性。本组例1肿瘤成分有分层分布的结构特点,表面为肿瘤性小凹上皮向下内陷,肿瘤性泌酸腺在深层并包绕内陷的小凹上皮成分,有明确的异型性,最初作者认为例1病变是肿瘤与GCP并发。经进一步形态学和免疫组化观察,结合文献复习,最终诊断为GA-FGM。在诊断例1的过程中作者详细了解了1型GA-FGM的分层结构特点,以及认识到仔细观察确定异型性诊断的重要性。
GA-FGM的肿瘤细胞分化明确,细胞异型性小,活检标本诊断尤其困难。本组4例中,例1和例2的活检标本均能观察到泌酸腺分化的肿瘤成分有结构异型性,腺管扭曲明显,因此活检时诊断为胃底腺分化的肿瘤,考虑泌酸腺腺瘤或胃底腺型腺癌,临床行ESD后全面观察获得明确诊断。例3虽仅获得活检标本,因临床取材标本较大,取到了4 mm直径的黏膜,因而能观察到黏膜深部扭曲的异形小凹和胃底腺肿瘤成分。例4细胞异型性相对较大,为2型GA-FGM,活检病理诊断为普通的高级别异型增生,未识别出特殊的胃底腺分化。因此我们认为,活检标本组织具有局限性,并不一定能观察到GA-FGM中的各种成分,因此直接诊断GA-FGM非常困难,诊断时应结合结构异型性和细胞异型性,作出肿瘤性病变的诊断。当临床行ESD后全面观察完整的标本才能获得准确的诊断。
Ueyama等[3]报道的34例胃底腺分化肿瘤行NGS检测发现,胃底腺分化的肿瘤,包括泌酸腺腺瘤、胃底腺型腺癌和胃底腺黏膜型腺癌,GNAS突变的频率较高,提示GNAS可能是这一组肿瘤的特征性基因改变。此外既往文献报道GA-FGM可与GA-FG同时发生[11],其中1例为多发性GA-FGM合并多发性GA-FG[12]。因此提出GA-FG可能获得更多分子异常后转化为GA-FGM的假说,但由于报道例数较少,尚无证据证实,相应的分子发病机制还待揭露,本组病例未行分子检测,为本研究的局限。
GA-FGM预后较差,常见多发且多浸润到黏膜下层,提示生物学行为具有较高的侵袭性。Ueyama等[3]通过对比分析其他类型的胃型腺癌,统计分析GA-FGM的肿瘤大小、黏膜下浸润深度、脉管侵犯等指标后发现其预后较差。长期随访后,无论患者是行ESD术还是胃癌根治切除术,其后续追加治疗的比例明显高于其他类型的胃型腺癌。
综上,GA-FGM较少见,属于胃型腺癌中预后较差的一组病变,具有独特的形态学特征,与胃底腺型腺癌形态学有重叠又有不同,需要我们加强认识,免疫组化染色在鉴别诊断中具有重要作用。

