幽门腺腺瘤16例临床病理学观察
周 宾,岳 冰,徐 瑞,陈光勇
幽门腺腺瘤(pyloric gland adenoma, PGA)是一种向胃幽门腺分化的少见肿瘤,占胃息肉的2.7%[1]。1976年Elster首次报道PGA,当时PGA被误认为是黏液腺体的腺瘤样增生[2]。PGA主要发生于胃、胆囊、十二指肠,也可发生于食管、直肠、胰腺、子宫颈[3]。本研究回顾性分析16例PGA的临床病理特征,探讨其组织学发生,以提高临床与病理医师对该肿瘤的认识水平,避免漏诊、误诊。
1 材料与方法
1.1 临床资料收集2018年11月~2022年11月北京友谊医院病理科诊断的16例PGA,所有病例均经两位高年资医师参考WHO(2019)消化系统肿瘤分类进行诊断,并收集其临床资料。
1.2 方法标本均经10%中性福尔马林固定,常规石蜡包埋,切片,HE染色,镜下观察。免疫组化染色采用EnVision两步法。所用一抗包括:PepsinogenⅠ(7G3,1 ∶4 000)、p53(DO-7,即用型)、MUC6(MRQ-20,1 ∶200)、MUC5AC(45M1,1 ∶200)、CgA(MX018,1 ∶100)、Syn(MX038,1 ∶100)、CD56(MX039,1 ∶200)、Ki67(MXROO2,1 ∶200)、CDX-2(EPR2764Y,1 ∶100)、MUC2(M53,1 ∶100)、β-catenin(MX043,1 ∶200)和CD10(MX002,1 ∶200),除PepsinogenⅠ购自Abcam公司,p53购自Ventana公司,其余抗体均购自福州迈新公司。所有抗体均设阳性对照,阳性信号按说明书标准判读。
2 结果
2.1 临床特征16例PGA中,男性7例,女性9例。平均年龄58岁(范围26~81岁)。平均最大径1.3 cm(范围0.2~4.0 cm)(表1)。肿瘤位于胃6例(胃体3例,胃底3例),十二指肠球部3例,胆囊7例。6例胃PGA中背景黏膜为自身免疫性萎缩性胃炎2例、幽门螺杆菌感染性胃炎1例、胆汁反流性胃炎1例、非萎缩性胃炎2例。3例十二指肠PGA中1例周围黏膜可见胃黏膜易位。6例胃PGA中1例为家族性腺瘤性息肉病。9例胃和十二指肠PGA均表现为内镜下亚蒂息肉(图1)。6例胃PGA均通过活检确诊,随后2例行内镜黏膜下剥离术(ESD),2例行内镜黏膜切除术(EMR),1例行近端胃切除,1例失访。3例十二指肠PGA均未取活检,1例行ESD切除,2例行EMR切除。7例胆囊PGA中5例因胆囊息肉切除,2例肿瘤较小(0.2 cm),在因胆囊结石切除胆囊时偶然被发现。
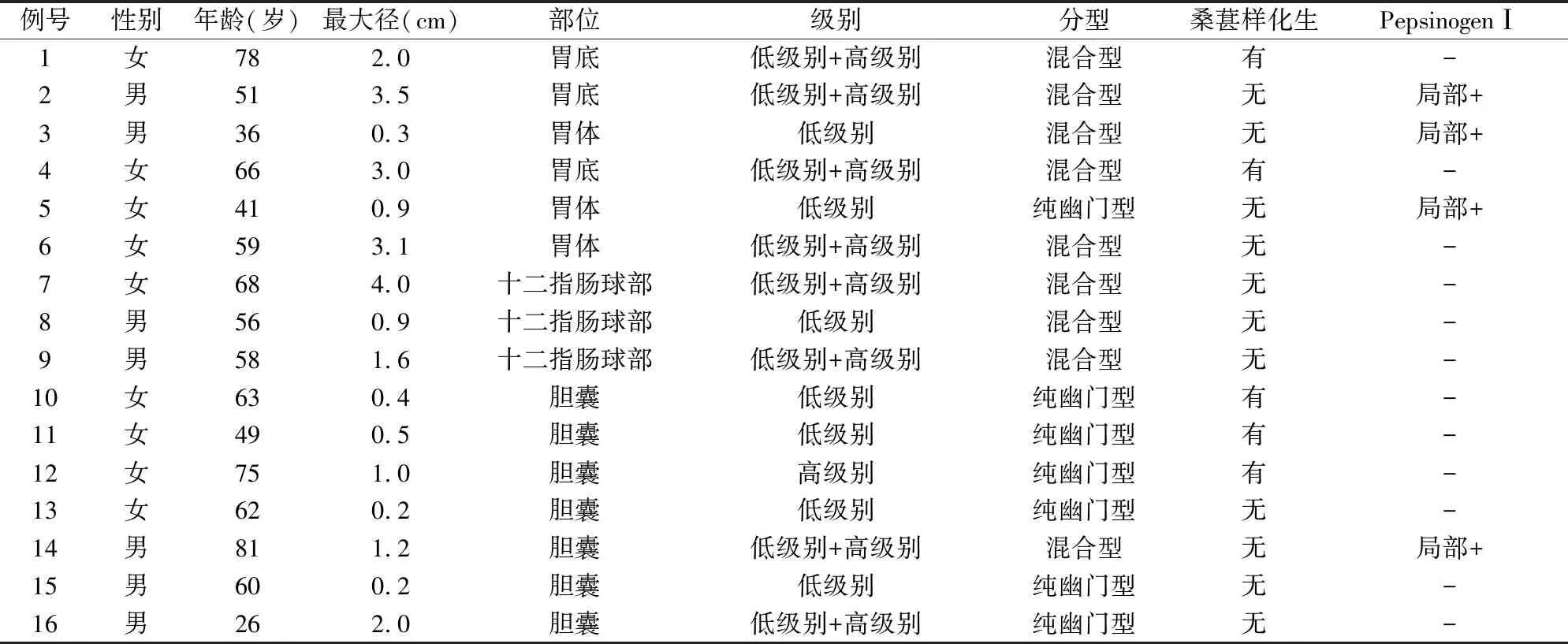
表1 16例幽门腺腺瘤的临床病理特征

图1 内镜下幽门腺腺瘤表现为亚蒂息肉
2.2 病理特征根据WHO(2019)消化系统肿瘤分类,低级别PGA 7例,镜下见幽门腺样腺管紧密排列,内衬单层立方至低柱状细胞,核圆形、卵圆形,位于基底侧,核仁不明显,胞质透明或嗜酸性,呈毛玻璃样外观,细胞缺乏黏液帽(图2);高级别PGA 1例,镜下见腺体结构紊乱、细胞核拥挤、核极向消失(图3);其余8例混合低级别和高级别成分。5例中发现鳞状桑葚样化生[胃(2/6)、十二指肠(0/3)、胆囊(3/7)]。大部分PGA(14/16)表面被覆MUC6阴性柱状上皮。其余可见的伴随现象是腺管扩张、血管扩张、充血、出血、间质水肿及炎细胞浸润。
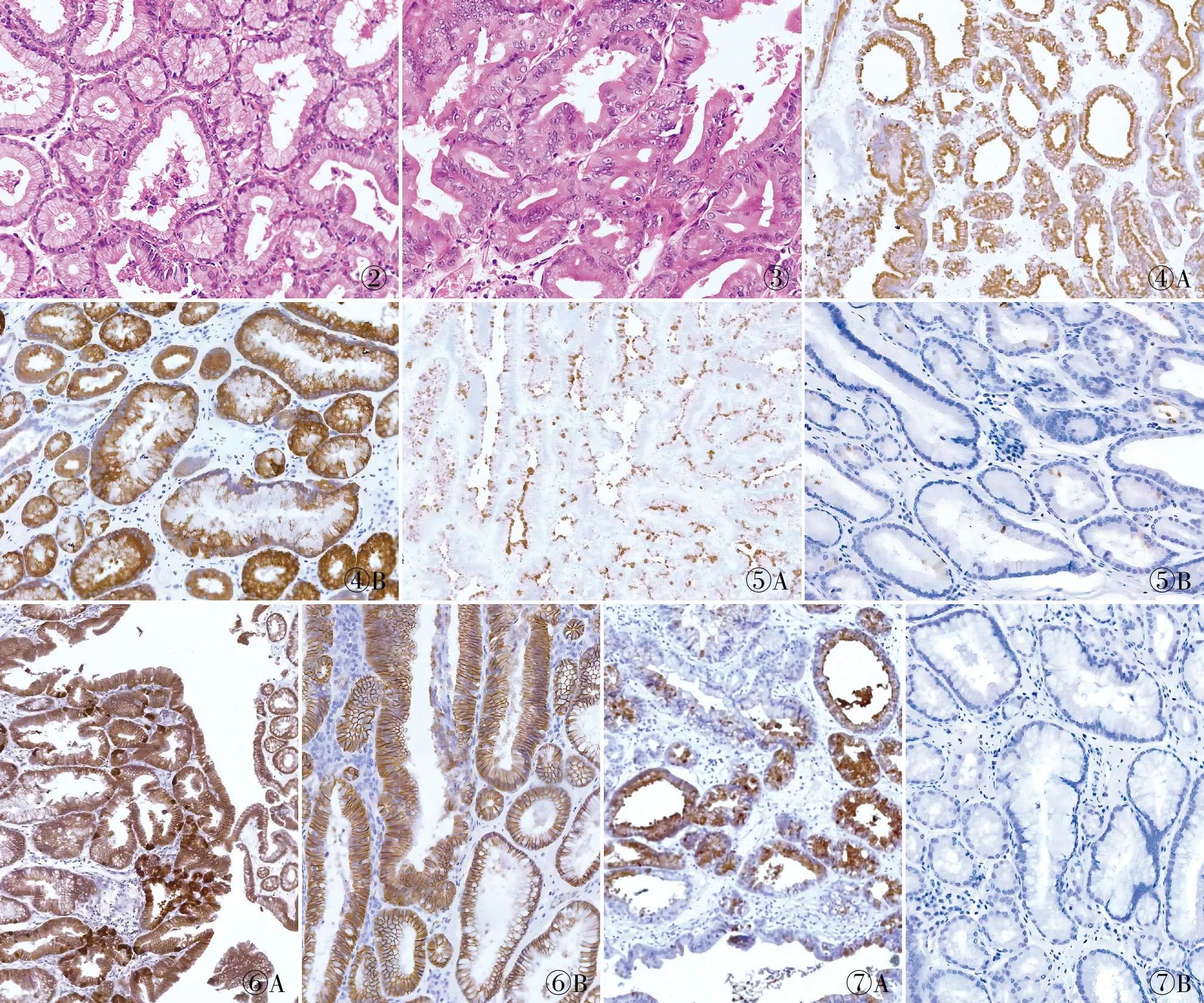
图2 低级别:幽门腺样腺管紧密排列,腺管内衬单层立方至低柱状细胞,核圆形、卵圆形,位于基底侧,核仁不明显,胞质透明或嗜酸性,呈毛玻璃样外观
2.3 免疫表型16例MUC6均阳性(图4A、B)。其中8例MUC5AC阳性(图5A),8例MUC5AC阴性(图5B)。β-catenin(图6A)在鳞状桑葚样小体内呈核阳性,在部分高级别区域呈核阳性,其他区域呈膜阳性(图6B)。4例PepsinogenⅠ呈灶状阳性(图7A),12例阴性(图7B)。16例CgA和Syn均呈点状阳性。CDX-2在鳞状桑葚样小体内呈局部阳性。CD10在鳞状桑葚样小体内呈阳性。p53和Ki67主要表达于PGA表面,野生型p53表达增高区主要在MUC5AC阳性区域,同样区域Ki67增殖指数也增高。所有病例中MUC2均阴性。
2.4 随访16例PGA中3例失访,其余13例随访时间13~51个月,均未发现复发及转移。
3 讨论
PGA是一种向胃幽门腺分化的少见肿瘤,占胃息肉的2.7%[1]。1976年Elster首次报道PGA,但当时其被误认为黏液腺体的腺瘤样增生[2]。
3.1 临床特征PGA好发于老年女性,发病年龄20~91岁[4]。文献报道的男女比例略有不同[1,4]。PGA主要发生于胃、胆囊、十二指肠,也可发生于Barrett食管、直肠、主胰管、胆囊管、子宫颈[3]。PGA的背景黏膜可以是自身免疫性胃炎、幽门螺杆菌感染性胃炎、化学性胃炎、肠化和正常黏膜[1, 4-5],但文献报道略有不同。PGA可以伴发家族性腺瘤性息肉病、林奇综合征或青少年息肉综合征[6-8],本组也有1例患者伴发家族性腺瘤性息肉病。PGA还可伴发小凹上皮型腺瘤(现称为幽门腺黏膜型腺瘤)[9]。在白光模型胃镜下,大多数PGA病变表现为息肉样、结节状突起或黏膜不均匀、扁平隆起,溃疡或黏膜下的隆起[4, 10-11],本组9例胃和十二指肠病变均表现为亚蒂息肉。6例胃PGA均通过活检证实后行ESD、EMR或部分胃切除术,说明PGA可以通过内镜早期发现、早期诊断和早期治疗。
3.2 病理特征幽门腺来源的病变包括幽门腺化生、幽门腺增生、低级别PGA、高级别PGA、幽门腺腺癌。对于PGA许多学者提出了多种不同的组织学分级和分类系统。WHO(2019)消化系统肿瘤分级系统中定义低级别PGA表现为幽门腺样腺管紧密排列,内衬单层立方至低柱状细胞,核圆形、卵圆形,位于基底侧,核仁不明显,胞质透明或嗜酸性,呈毛玻璃样外观,细胞缺乏黏液帽。高级别PGA表现为结构紊乱、核拥挤、核极向消失。Chen等[5]采用的是3级分类,无异型增生、低级别异型增生、高级别异型增生。Vieth等[1]和Choi等[4]采用的是腺瘤和高分化腺癌2级分类。各个国家采用的诊断标准和命名有差异因而造成所用分类标准不同。本研究采用的是WHO(2019)消化系统肿瘤分类,16例PGA中,低级别7例(直径0.2~0.9 cm),低级别合并高级别8例(直径1.2~4.0 cm),高级别1例(直径1.0 cm),肿瘤异型增生级别与大小关系密切。鳞状桑葚样化生在PGA中可见,Wani等[12]报道胆囊PGA的发病率为23%,而胃PGA的鳞状桑葚样化生尚未见报道,本组6例胃PGA中2例可见该特征。根据免疫表型特点,可将PGA分为3种类型[4,13]:(1)混合型:表达MUC6和MUC5AC,但MUC6的表达更广泛,深部腺体MUC6的阳性率一般为20%~90%;(2)纯幽门型:MUC6广泛表达,MUC5AC仅在表面小凹上皮中表达;(3)小凹优势型:MUC5AC呈弥漫表达,MUC6在深部腺体的阳性率<10%。根据此标准,本组16例中混合型9例(胃5例,十二指肠3例,胆囊1例),纯幽门型7例(胃1例,胆囊6例),未发现小凹优势型,小凹优势型仅表达MUC5AC,与小凹型腺瘤的免疫表型一致,但两者形态学差异明显,可以通过形态学鉴别。PepsinogenⅠ由胃底的主细胞和颈黏液细胞分泌,本组有4例呈局灶表达,其中3例为胃PGA,1例为胆囊PGA,PGA表型类似于黏液颈细胞而非幽门腺[14]。有文献报道PGA还可伴发小凹上皮型腺瘤[9],故作者推测部分PGA来源于颈黏液细胞。十二指肠未发现PepsinogenⅠ表达,十二指肠腺与幽门腺的形态和免疫组化类似,Kushima等[15]报道紧邻PGA可见胃黏膜异位,胃黏膜异位在十二指肠、胆囊、直肠中均有报道[16-18],这些部位也均有PGA的报道,本组3例十二指肠PGA中1例周围亦见胃黏膜异位,十二指肠PGA的发生可能为胃黏膜易位,也有可能是来源于幽门腺或幽门腺化生,这有待进一步研究。鳞状桑葚样化生特征性地表现出β-catenin核过表达,Ki67低增殖指数(<1%),CD10呈细胞质过表达[19],这与本组研究结果一致。Ki67阳性的增殖细胞主要位于肿瘤表面[10],p53在腺瘤表面有表达[20],本组病例与之一致。Kushima等[20]认为p53表达与小凹上皮型腺瘤有关。Vieth等[21]的研究结果显示PGA伴或不伴腺癌中p53和Ki67的表达存在明显差异。本组发现PGA中神经内分泌标志CgA、Syn呈点状表达,但有何意义还有待进一步研究。通过分析本组病例,发现胆囊、胃和十二指肠PGA在鳞状桑葚样化生、免疫表型及胃底腺分化方面均不能彻底分开,这与He等[22]得出的结论不同,发生在胆囊和胃的幽门腺腺瘤是否为不同的肿瘤仍需积累更多病例进一步研究。作者认为PGA的组织学发生可能为幽门腺、幽门腺化生、胃黏膜异位或颈黏液上皮来源。
3.3 分子学特征目前有关PGA的分子研究较少,Setia等[23]通过二代测序技术发现低级别异形增生的PGA均存在APC、KRAS和GNAS基因突变,高级别异形增生/腺癌中存在APC、CTNNB1、KRAS、GNAS、TP53、CDKN2A、PIK3CA和EPHA5多个基因突变,但APC、KRAS和GNAS基因突变比例降低,且高级别中肿瘤突变负荷更高。He等[22]认为胆囊PGA中KRAS和GNAS基因突变与胃和十二指肠PGA相比较少,可能因胆囊PGA不易早期发现,高级别占比较高所致,两者是否为不同的肿瘤还需要积累更多病例研究来证实。Kushima等[14]采用PGA的比较基因组杂交分析显示了胃腺癌中常见的染色体异常,如17pq和20q的获得,以及4q、5q和6q的缺失。与低级别异形增生的PGA相比,高级别异形增生/腺癌有更多的染色体获得和缺失[23]。
3.4 预后早在1986年和1987年,Franz Borchard先后两次在德国举办的国际病理学会幻灯片研讨会上展示1例PGA进展为中分化腺癌病例[24]。在有随访的报道中,Chen等[5]随访的7例中3例发展为浸润性癌,3例发展为浸润性癌后分别随访2个月、10个月和10年,均存活。Choi等[4]随访的44例患者,平均随访时间为28个月(范围1~84个月),4例(9.1%)(包括2例高级别和2例低级别)在3年内局部复发,其余40例在平均随访28个月内无复发。Schaefer等[25]也报道了1例PGA恶性转化病例。Khor等[26]的报道中还出现了淋巴结转移。Miller等[27]报道的病例中17.9%伴有黏膜内癌或浸润性腺癌,且3例发生淋巴结转移。以上证据均说明PGA有转变为癌的可能,临床和病理医师需提高警惕,诊断后应行手术切除。本组有13例获得随访信息,且均为完整切除病变,随访后均未见复发及转移,作者也认为局部内窥镜切除是一种合适的治疗策略。
综上所述,虽然PGA的发生率不低,但报道的病例数并不多,因其有转变为癌的潜能,需要病理医师和内镜医师提高认识水平,临床医师要注意其诊断和治疗。PGA具有特殊的组织学和免疫表型特征,内镜下也有特殊的表现,加强病理医师与内镜医师的沟通,使早期发现、早期诊断、早期治疗成为可能。

