右心功能监测对新生儿急性呼吸窘迫综合征预后的评估价值
刘东惠,陈庭萱,王 威
(商丘市第一人民医院新生儿重症监护室,河南 商丘 476000)
新生儿急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是由于肺泡毛细血管弥漫性炎症损伤,引起肺表面活性物质(pulmonary surfactant,PS)匮乏,导致新生儿通换气功能障碍,具有病程进展快、预后差等特点[1-2]。ARDS主要见于早产儿、体质量偏低新生儿及超期新生儿,个别新生儿病死率可达20%[3]。新生儿ARDS与成人不同,病因相对明确,临床治疗主要为呼吸支持、PS替代治疗、体外膜肺氧合治疗、营养支持及液体摄入等对症及综合治疗,但仍有部分患儿出现病情恶化,甚至出现气胸、持续性肺动脉高压及肺出血等并发症,最终导致死亡[4]。新生儿本身免疫功能低下、肺生物学和成熟度较差,低氧、炎症因子刺激、肺泡渗透性增加等因素可导致肺血管小动脉痉挛或肺静脉压力增高,当肺动脉压力持续高于体循环压力时,动脉导管重新开放出现右向左的分流,导致肺血管阻力增加,从而增加右心室后负荷,加重右心功能损害[5-6]。因此,早期动态监测新生儿右心功能指标的变化并积极处理,对改善新生儿ARDS预后有一定意义。本研究选取112例新生儿ARDS患者,探讨右心功能指标监测对其预后的预测价值,报道如下。
1 对象与方法
1.1 对象 选取2021年1月—2022年7月商丘市第一人民医院诊治的112例ARDS新生儿作为研究对象,其中男52例,女60例;胎龄28~40(36.42±4.23)周;发病时间4~48 (8.48±1.26)h;原发重度肺炎28例,新生儿失血性休克16例,脓毒症34例,误吸26例,心源性休克8例。纳入标准:①符合新生儿ARDS相关诊断标准[7]。②肺部影像学检查显示双侧弥漫性、不规则的透亮度下降、渗出或白肺。③临床资料完整。排除标准:①先天性心脏病患者。②合并肺部其他疾病者。③先天性畸形引起的呼吸困难。本研究开展前经院医学伦理委员会批准,对新生儿进行的检查及治疗措施均经过监护人知情同意。
1.2 方法
1.2.1 治疗方法 所有患儿入院后均常规给予抗感染、抗休克、补液、营养支持等基础治疗,并采用德国Stephanie小儿常频呼吸机(德国Stephanie公司)给予机械通气,采用Hitachi Arietta 70多普勒超声诊断仪(日本日立公司)及探头,频率2~9 MHz,连接超声心电图,于患儿主动脉根部短轴切面,将探头置于三尖瓣口及肺动脉口,获取血流频谱,由软件自动计算新生儿机械通气上机后心脏指数(cardiac index,CI)、右心室做功指数(right ventricular work index,RV-Tei)、右心室射血分数(right ventricular ejection fraction,RVEF),连续测量3个心动周期取平均值。
1.2.2 检测方法 收集患儿静脉血10 mL,6 000 r·min-1离心10 min后取上清液检测血常规及各项血清生化指标。采用免疫荧光分析法检测降钙素原(procalcitionin,PCT)含量;采用酶联免疫吸附法检测血清C-反应蛋白(C-reactive protein,CRP)、血浆N末端脑钠肽前体(N-terminal brain natriuretic peptide precursor,NT-proBNP);检测所用试剂盒均购自上海酶联生物有限公司,操作时严格按照说明书进行检测,新生儿PCT正常区间为0~0.5 ng·L-1,CRP为0.1~8 mg·L-1,NT-proBNP为<450 g·L-1。
1.2.3 资料收集 收集患儿基线资料[性别(男、女)、出生胎龄、出生体质量、分娩方式(顺产、剖宫产)、机械通气时间、住院时间、一氧化氮(NO)治疗(有、无)、氧合指数(oxygenation index,OI)、PS使用次数]、血清生化指标(白蛋白、球蛋白、白细胞、PCT、NT-proBNP、CRP)、心功能指标(CI、RV-Tei、RVEF)。
1.2.4 分组标准 根据28 d预后情况,将112例ARDS新生儿分为预后良好组(n=81)和预后不良组(n=31)。预后良好组:治疗后生命体征正常、呼吸平稳,病情好转出院或治疗后患儿呼吸症状好转,达到临床稳定标准。预后不良组:患儿生命体征消失,宣告临床死亡;病情改善后又恶化;未脱离呼吸机或药物治疗。

2 结果
2.1 新生儿ARDS预后情况 根据28 d预后情况,有81例患儿好转或治愈,31例患儿病死,病死率为27.68%。
2.2 影响新生儿ARDS预后的单因素分析 预后良好组与预后不良组在性别、分娩方式、NO治疗比例及出生体质量、白细胞计数、CI比较,差异无统计学意义(P>0.05);预后良好组胎龄、住院时间、OI及球蛋白、白蛋白、PCT含量高于预后不良组,PS使用次数≥3的比例及机械通气时间、CRP、RV-Tei、NT-proBNP、RVEF低于预后不良组,差异有统计学意义(P<0.05)。见表1。

表1 影响新生儿ARDS预后的单因素分析
2.3 新生儿ARDS预后的logistic多因素回归分析 将结果2.2中有统计学差异的变量记为自变量X,预后不良为因变量Y(发生=1,未发生=0),进行logistic回归分析赋值,见表2。logistic多因素回归分析结果显示,RV-Tei、NT-proBNP是影响新生儿ARDS预后的独立危险因素。见表3。

表2 logistic多因素回归分析赋值

表3 新生儿ARDS预后不良相关影响因素的logistic多因素回归分析
2.4 右心功能指标联合监测对新生儿ARDS预后的ROC曲线 RV-Tei联合NT-proBNP预测新生儿ARDS预后的敏感度、准确度、曲线下面积(AUC)分别为92.60%、91.54%、0.822。见图1。
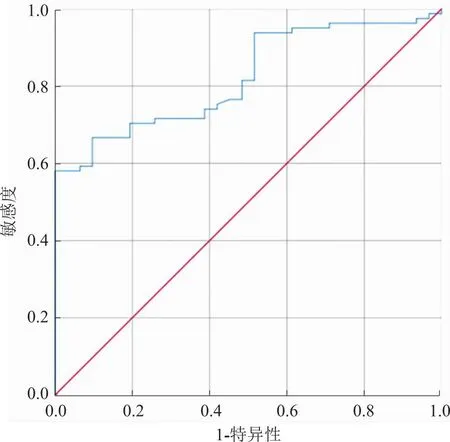
图1 右心功能指标监测评估新生儿ARDS预后的ROC曲线
3 讨论
新生儿ARDS是由多种原因导致的肺部急性炎症反应,临床特点不同于成人,以顽固性低氧血症、呼吸窘迫为主要临床特征[8]。随着医疗技术水平的发展,国际上ARDS病死率已由最初的75%下降至40%,我国儿童ARDS的病死率约为20%,成人病死率为40%[9]。尽管国际上制定了独立的新生儿ARDS诊断标准,但新生儿ARDS仍然缺乏特异性的治疗方式,目前ARDS的临床治疗主要包括药物治疗、机械通气、辅助治疗3方面,机械通气是主要治疗手段,超90%的患者可通过机械通气提高动脉血氧饱和度,改善通气和灌注,复张塌陷的肺泡,从而有效改善呼吸状况。最初学者对ARDS患者治疗的关注点多集中于肺,但随着对ARDS病理生理机制了解的不断增多,临床学者已逐渐认识到ARDS患者右心功能较左心功能受累更严重,若未能及时纠正,将会进入到自主恶化的恶性循环中,引起严重血流动力学波动及后果,因此右心功能的管理在血流动力学治疗中的重要地位被认知而更加受到重视[10]。
本研究结果显示,ARDS新生儿病死率为27.68%(31/112),高于徐慧等[9]研究结果的23.41%(48/205),原因可能与纳入及排除标准不一,基线资料存在差异相关。本研究通过比较预后良好组与预后不良组的临床资料发现,预后良好组患儿胎龄、住院时间、OI及球蛋白、白蛋白、PCT含量高于预后不良组,PS使用次数≥3的患儿比例及机械通气时间、CRP、RV-Tei、NT-proBNP、RVEF低于预后不良组,提示上述因素可能与ARDS新生儿预后相关,通过进一步logistic多因素回归分析发现,RV-Tei、NT-proBNP是影响ARDS新生儿预后的危险因素,提示并印证RV-Tei、NT-proBNP水平与ARDS新生儿预后有关。RV-Tei是右心室做功指数,是一种无创测量心肌整体收缩和舒张功能的方法。本研究观察到预后不良组患儿RV-Tei高于预后良好组的原因可能是ARDS新生儿存在肺泡上皮受损、炎症反应、肺通透性增加,引起肺血管阻力增大,肺动脉压升高,肺动脉压升高直接影响到右心室的后负荷,导致右心室收缩期末及舒张期末容积增加,右心做功增加,RV-Tei升高[11]。脑钠肽(BNP)主要是由心室肌细胞合成及分泌的多肽类心脏神经激素,其释放与心室容积扩张、心室压力负荷等有关。NT-proBNP由134个氨基酸的前激素合成,比BNP具有更长的半衰期和更高的血浆浓度。有研究[12]证明,NT-proBNP作为BNP激素原分裂后的N末端片段,无内分泌活性,在血浆中具有较好的稳定性,便于临床检测。王裕林等[13]研究发现,ARDS患儿肺泡NT-proBNP水平上升,且与ARDS病情严重程度相关。因此,NT-proBNP作为早期心功能障碍的诊断标志物,更能客观、敏感评价患儿的心功能状态及判断预后。本研究结果显示,预后不良组NT-proBNP水平高于预后良好组,且该指标是影响新生儿ARDS预后的危险因素,分析可能由于ARDS病情发展,机体严重缺氧致使肺血管收缩、心肌细胞缺氧,增加代偿输出量,甚至机械通气过程中胸膜腔内压升高,均可引起心肌损伤,从而增加NT-proBNP表达。由于右室复杂的几何形态及负荷依赖性,目前超声心动图评价右室功能的多种技术指标各有优势和限制,应综合两种或以上指标对右室功能进行综合评价。RV-Tei联合NT-proBNP评估新生儿ARDS预后的敏感度、准确度、AUC分别为92.60%、91.54%、0.822,提示二者联合具有较高的预测效能。
综上所述,右心功能指标与新生儿ARDS预后相关,RV-Tei联合NT-proBNP评估新生儿ARDS预后价值较高。但本研究为单中心,结果难免有偏倚,后期仍需多中心多样本研究进行验证。

