赤水河河源段鱼类资源现状调查
陈文善,陈泊霖,卢 群,刘建虎*,何 滔,杨 峰
(1.长江上游珍稀特有鱼类国家级自然保护区云南管护局,云南 昭通 657000;2.西南大学水产学院,重庆 400715;3.枞阳南方材料有限公司,安徽 铜陵 246700)

生物通过产生粪便、尿液、唾液、皮肤细胞的方式将DNA排出或脱落到周围环境中,这类大量存在于环境中的DNA片段总和被称为环境DNA (Environmental DNA,eDNA)[6]。eDNA技术是指直接从水体、土壤、沉积物等环境样本中提取DNA片段,然后通过DNA测序和qPCR等分子生物学检测技术来定性或定量目标生物,从而确定目标生物在该环境中的分布及功能特征的研究方法。该方法应用在鱼类资源调查上具有一定的创新性,调查过程不依赖动物样本,不受禁捕的限制,可以大量采样[7];eDNA技术进行资源调查相对传统调查成本较低,对分类学鉴定专业知识要求较低,生态环境侵入性低、影响较小[8];eDNA技术能检测出传统鱼类多样性调查手段难以捕获的物种,但因假阳性和DNA污染等情况的存在,其适合作为鱼类资源调查的一个重要补充手段[9]。利用eDNA进行资源调查不能完全替代传统的鱼类调查方法,但该技术具有对生物体以及生态环境无害、操作简单、高灵敏度以及高检测率等诸多优势,随着数据库的持续完善,其适用性会越来越强[10]。
本次调查采用传统捕捞方式和采集水样检测环境DNA相结合的技术方法,于2020—2021年对赤水河河源段的鱼类资源现状进行调查,分析其种类组成和数量结构、优势种、生物多样性及鱼类栖息分布状况,既弥补了传统捕捞方法调查不够全面的不足,也在一定程度解决了eENA技术出现假阳性的问题,旨在为保护区鱼类生物多样性保护提供管理依据。
1 材料与方法
1.1 样品采集
在赤水河河源段的保护区水域布设18个调查站位(表1),其中赤水河干流10个、支流8个,利用笼壶、抛撒掩网和定置三重刺网3种类型渔具对该区域的鱼类进行捕捞。同时在赤水河河源段主要支流及干流设置的18个采样点中选取7个点(鱼洞、罗甸、小三峡、天生桥、石坎、河口、苦竹塘)采集eDNA水样。

表1 赤水河河源段鱼类资源调查站位分布表Tab.1 Characteristics of biodiversity monitoring stations
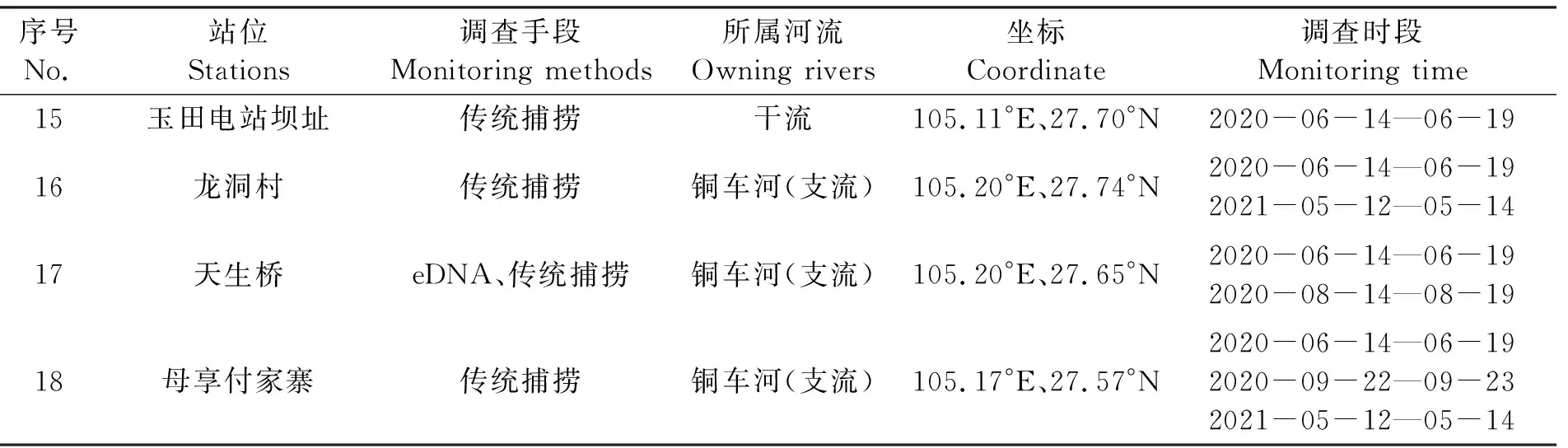
续表1
1.2 样品鉴定与检测
对采集到的渔获物进行现场鉴定,并测量体长和体质量,对于疑难物种采用甲醛固定后带回鉴定。标本鉴定和分类主要依据《四川鱼类志》[11]、《长江鱼类》[12]、《贵州鱼类志》[13]、《中国内陆鱼类物种与分布》[14]。
eDNA水样按照Omega Soil DNA Kit试剂盒提取DNA,同时利用液氮进行保存,再带回实验室,并利用MiFish引物扩增,通过2%琼脂糖凝胶电泳回收目的条带检测浓度。如满足条件则运用高通量测序 (High-throughput sequencing,HTS)技术,同时对环境样本中存在的多个物种进行识别[15]。满足检测条件后随机检测样本OTU数并绘制OTU稀疏曲线,若有OTU无法比对至种的水平,则向上一级如属、科等进行统计[16]。
1.3 数据分析
使用相对重要性指数(IRI)[17]计算鱼类群落优势种的成分:
IRI=(N+W)×F
(1)
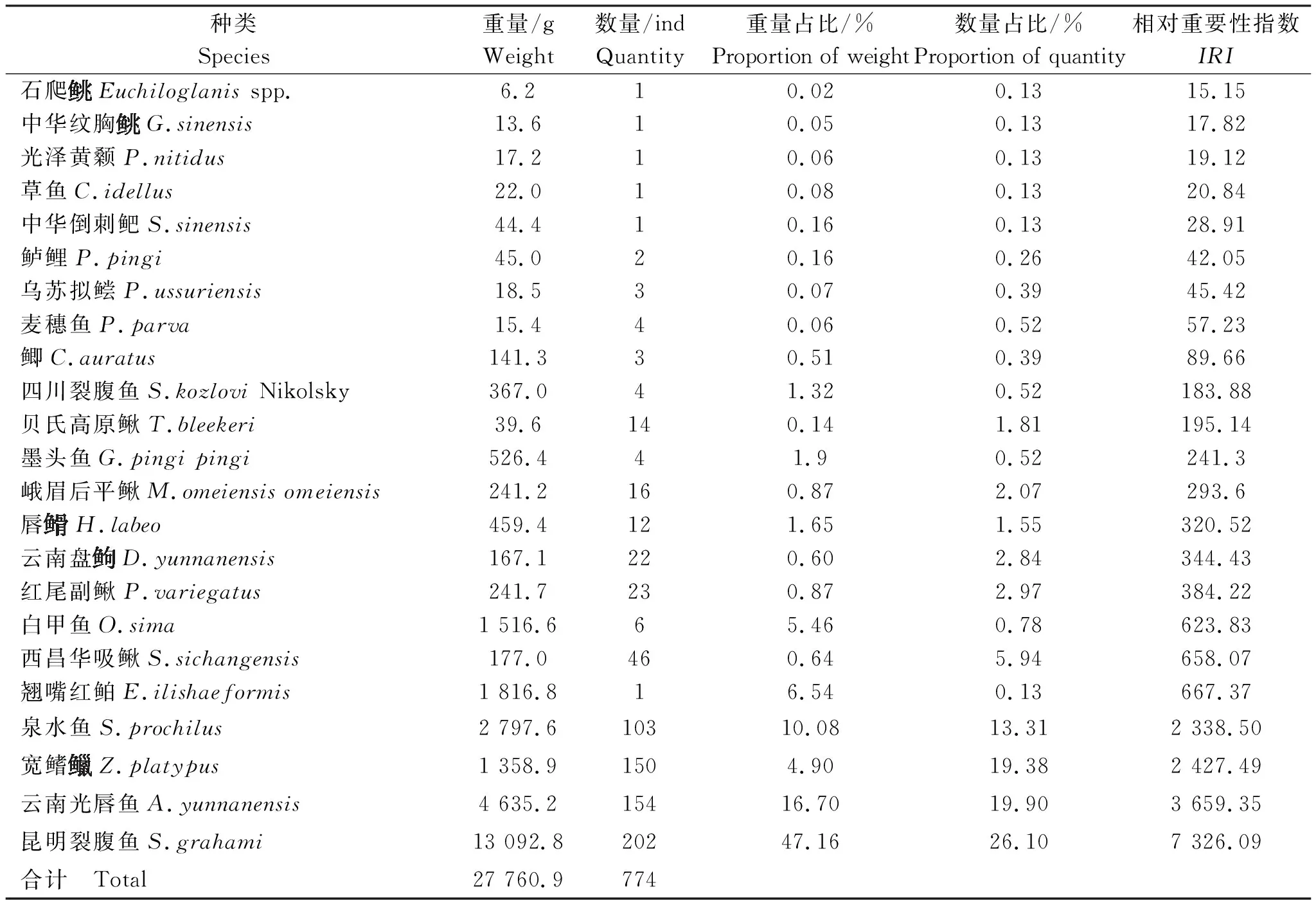
式(1)中:N为某种鱼类尾数占总尾数的百分比;W为某种鱼类重量占总重量的百分比;F为某种鱼类在调查站位出现的次数占在总站位中的百分比。将IRI>1 000的种类作为优势种;100 采用Shannon-Wiener多样性指数(H′)[18]、Margalef种类丰富度指数(D)[19]和Pielou均匀度指数(J)[20]研究调查海域鱼类群落的生物多样性,计算公式如下: (2) D=(S-1)∕lnW (3) J=H′/lnS (4) 式(2)~(4)中:S为调查所获鱼类种数;W为该调查总渔获重量;Pi为第i种重量占总渔获重量的比例。 表2 调查期渔获物名录Tab.2 List of catch during monitoring period 续表2 表3 渔获物结构Tab.3 Structure of the catch eDNA技术分析检测出鱼类4目8科38属40种,其中石坎共有鱼类3目8科17属17种;河口共有4目8科20属21种;苦竹塘共有3目7科17属17种;小三峡共有4目8科25属28种;天生桥共有3目7科18属18种;罗甸共有3目7科30属34种;鱼洞共有4目8科19属19种(表4)。 表4 基于eDNA检测各站位的鱼类序列比对结果Tab.4 Sequence alignment results of fish based on eDNA detection at each station 本次调查以2020年为主,因甲方资金问题,而顺延至来年,但2021年采样期间为雨季,因此渔获物少,导致无法作多样性分析。在2020年度调查期间采集鱼类19种,占本次调查总数的82.6%,其中铜车河采集鱼类13种,占总数的56.5%;倒流河采集鱼类5种,占总数的21.7%;石坎河采集鱼类3种,占总数的13.0%。各河段鱼类组成存在差异,干流>铜车河>倒流河>石坎河,干流鱼类物种更加丰富。 调查期间干流各个站点平均鱼类捕获重量为2 636 g,个体全长分布在2.1~37.0 cm之间,大个体占比较高;铜车河站点平均鱼类渔获重量为748 g,个体全长分布在2.8~22.5 cm之间;倒流河站点平均鱼类渔获重量为242 g,个体全长分布在4.6~13.5 cm之间;石坎河上游各个站点平均鱼类渔获重量为58.5 g,个体全长分布在4.0~15.0 cm之间;支流受流量、饵料生物及生态环境因素影响,其鱼类个体整体偏小。干、支流在鱼类资源量方面存在差异。 Shannon-Wiener多样性指数基于物种数量反映群落种类多样性,群落中生物种类增多代表了群落的复杂程度增高,即H′值愈大,群落所含的信息量愈大[18]。2020—2021年度调查河段渔获物Shannon-Wiener多样性指数为2.99,表明该河段总体鱼类资源相对丰富,群落结构相对稳定。Margalef丰富度指数指一个群落或环境中物种数目的多寡,亦表示生物群聚(或样品)中种类丰富度程度的指数[19-21]。调查河段总渔获物Margalef丰富度指数(D)为3.31,表明调查区域鱼类资源种类数相对丰富,生物多样性结构相对完好,鱼类组成及种群结构稳定。Pielou均匀度指数(J)是一个用于反映物种个体数目在群落中分配的均匀程的指数[19-21],调查河段总渔获物均匀度指数为0.66,种群结构分布较均匀,群落结构稳定(表5)。 表5 渔获物生物多样性指数Tab.5 Biodiversity indexes of catches 基于eDNA检测各站位的鱼类群落多样性指数分析结果如表6所示,从中可知,鱼洞、罗甸和小三峡的鱼类多样性更加丰富,鱼洞位于调查区干流上游,罗甸位于调查区干流中游,小三峡位于调查区干流下游,其他采样点则是分布于主要支流。调查区域干流的鱼类资源比支流区域更丰富,鱼类多样性也更高。 表6 基于eDNA检测各站位的鱼类群落多样性指数Tab.6 Fish community diversity indexes based on eDNA detection at each station 本次eDNA调查,共检测出4目8科28属40种。考虑到网具、捕鱼技术、鱼类生活习性和鱼类数量等因素,利用eDNA检测的种类数较传统捕捞方式更加全面。郭宁宁等[24]利用eDNA技术于2021年9月对赤水河流域开展了鱼类多样性、分布及其特征调查,设置了52个采样点,其采样点设置比本研究eDNA技术调查采样点(7个)多45个,共调查到6目18科62属77种鱼类,比本次河源段调查(40种)多出37种。经分析,存在差异可能是郭宁宁等[24]调查的范围更大,调查频次更加密集,且调查区域不同导致的。本次调查区域部分支流存在水量较少等情况,几条支流存在只有雨季才有的现象,这部分支流的鱼类多样性不高,鱼类资源不够丰富,导致调查出的鱼类种类数量较少。本研究eDNA分析结果显示,罗甸和小三峡的鱼类种类最多,分别为34种和28种,其中罗甸采样点处于妥泥河河口处,小三峡处于干流下流区域。干流区域的鱼类种类更加丰富,与渔获物种类分析结果一致。 在2020—2021年调查过程中,小三峡、鱼洞调查点基因含量水平较高,物种相对丰富,而且小三峡段还检测到部分洄游性鱼类基因片段,证明赤水河下游鱼类在繁殖季节可上溯至此,下一步应有针对性地加强重点物种调查,加强保护措施。在上游鱼洞调查水域检测到有铜鱼基因片段信息,可能是放流品种在此区域活动停留导致的。在检测过程中检测到四大家鱼、鲤、鲫和鲟鱼,可能是养殖或者食用品种基因片段混杂导致的。考虑到采样点的分布集中在干、支流区域,因此分别对干、支流的资源量进行统计,发现干、支流在鱼类资源量方面存在显著差异,干流的鱼类种类数目比支流更加丰富,同时在干、支流的同种类鱼类中,干流的鱼体显著大于支流,推测是受流量、饵料生物、生态环境因素和保护力度的影响。在后期鱼类多样性保护上,应加强干流保护区核心区的保护,逐步加强支流资源量恢复措施,提升整体资源水平。2 结果与分析
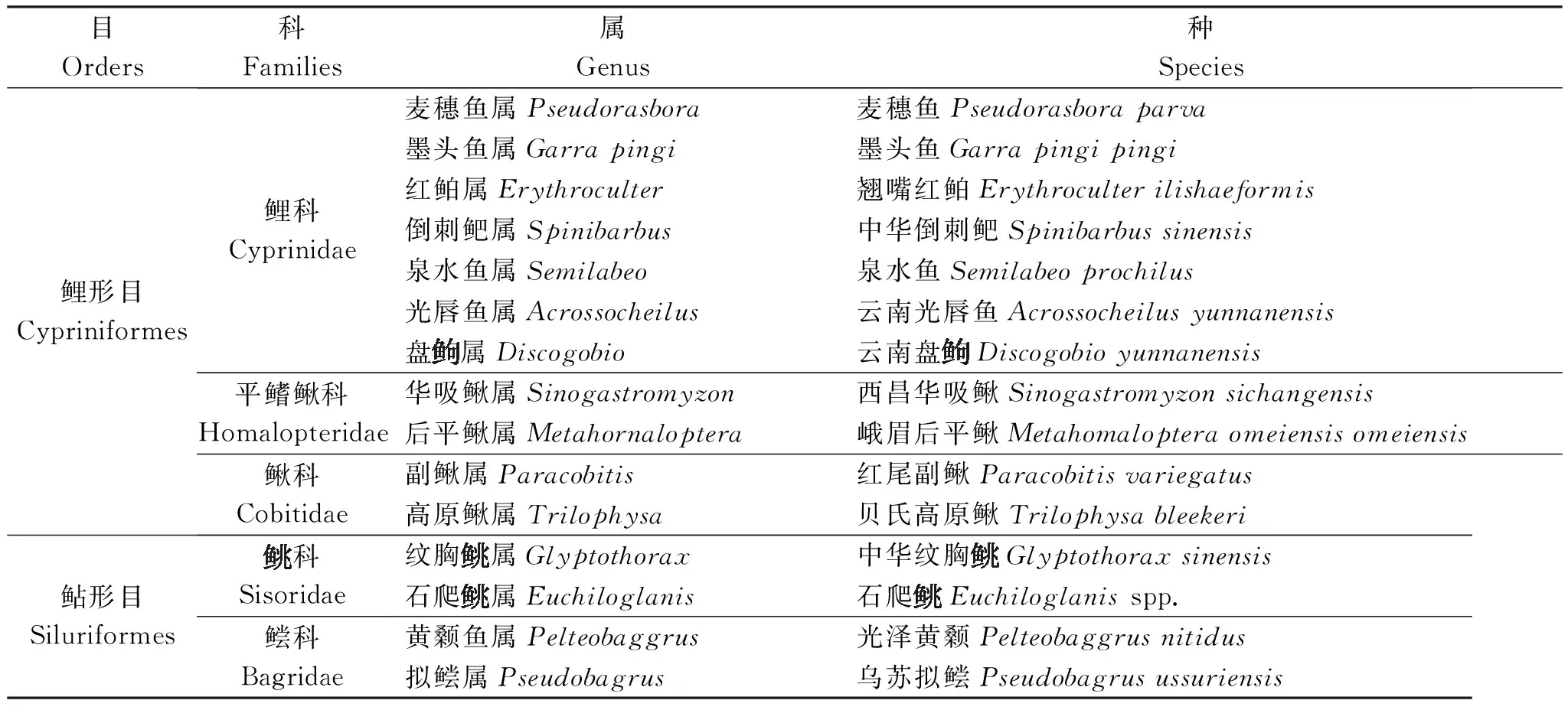
2.1 种类组成





2.2 鱼类资源分布特征
2.3 鱼类多样性分析


3 讨论


