lncRNA HIF1A-AS1对长春新碱耐药视网膜母细胞瘤细胞化疗敏感性的影响
何道侗,高 玉
0 引言
视网膜母细胞瘤(retinoblastoma,RB)是一种主要发生于儿童的视网膜恶性肿瘤,占所有儿科恶性肿瘤的4%,严重影响儿童的视力和生命健康[1]。RB的临床治疗主要包括化疗、放疗、手术等局部治疗,其中化疗为最常见的治疗方法,化疗可以避免患者眼球摘除,提高患者的生存率和生活质量。长春新碱(vincristine,VCR)是临床常用于RB治疗的一线化疗药物,具有良好的疗效。但是,长期应用会产生耐药性及多药耐药反应,极大减弱化疗效果甚至造成化疗失败[2]。因此,减轻RB的VCR耐药性对提升化疗效果具有重大价值。长链非编码RNA(long non-coding RNA,lncRNA)在RB的发生发展中起着重要的调控作用。报道显示,ZF-PM2反义RNA 1(ZFPM2-AS1)、肺腺癌转移相关转录因子1(metastasis-associated lung adenocarcinoma transcrip,MALAT1)等多种lncRNAs与RB的进展有关[3-4]。lncRNA HIF1A-AS1位于人类第14号染色体缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)的反义链上,Hong等[5]研究显示,抑制lncRNA HIF1A-AS1表达可通过降低HIF-1α/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)介导的自噬,促进肝癌细胞凋亡。HIF-1α是细胞低氧应激的主要调节因子,可参与肿瘤血管生成,能量代谢,促进肿瘤恶性进展及抗放化疗等[6]。已有研究报道显示[7],HIF-1α在RB组织中表达水平升高,HIF-1α信号通路可介导低氧诱导的RB细胞侵袭,上调HIF-1α表达可增加RB细胞对VCR的耐药性。但lncRNA HIF1A-AS1是否通过调控HIF-1α表达参与RB对VCR的耐药性在国内尚未见报道。本研究探索lncRNA HIF1A-AS1对VCR耐药的人RB细胞化疗敏感性的影响及可能机制。
1 材料和方法
1.1材料人视网膜母细胞瘤细胞SO-RB50购于中国科学院细胞库;VCR(B20157)购自上海源叶生物科技有限公司;抑制lncRNA HIF1A-AS1表达质粒(si-lncRNA HIF1A-AS1,序列5’-GUCAAUUGGUUGAUCACCCG-3’)及对照si-NC(序列:5’-UUCUCCGAACGUCACGUTT-3’)、HIF-1α过表达质粒(HIF-1α,序列:5’-ATCTCATCCAAGAAGCCCT-3’)、对照pcDNA质粒(序列:5’-AAGTAATCAC TCGGTTAGAA-3’ )以及lncRNA HIF1A-AS1、HIF-1α、内参GAPDH引物购自广州锐博生物科技有限公司;Trizol试剂(15596018)购自Invitrogen;SYBR Green Master(4913914001)购自Roche;LipofectamineTM2000 Transfection Reagent(11668030)购自Thermo Scientific;高效RIPA裂解液(R0010)、CCK-8(cell counting kit-8)试剂盒(CA1210)购自索莱宝生物科技有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒(40302ES20)购自上海翌圣生物科技有限公司;兔抗人HIF-1α(AF7087)、多药耐药相关蛋白(multidrug resistance associate protein,MRP)(AF7503)、P-糖蛋白(P-glycoprotein,P-gp)(AF2245)、β-肌动蛋白(β-actin)(AF5003)抗体以及辣根过氧化物酶标记山羊抗兔IgG二抗(A0208)购自上海碧云天生物科技有限公司。
1.2方法
1.2.1RBVCR耐药细胞株SO-RB50/VCR的建立SO-RB50细胞在含有10% FBS的RPMI 1640培养基中培养,加入起始浓度为75 ng/mL VCR连续培养2 wk,采用浓度递增法[8]建立SO-RB50/VCR,直至SO-RB50细胞可在600 ng/mL的VCR中稳定生长。
1.2.2细胞转染将对数期的SO-RB50/VCR细胞接种于6孔板中,当细胞达到70%融合时,对细胞进行转染,根据转染质粒,将细胞分为对照组(正常培养的SO-RB50/VCR细胞,不进行转染)、si-NC组(将si-NC转染至SO-RB50/VCR细胞)、si-HIF1A-AS1组(将si-HIF1A-AS1转染至SO-RB50/VCR细胞)、si-HIF1A-AS1+pcDNA组(将si-HIF1A-AS1和pcDNA共转染至SO-RB50/VCR细胞)、si-HIF1A-AS1+HIF-1α组(将si-HIF1A-AS1和HIF-1α过表达质粒共转染至SO-RB50/VCR细胞),转染48 h后,使用荧光素同工异构体(FITC)进行标记,并与转染物结合后通过流式细胞仪检测转染效率。流式细胞术检测显示转染效率达60%进行后续实验。
1.2.3CCK-8法检测细胞增殖和对VCR的半抑制浓度取对数生长期的各组SO-RB50/VCR细胞,按照每孔5×104个细胞接种至96孔板中培养48h,然后每孔加入10 μL的CCK-8溶液,孵育2 h后,测定各组细胞酶标仪450 nm处吸光度值(optical density,OD450)。
取对数生长期的各组SO-RB50/VCR细胞,按照每孔5×104个细胞接种至96孔板中,每孔分别加入终浓度为0.005、0.010、0.050、0.100、0.500、1.000 μg/mL的VCR,各组对照孔加入二甲基亚砜(dimethyl sulfoxide,DMSO)溶液,培养48 h后每孔加入10 μL的CCK-8溶液,孵育2 h后,测定各组细胞酶标仪450 nm处吸光度值。计算各VCR浓度组的生长抑制率(%)=(1-实验孔平均OD值/对照孔平均OD值)×100%,其中实验孔为对照组、si-NC组、si-HIF1A-AS1组、si-HIF1A-AS1+pcDNA组及si-HIF1A-AS1+HIF-1α组给药浓度>0的含细胞孔,对照孔为各组给药浓度为0的含细胞孔,调零孔为无细胞的孔。计算时首先将实验孔或对照孔的值减去调零孔值,再取每个剂量组各孔的平均值。根据抑制率及对应浓度使用SPSS 25.0计算出各组细胞的半抑制浓度(median inhibitory concentration,IC50)。
1.2.4实时荧光定量PCR检测lncRNAHIF1A-AS1和HIF-1αmRNA相对表达Trizol试剂提取细胞中总RNA,NanoDrop分光光度计检测RNA浓度和纯度,使用逆转录试剂盒将RNA合成cDNA后,通过使用ETC811PCR扩增仪进行PCR扩增,qPCR引物如下:lncRNA HIF1A-AS1上游引物5’-TTCGGTACTTTACGCACCCT-3’;下游引物5’-TTTTCCTCCTTTTCGCCAGC-3’;HIF-1α上游引物:5’-TCAAGTCAGCAACGTGGAAG-3’;下游引物:5’-ATCGAGGCTGTGTCGACTG-3’;3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物:5’-AGGTCGGTGTGAACGGATTT-3’G;下游引物:5’-TGTAGACCATGTAGTTGAGGTCA-3’。以GAPDH为内参,采用2-△△Ct法计算相对表达量。
1.2.5细胞凋亡实验转染后的各组SO-RB50/VCR细胞接种于96孔板中培养24 h后,胰酶消化后用binding buffer制备成1×105cell/mL的细胞悬液,再加入5 μL Annexin V-FITC与10 μL的PI,避光孵育20 min,通过使用BD FACSCantoTMⅡ流式细胞仪检测细胞凋亡,并使用flowjo 10软件对数据进行分析。
1.2.6Westernblot检测HIF-1α和MRP及P-gp蛋白表达收集各组细胞,加入RIPA蛋白裂解液冰上裂解1 h,离心收集上清,BCA法检测蛋白浓度,取30 μg蛋白进行聚丙烯酰胺凝胶电泳并转膜,5%脱脂奶粉封闭2 h,加入按照说明书进行稀释的抗HIF-1α(1∶1 000稀释)、MRP(1∶500稀释)、P-gp(1∶1 000稀释)、β-actin(1∶1 000稀释)一抗稀释液,4 ℃孵育过夜,次日加辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶2 000稀释),室温孵育60 min,TBST洗涤后加ECL发光液显影,以β-actin为内参,Image J 软件分析蛋白相对表达。
2 结果
2.1lncRNAHIF1A-AS1和HIF-1α蛋白在SO-RB50和SO-RB50/VCR细胞表达情况与SO-RB50细胞相比,SO-RB50/VCR细胞中lncRNA HIF1A-AS1和HIF-1α蛋白表达水平明显升高,差异均有统计学意义(t=7.497、13.717,P<0.001),见图1。

图1 lncRNA HIF1A-AS1和HIF-1α蛋白在SO-RB50和SO-RB50/VCR细胞表达情况 A:SO-RB50和SO-RB50/VCR细胞lncRNA HIF1A-AS1表达;B:SO-RB50和SO-RB50/VCR细胞HIF-1α蛋白表达;aP<0.05 vs SO-RB50细胞。
2.2lncRNAHIF1A-AS1表达对SO-RB50/VCR细胞VCR耐药性的影响与si-NC组相比,si-HIF1A-AS1组SO-RB50/VCR细胞中lncRNA HIF1A-AS1表达水平、OD450及细胞对VCR的IC50值均显著降低,差异均有统计学意义(F=92.336,62.111,15.545,均P<0.001),si-HIF1A-AS1组SO-RB50/VCR细胞凋亡率显著升高,差异有统计学意义(F=182.048,P<0.001),MRP及P-gp蛋白表达水平均显著降低,差异均有统计学意义(F=108.953,93.964,均P<0.001),见图2。

图2 lncRNA HIF1A-AS1表达对SO-RB50/VCR细胞VCR耐药性的影响 A:各组细胞lncRNA HIF1A-AS1表达比较;B:各组细胞OD450值比较;C:各组细胞对VCR的IC50值比较;D:各组细胞凋亡率比较;E:各组细胞MRP、P-gp蛋白表达比较;aP<0.05 vs si-NC组。
2.3lncRNAHIF1A-AS1对SO-RB50/VCR细胞中HIF-1αmRNA和蛋白表达的影响与si-NC组相比,si-HIF1A-AS1组SO-RB50/VCR细胞HIF-1α蛋白表达水平显著降低,差异有统计学意义(F=188.188,P<0.001),HIF-1α mRNA表达差异无统计学意义(P>0.05),见图3。
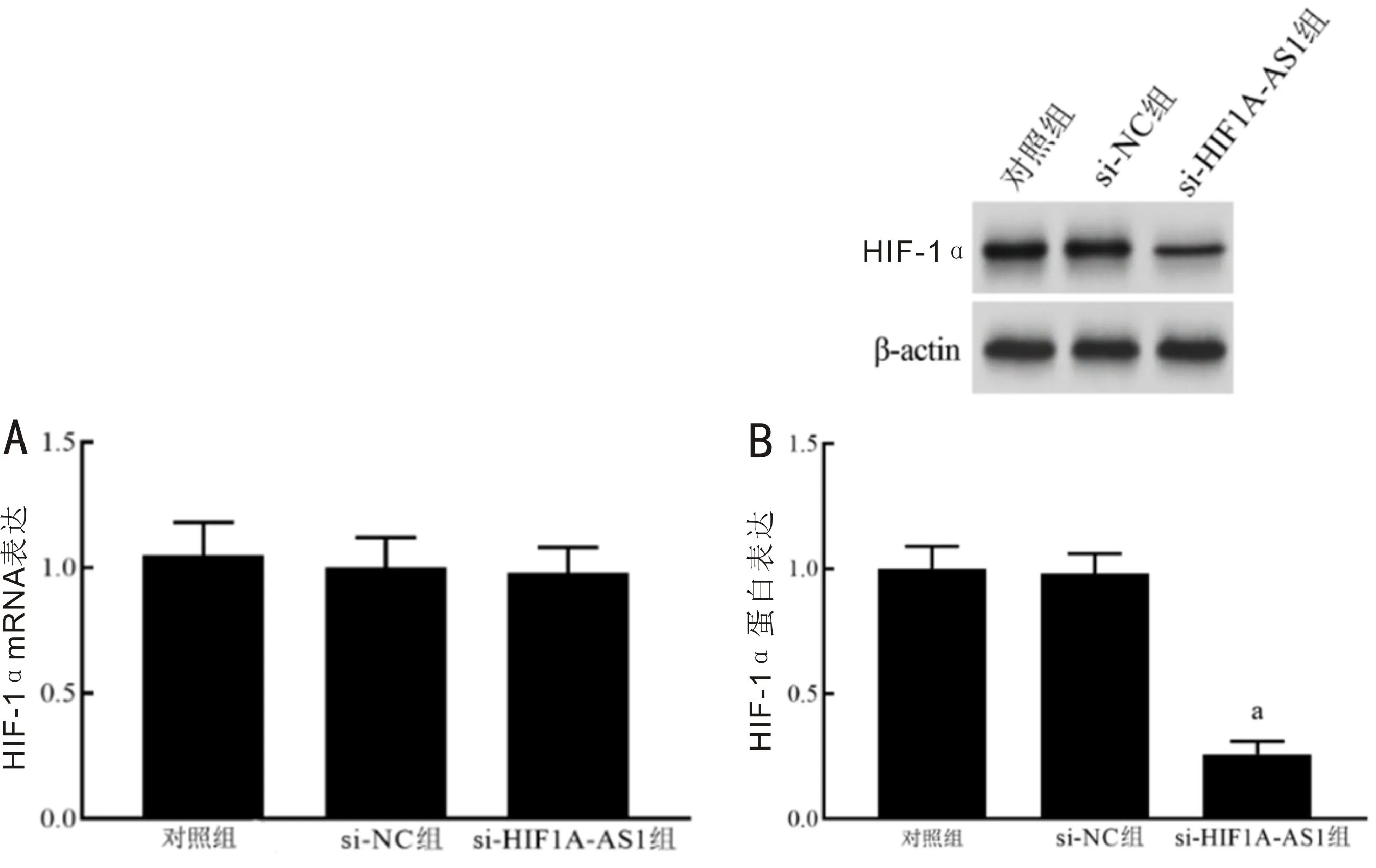
图3 lncRNA HIF1A-AS1对SO-RB50/VCR细胞中HIF-1α mRNA和蛋白表达的影响 A:各组细胞HIF-1α mRNA表达比较;B:各组细胞HIF-1α蛋白表达比较;aP<0.05 vs si-NC组。
2.4lncRNAHIF1A-AS1对SO-RB50/VCR细胞VCR耐药性影响与si-HIF1A-AS1+pcDNA相比,si-HIF1A-AS1+HIF-1α组SO-RB50/VCR细胞OD450、对VCR的IC50值均显著升高,差异均有统计学意义(F=35.586,7.412,P<0.001),SO-RB50/VCR细胞凋亡率显著降低,差异有统计学意义(F=21.629,P<0.001),HIF-1α、MRP、P-gp蛋白表达水平均显著升高,差异均有统计学意义(F=209.638,105.085,90.196,均P<0.001),si-HIF1A-AS1组与si-HIF1A-AS1+pcDNA组比较差异无统计学意义(P>0.05),见图4。
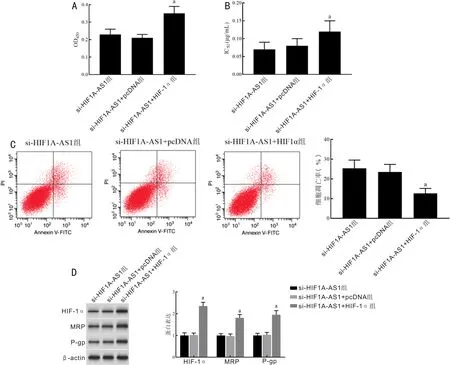
图4 lncRNA HIF1A-AS1对SO-RB50/VCR细胞VCR耐药性影响 A:各组细胞OD450值比较;B:各组细胞对VCR的IC50值比较;C:各组细胞凋亡率比较;D:各组细胞HIF-1α、MRP、P-gp蛋白表达比较;aP<0.05 vs si-HIF1A-AS1+pcDNA组。
3 讨论
化疗是目前治疗RB的主要方法,联合使用长春新碱、依托泊苷和卡铂的VEC方案是最常用的全身静脉化疗方案[8]。然而RB对VCR耐药是导致患者化疗失败的原因之一[9]。耐药性RB会引起肿瘤转移,并增加复发的可能性。而有关RB对VCR耐药的机制尚不完全清楚。因此研究其耐药机制,降低RB对VCR耐药性对提高RB治疗的疗效有重要意义[10-11]。
lncRNA对人类多种疾病具有调控作用,已有研究显示,lncRNA可通过调控肿瘤细胞增殖、凋亡、自噬等影响肿瘤细胞对放化疗的敏感性[12]。研究显示[13],lncRNA X染色体失活基因(X chromosome inactivation,XIST)在RB组织和细胞系中高表达,抑制lncRNA XIST表达可减弱RB细胞的增殖和自噬,增强VCR敏感性。另外,也有研究显示lncRNA DLGAP1-AS2在RB组织中的表达高于正常视网膜组织,沉默lncRNA DLGAP1-AS2可抑制RB细胞增殖、迁移和侵袭,可作为视网膜母细胞瘤治疗的潜在靶点[14]。lncRNA HIF1A-AS1可通过调控肿瘤细胞增殖、凋亡、自噬等生物学行为参与肿瘤的发生发展,研究显示,lncRNA HIF1A-AS1在肺癌、肝癌、结直肠癌等肿瘤中表达上调,与肿瘤进展和患者预后相关[15-16]。另外,有研究表明lncRNA HIF1A-AS1还可参与调节血管平滑肌细胞增殖,可能与动脉瘤的发病机制有关[17]。lncRNA HIF1A-AS1与RB化疗耐药性的关系及其机制尚不完全明确。本研究发现耐药SO-RB50/VCR细胞中lncRNA HIF1A-AS1表达水平高于SO-RB50细胞,初步证实了的高表达状态与RB细胞呈现化疗耐药性有关。为探究lncRNA HIF1A-AS1对SO-RB50/VCR细胞的作用,在SO-RB50/VCR细胞中转染si-lncRNA HIF1A-AS1,结果显示,抑制lncRNA HIF1A-AS1表达可显著降低SO-RB50/VCR细胞增殖水平,诱导细胞凋亡,表明抑制lncRNA HIF1A-AS1可以显著降低SO-RB50/VCR的生物学功能,提高其对VCR药物的敏感性。MRP是细胞耐药形成机制调节蛋白之一,P-gp是膜转运蛋白,单一药物的长期治疗激活P-gp是肿瘤细胞耐药的主要原因[18]。本研究抑制lncRNA HIF1A-AS1表达后,SO-RB50/VCR中耐药相关蛋白MRP、P-gp蛋白表达水平显著降低,细胞对VCR的IC50值降低,进一步证明,抑制lncRNA HIF1A-AS1表达则可显著抑制RB细胞化疗耐药性的产生。
HIF-1α是一种转录因子,在低氧环境下,通过低氧反应原件与靶基因结合,调控转录过程,可参与调节肿瘤血管形成、肿瘤转移与侵袭、糖酵解、癌细胞干性等生物学功能。研究显示,HIF-1α在肝癌、肺癌等肿瘤中高表达,并在缺氧条件下促进肿瘤恶性发展[19-20],而抑制HIF-1α表达可增强结直肠癌细胞的放射敏感性[21]。另外,也有研究显示下调HIF-1α表达后可促进缺氧损伤的视网膜神经胶质细胞活力,并能抑制视网膜新生血管[22]。本研究结果显示,HIF-1α在SO-RB50耐药细胞SO-RB50/VCR中表达水平升高,抑制lncRNA HIF1A-AS1表达后HIF-1α蛋白表达水平降低,而HIF-1α mRNA表达水平不变,提示HIF-1α参与SO-RB50/VCR耐药,且lncRNA HIF1A-AS1可能调控HIF-1α转录后水平。在SO-RB50/VCR细胞中同时抑制lncRNA HIF1A-AS1表达和过表达HIF-1α,发现SO-RB50/VCR细胞凋亡率较单抑制lncRNA HIF1A-AS1表达显著降低,OD450、VCR对细胞的IC50值及HIF-1α、MRP、P-gp蛋白表达水平显著升高,提示过表达HIF-1α可部分抵消抑制lncRNA HIF1A-AS1表达对SO-RB50/VCR细胞耐药性的抑制作用。以上结果表明,抑制lncRNA HIF1A-AS1表达可以通过抑制HIF-1α表达,降低SO-RB50/VCR细胞对VCR的耐药性。但本研究仅测试一种RB细胞株,缺乏实验全面性,对于RB常用化疗药物还有卡铂、依托泊苷等临床用药,因此,后续本研究将使用不同的RB细胞株,并建立不同的耐化疗药物细胞株,深入探究lncRNA HIF1A-AS1与HIF-1α对RB的耐药性影响。
综上,lncRNA HIF1A-AS1在SO-RB50/VCR细胞中高表达,抑制lncRNA HIF1A-AS1表达可通过下调HIF-1α表达抑制SO-RB50/VCR细胞增殖,并降低SO-RB50/VCR细胞对VCR的耐药性,从而提高VCR耐药RB细胞对VCR的化疗敏感性,可作为耐VCR视网膜母细胞瘤化学药物治疗的新的潜在靶点。

