鸢尾素减轻模拟失重下心肌细胞氧化应激和细胞凋亡
赵汐冉,高 寒,武子敬,薛 桐,胡泽兵,张 舒,郭 显,3
(空军军医大学:1航空航天医学系航空航天生物动力学教研室,2基础医学院学员三大队,陕西 西安 710032;3空军军医大学唐都医院呼吸与危重症医学科,陕西 西安 710038)
航天失重环境引起的机体心脏功能改变是影响中长期载人航天飞行亟待解决的难题之一[1]。动物实验、长期卧床和航天飞行研究均发现心脏发生了生理性重塑以适应低负荷环境,且出现收缩力减小、心脏乳头肌肌纤维横截面积减小、心肌细胞凋亡率增加等变化,返回正常重力环境后造成心脏功能下降和立位耐力不良[2]。氧化应激是机体抗氧化反应与氧化反应之间的一种失控状态,其特点是机体活性氧(reactive oxygen species,ROS)生成能力超出了抗氧化系统的清除能力。心肌细胞细胞膜上具有丰富的磷脂质,氧化作用使磷脂质失活,进而损伤心肌细胞结构和功能[3]。大量研究发现,航天飞行所致心血管系统氧化应激水平的改变与航天员心血管疾病的死亡率密切相关[4]。动物和细胞研究也发现,失重环境会诱导超氧化物歧化酶(superoxide dismutase,SOD)降低,造成ROS生成过多,而细胞内源ROS水平增加与心肌细胞凋亡和心脏功能下降密切相关[4]。心肌细胞在成年人心脏中约占30%,是心脏收缩舒张关键细胞,在实现心脏功能中起重要作用。心肌细胞凋亡在原发性高血压、缺血性心脏病和再灌注损伤、心肌病、心律失常等多种心血管疾病中广泛存在,凋亡数量和程度的变化对心血管疾病的发生和发展具有直接影响。已有研究表明回转器模拟失重可显著提高大鼠心肌细胞凋亡率,并升高促凋亡基因p53、caspase-3表达,降低抑凋亡基因Bcl-2表达[5]。因此,寻找防治失重/模拟失重所致心脏氧化应激水平和心肌细胞凋亡变化的潜在药物对于改善心功能,发展长期载人航天事业具有实际意义。
鸢尾素(Irisin)是近期发现的一种可以发挥抗炎、抗凋亡和抗氧化等作用的内源性肽类激素,主要受运动调控,由骨骼肌、心肌等肌细胞分泌。其前体物质为含Ⅲ型纤连蛋白结构域蛋白5(fibronectin type Ⅲ domain-containing protein 5,FNDC5),FNDC5经剪切修饰后可形成Irisin分泌入血,发挥心血管保护作用[6]。研究发现,FNDC5/Irisin可通过增强大鼠内源性抗氧化系统减少阿霉素诱导的心肌细胞氧化应激损伤[7]。在糖尿病心肌病小鼠模型中,FNDC5/Irisin可通过抑制心肌细胞凋亡、心肌纤维化和心脏肥大发挥心脏保护作用,并抑制糖尿病血管内皮细胞损伤,增强血管舒张功能[8]。上述研究提示,Irisin可能通过抑制氧化应激,减轻细胞凋亡,发挥心肌保护作用。本研究拟采用H9C2细胞建立模拟失重模型,深入研究Irisin是否可通过影响氧化应激和细胞凋亡缓解模拟失重导致的心肌细胞损伤,为临床预防太空失重环境引起的航天员心肌损伤提供理论依据和潜在的治疗策略。
1 材料与方法
1.1 材料
H9C2大鼠心肌细胞(中科院上海细胞库);DMEM培养基(高糖)、胎牛血清、青-链霉素双抗、胰蛋白酶(美国Gibco公司);Irisin、BCA蛋白定量试剂盒(美国Sigma公司);anti-GAPDH、anti-BAX、anti-Bcl-2、anti-cleaved caspase-3、anti-caspase-3、anti-SOD1和anti-SOD2抗体(美国Cell Signaling Technology公司);anti-FNDC5抗体(美国Sino Biological公司);辣根过氧化物酶标记的山羊抗兔、山羊抗鼠二抗(北京中杉金桥生物技术有限公司);RNAiso Plus细胞裂解液、SYBR®Premix Ex TaqTM、Prime Script®RT Reagent Kit(日本TaKaRa公司);M-PER哺乳动物蛋白抽提试剂(美国Thermo Fisher Scientific公司);PVDF膜(美国Invitrogen公司);大鼠Irisin酶联免疫吸附测定试剂盒(美国Elabscience公司);丙二醛(malondialdehyde,MDA)检测试剂盒、还原型谷胱甘肽(glutathione,GSH)和氧化型谷胱甘肽检测试剂盒、ROS检测试剂盒、总SOD活性检测试剂盒(上海碧云天生物技术公司);实时定量PCR仪、酶标仪、Western blotting电泳、半干转仪(美国Bio-Rad公司);凝胶成像仪(上海天能科技有限公司);无菌CO2细胞培养箱(美国Thermo Fisher Scientific公司);2D回转器(中国航天员科研训练中心)。
1.2 方法
1.2.1 细胞培养 使用含有100 mL/L胎牛血清、10 g/L双抗的高糖DMEM完全培养基,在50 mL/L CO2、37 ℃、95%湿度的培养箱中常规培养H9C2细胞,所有实验均用第4~8代细胞。
1.2.2 模拟失重细胞模型建立 使用2D-Clinost回转器模拟细胞失重环境,接种2×105/瓶的H9C2细胞于25 cm2回转舱专用培养瓶中常规培养。细胞贴壁后,过滤培养基并灌满培养瓶,完全去除气泡后盖上塞子和盖子。将培养瓶放入回转器中,以24 r/min的速度绕水平轴回转72 h,获得的细胞为模拟失重组(SMG组)。对照组(CON组)置于相同环境中常规培养,不回转。Irisin处理组(Irisin组)使用5 nmol/L Irisin预处理H9C2细胞2 h;模拟失重+Irisin保护组(SMG+Irisin组)H9C2细胞用5 nmol/L Irisin预处理2 h后灌液,使用2D回转器回转72 h。
1.2.3 qRT-PCR 使用RNAiso Plus提取H9C2细胞总RNA,Prime Script®RT Reagent Kit试剂盒用于将RNA逆转录为cDNA,以GAPDH作为内参基因,使用CFX96 real-time PCR检测系统和SYBR®Premix Ex TaqTM检测mRNA表达水平,使用Ct(2-△△Ct)法计算样本间mRNA的相对表达量。PCR引物序列见表1。

表1 基因引物序列
1.2.4 Western blotting检测 使用胰蛋白酶消化、收集并裂解细胞,提取细胞总蛋白。超声裂解蛋白3次,在12 000 r/min、4 ℃下离心10 min,吸取上清后使用BCA法进行蛋白定量。获得的总蛋白通过100~150 g/L SDS-PAGE分离并转移至PVDF膜,用50 g/L脱脂牛奶于室温封闭1.5 h,然后与特异性一抗GAPDH(1∶1 000)、FNDC5(1∶1 000)、BAX(1∶1 000)、Bcl-2(1∶1 000)、caspase-3(1∶1 000)、cleaved caspase-3(1∶1 000)、SOD1(1∶1 000)、SOD2(1∶1 000)在4 ℃孵育过夜。用TBST清洗后,二抗(1∶5 000)室温孵育2 h,再用TBST清洗后,加入显影液显影留存,使用Image Lab软件定量分析蛋白条带。
1.2.5 ELISA检测Irisin含量 采用双抗体夹心ELISA法检测细胞上清中的Irisin含量,按照试剂盒说明书操作:收集细胞上清后于4 ℃、1 000g离心20 min,取100 μL上清加入酶标板,覆膜后于37 ℃孵育1.5 h,甩尽孔内液体后加入100 μL生物素化抗体,覆膜,37 ℃孵育1 h,洗涤3次后加入100 μL酶结合物,覆膜,37 ℃孵育30 min,洗涤5次后加入底物溶液90 μL,覆膜后避光,37 ℃孵箱放置15 min,取出后终止反应,立刻使用酶联免疫检测仪检测A450 nm值。
1.2.6 MDA、GSH和ROS含量检测 分别采用硫代巴比妥酸法、二硫代二硝基苯甲酸闭塞定量法测定MDA含量、GSH含量;采用荧光探针DCFH-DA法检测ROS水平,按照试剂盒说明书处理细胞后,采用流式细胞术检测。
1.2.7 SOD活性测定 收集并裂解细胞后,4 ℃、12 000 r/min,离心5 min,收集上清后采用黄嘌呤氧化酶法检测总SOD活性,按照试剂盒说明书操作后,使用酶联免疫检测仪检测A450 nm值。
1.2.8 流式细胞术 细胞经胰蛋白酶消化离心后,使用预冷的PBS洗涤,在细胞中加入Annexin V-FITC/PI染料,室温下避光15 min,使用流式细胞仪检测Annexin V阳性细胞。
2 结果
2.1 模拟失重对H9C2细胞FNDC5/Irisin表达的影响
为了探究FNDC5/Irisin是否在模拟失重下差异表达,将H9C2细胞置于2D回转器培养72 h后进行qRT-PCR和Western blotting检测,并使用ELISA试剂盒检测细胞上清中Irisin水平。结果表明,与CON组相比,SMG组H9C2细胞的FNDC5mRNA表达显著降低(P<0.01,图1A)、FNDC5和Irisin的蛋白表达以及细胞上清中的Irisin含量均显著降低(均P<0.01,图1B~E)。
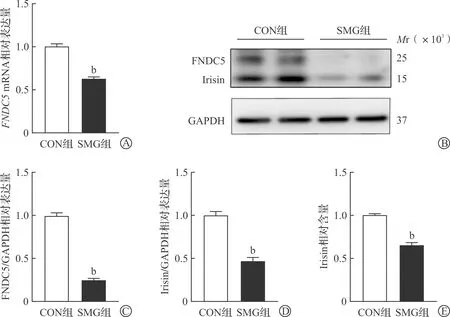
A:模拟失重72 h后H9C2细胞的FNDC5 mRNA表达;B:模拟失重72 h后H9C2细胞的FNDC5、Irisin蛋白表达;C:模拟失重72 h后H9C2细胞的FNDC5/GAPDH相对表达量;D:模拟失重72 h后H9C2细胞的Irisin/GAPDH相对表达量;E:模拟失重72 h后细胞上清中的Irisin相对含量。CON组:对照组;SMG组:模拟失重组。FNDC5:含Ⅲ型纤连蛋白结构域蛋白5;Irisin:鸢尾素。bP<0.01 vs CON组。
2.2 Irisin对模拟失重导致的H9C2细胞氧化应激水平的影响
为了探究Irisin对模拟失重诱导的细胞氧化应激的影响,将H9C2细胞置于2D回转器培养72 h后检测ROS、MDA和GSH含量。ROS广泛指代氧来源的自由基和非自由基,高水平的ROS提示氧化应激水平的升高。MDA是脂质过氧化反应的终产物,MDA的增加提示氧化应激水平的升高。GSH是一种低分子清除剂,可清除O2-、H2O2等,GSH的降低提示氧化应激水平的升高,是衡量机体抗氧化能力的重要指标。流式细胞术检测结果显示,与CON组相比,SMG组ROS水平显著增加(P<0.01,图2A~B),MDA含量显著增加(P<0.01,图2C),GSH含量显著降低(P<0.01,图2D);与SMG组相比,Irisin预处理后,SMG+Irisin组H9C2细胞的ROS产量明显降低(P<0.01,图2A~B),MDA含量降低(P<0.01,图2C),GSH含量升高(P<0.01,图2D),提示Irisin预处理可减轻模拟失重诱导的心肌细胞氧化应激水平升高。
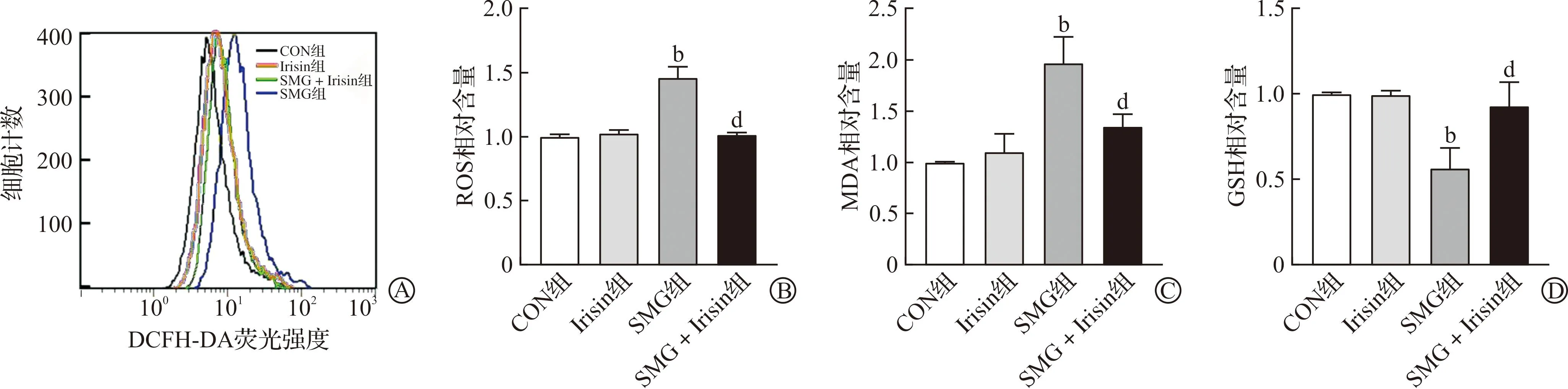
A:模拟失重72 h后H9C2细胞的ROS生成;B:模拟失重72 h后H9C2细胞的ROS生成数据统计;C:模拟失重72 h后H9C2细胞的MDA相对含量;D:模拟失重72 h后H9C2细胞的GSH相对含量。CON组:对照组;SMG组:模拟失重组;Irisin组:Irisin处理组;SMG+Irisin组:模拟失重+Irisin保护组。ROS:活性氧;MDA:丙二醛;GSH:还原型谷胱甘肽;Irisin:鸢尾素。bP<0.01 vs CON组;dP<0.01 vs SMG组。
2.3 Irisin对模拟失重环境下H9C2细胞的抗氧化酶活性和表达的影响
为了进一步探究Irisin对模拟失重下H9C2细胞抗氧化酶SOD的影响,使用Irisin预处理H9C2细胞后在回转器中培养72 h后检测SOD1、SOD2蛋白表达情况,使用试剂盒检测细胞总SOD酶活性。Western blotting检测结果显示,SMG组较CON组蛋白SOD1、SOD2表达显著下降(均P<0.01,图3A~C),总SOD酶活性明显降低(P<0.01,图3D);而Irisin预处理可明显改善SOD1、SOD2表达水平和总SOD酶活性(均P<0.01,图3A~D)。

A:模拟失重72 h后H9C2细胞的SOD1、SOD2蛋白表达;B:模拟失重72 h后H9C2细胞的SOD1/GAPDH相对表达量;C:模拟失重72 h后H9C2细胞的SOD2/GAPDH相对表达量;D:模拟失重72 h后H9C2细胞中的总SOD酶活性。CON组:对照组;SMG组:模拟失重组;Irisin组:Irisin处理组;SMG+Irisin组:模拟失重+Irisin保护组。Irisin:鸢尾素。bP<0.01 vs CON组;dP<0.01 vs SMG组。
2.4 Irisin对模拟失重环境下H9C2细胞凋亡的影响
为了探究Irisin对模拟失重下H9C2细胞凋亡的影响,使用Irisin预处理H9C2细胞后在回转器中培养72 h。流式细胞术检测结果显示,与CON组相比,仅加入Irisin后总细胞数量及凋亡细胞数量均无显著改变,SMG组细胞凋亡率显著增加(P<0.01,图4A~B);Western blotting检测显示,相较CON组,SMG组蛋白cleaved caspase-3(P<0.01,图4C~D)、BAX(P<0.05,图4E)的表达显著增加,同时抗凋亡蛋白Bcl-2的表达量显著下降(P<0.01,图4F),与SMG组相比,SMG+Irisin组细胞凋亡率明显降低(P<0.01,图4A~B),cleaved caspase-3/caspase-3值显著降低、BAX表达降低、Bcl-2表达升高(均P<0.01,图4C~F)。
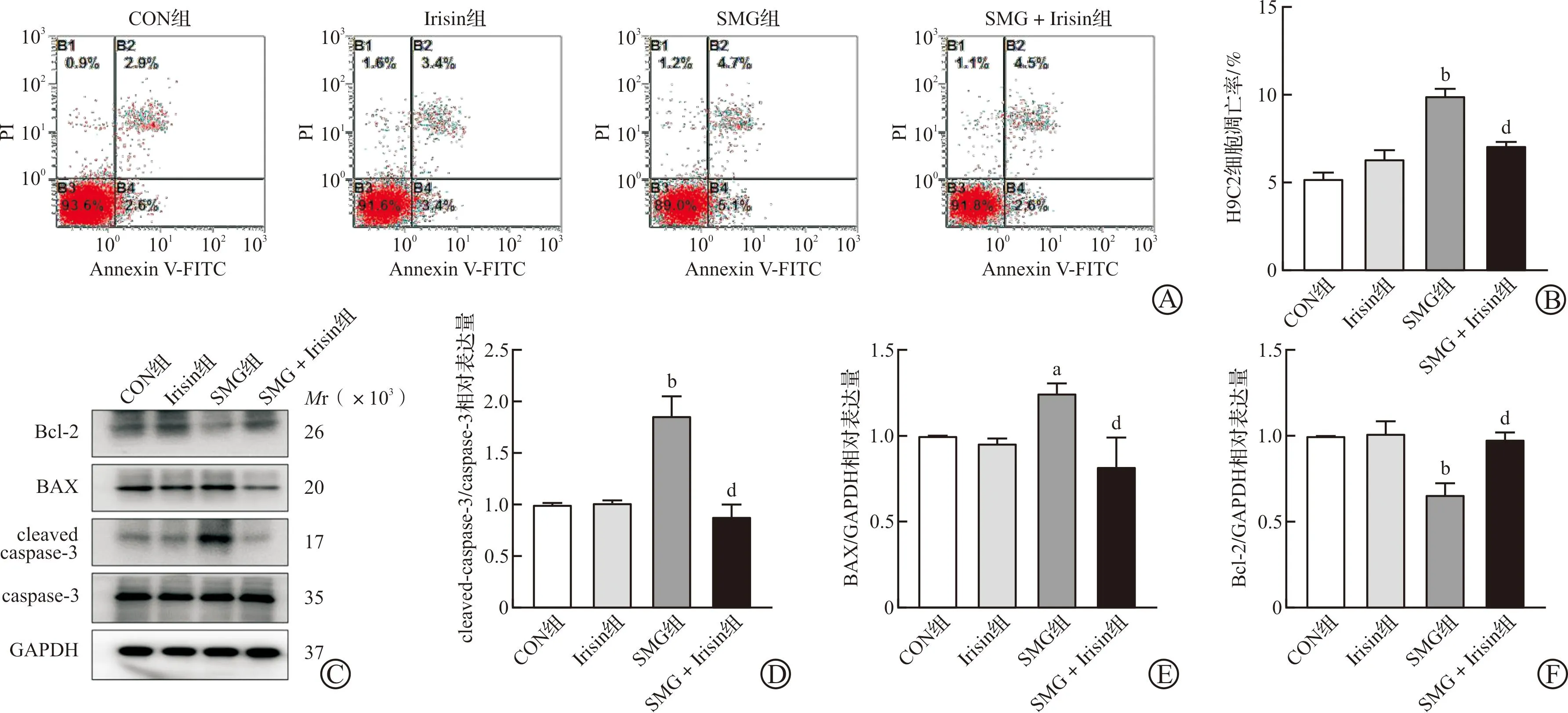
A:模拟失重72 h后H9C2细胞凋亡情况;B:模拟失重72 h后H9C2细胞凋亡率;C:模拟失重72 h后H9C2细胞的BAX、Bcl-2、cleaved caspase-3、caspase-3表达;D:模拟失重72 h后H9C2细胞的cleaved caspase-3/caspase-3相对表达量;E:模拟失重72 h后H9C2细胞的BAX/GAPDH相对表达量;F:模拟失重72 h后H9C2细胞的Bcl-2/GAPDH相对表达量。CON组:对照组;SMG组:模拟失重组;Irisin组:Irisin处理组;SMG+Irisin组:模拟失重+Irisin保护组。Irisin:鸢尾素。aP<0.05,bP<0.01 vs CON组;dP<0.01 vs SMG组。
3 讨论
随着我国载人航天工程进入空间站时代,航天员将长期暴露于航天微重力环境,研究微重力环境对航天员的影响与防护成为亟待解决的关键问题。航天医学研究发现,航天环境可导致航天员心脏结构重塑和功能失调,增加航天员的心血管疾病死亡率[4,9-14]。心肌细胞是心脏收缩舒张关键细胞,在实现心脏功能中起重要作用。已有研究表明,心肌细胞异常凋亡在心肌重塑和心脏功能下降中起主导作用[5]。动物实验表明尾悬吊模拟失重可显著提高大鼠心肌细胞凋亡率,并降低抑凋亡基因Bcl-2表达[15]。氧化应激是细胞内氧自由基及相关代谢产物过量聚集的一种病理状态。研究发现,长时间暴露于太空环境使机体处于高度应激状态,航天员体内氧化应激水平显著升高[16-17]。地面模拟失重大鼠心肌组织中O2-、MDA和H2O2含量显著升高,提示氧化应激水平升高[18]。上述研究发现表明,航天飞行环境中体内氧化应激水平的改变和心肌细胞凋亡率的增加与航天员心血管疾病的发生密切相关。运动康复治疗在多种地面心血管疾病治疗中取得了不同程度的疗效[19]。目前,对抗失重环境不良效应的措施主要包括体育锻炼和药物防护,但在航天环境中需耗费大量时间且疗效欠佳。因此,寻找改善失重所致氧化应激和心肌细胞凋亡增加的策略对于改善中长期太空飞行所致的航天员心血管系统损伤具有重要意义。
Irisin是新近发现的一种由骨骼肌、心肌等肌细胞分泌的内源性肽类激素,主要受运动调控,而航天员执行航天飞行任务时,运动强度降低,全身肌肉萎缩等均可能导致机体Irisin生成能力不足。其前体FNDC5经剪切修饰后可形成Irisin分泌入血,可以发挥抗炎、抗凋亡和抗氧化等作用。研究发现,Irisin能够抑制心肌梗死小鼠的氧化应激损伤,增加SOD1和SOD2的表达,并显著降低细胞中ROS水平[20]。Irisin能够抑制心肌组织阿霉素诱导产生的ROS,并显著降低心肌损伤大鼠的心肌细胞凋亡,起心肌保护作用[21]。还有研究发现,当机体产生Irisin时,可通过改善氧化应激维持心肌细胞线粒体稳态,改善心肌细胞状态[22]。本研究旨在探讨FNDC5/Irisin对模拟失重下心肌细胞氧化应激和细胞凋亡改变的影响,以期寻找内源性的改善航天员心血管适应性的潜在治疗策略。结果表明,模拟失重72 h后,H9C2心肌细胞氧化应激水平明显升高,心肌细胞凋亡率显著增加,而Irisin预处理可明显改善H9C2心肌细胞氧化应激和细胞凋亡,表明Irisin可成为航天失重环境所致心脏功能下降的潜在治疗措施。
研究发现,Irisin可通过多种通路调节心肌细胞功能,对改善心血管疾病的病理进程发挥积极作用[23]。SONG等[24]研究发现,刺激AKT的磷酸化来抑制过氧化等因素造成的心肌损伤;李丽等[25]研究发现,Irisin通过整合素αV/β5受体-GPX4信号途径抑制心肌缺血再灌注小鼠的心肌铁死亡,发挥心肌保护作用;CHEN等[26]研究发现,Irisin通过Nrf2介导的ROS/TGF-β1/Smad2/3信号轴抑制心肌纤维化;YU等[27]研究发现,Irisin通过AMPK/mTOR信号传导抑制心肌肥厚。本研究发现,模拟失重环境下心肌细胞氧化应激水平和细胞凋亡同步变化,提示模拟失重下氧化应激水平增加可能是导致心肌细胞凋亡的重要环节,与航天飞行中心功能下降关系密切。Irisin处理后,心肌细胞ROS生成、MDA和GSH含量变化与细胞凋亡相关蛋白及细胞凋亡率变化呈现一定相关性,提示模拟失重下Irisin可能通过抗氧化应激发挥心肌保护作用。氧化应激与心肌细胞凋亡之间是否存在某种联系及Irisin发挥心肌保护作用的机制,将是我们下一步研究的内容。
综上所述,本研究发现Irisin预处理可减轻模拟失重所致的H9C2细胞氧化应激升高和细胞凋亡增加,为太空飞行任务中的心功能保护提供新策略和新思路。

