血清ESM-1、TuM2-PK联合结肠镜检查诊断早期结直肠癌的临床价值
王微微,朱晓继,丛卉,姜树中,殷建飞,袁伟燕
(1.南通大学,江苏 南通 226019;上海大学附属南通医院·南通市第六人民医院,2.消化内科;3.内镜中心;4.ICU;江苏 南通 226000;5.南通市第一人民医院消化内科,江苏 南通 226001)
结直肠癌是全球最常见的恶性肿瘤之一,WHO数据[1]显示,每年新增病例约为190万例,致死人数约为90万例,占所有癌症死亡的9.2%。在过去的几十年里,尽管结直肠癌的发病率和死亡率在发达国家有所下降,但在发展中国家仍呈上升趋势,早期诊断和治疗对于改善患者生存率和生活质量具有重要意义[2]。结肠镜检查作为结直肠癌筛查的重要手段,在提高结直肠癌早期发现和预防的效果方面具有明显优势,但受限于技术水平、操作者经验等因素,其准确性仍有待提高,寻找辅助结肠镜检查的高灵敏度和高特异度生物标志物,以提高结直肠癌筛查的准确性和可靠性,具有重要的临床价值[3]。内皮细胞特异性分子-1(endothelial cell-specific molecule-1,ESM-1)是一种分泌型糖蛋白,在肿瘤生长、转移及新生血管形成过程中表达增加。近年来,研究发现ESM-1在结直肠癌患者中的表达水平显著高于正常人群,提示其可作为结直肠癌诊断的潜在生物标志物[4]。肿瘤M2型丙酮酸激酶(tumor M2-pyruvate kinase,TuM2-PK)是一种肿瘤标志物,主要存在于肿瘤细胞的细胞质和线粒体中,一些研究[5]表明,TuM2-PK在结直肠癌患者血清中的表达水平明显升高,且与肿瘤的生物学行为、临床分期及预后密切相关。但目前尚无ESM-1、TuM2-PK与结肠镜联合用于结直肠癌联合诊断的相关报道。本研究旨在探讨血清ESM-1、TuM2-PK水平及结肠镜检查联合诊断早期结直肠癌的临床价值。
1 资料与方法
1.1 一般资料
选取2020年12月至2022年12月南通市第六人民医院120例疑似结直肠癌患者作为研究对象。纳入标准:(1)年龄>18岁;(2)因长期腹泻、便秘、黏液血便等消化道症状入院就诊;(3)临床资料、检查记录完整。排除标准:(1)存在严重心、肝、肾等器官功能不全;(2)有血液系统疾病;(3)有严重感染或炎症者;(4)凝血功能异常者;(5)合并其他恶性肿瘤者;(6)无法耐受相关检查者。根据病理检查结果分为恶性组(n=52)、良性组(n=68)。恶性组中,男性30例,女性22例;年龄(50.21±10.13)岁;体质量指数BMI(23.25±2.55)kg/m2;结肠癌35例,直肠癌17例。良性组中,男性35例,女性33例, (49.34±9.87)岁;BMI(23.75±2.68)kg/m2;结肠息肉45例,炎症性肠病23例。两组性别、年龄、BMI等一般资料比较,差异均无统计学意义(P>0.05)。
1.2 结肠镜检查
采用日本Olympus CF H260AI电子结肠镜,检查前2 d开始低残渣饮食,检查前1 d晚上6点开始口服10%硫酸钠镇痛剂,每次30 mL,间隔30 min,共4次,检查当天早上6点继续使用10%硫酸钠,每次30 mL,间隔30 min,共3次。以清洁结肠,确保肠道内无明显残留粪便。检查时取左侧卧位,双腿屈曲,内镜医师在规范的无菌操作条件下进行结肠镜检查,首先对肛门及直肠进行局部麻醉,然后将结肠镜沿肛门缓慢插入,并顺着结肠的生理弯曲向前推进,检查过程中医师需要注意调整结肠镜的角度,避免损伤患者肠道。进镜时,结肠镜沿肠道向前推进,逐步穿过乙状结肠、降结肠、横结肠、升结肠,最后到达回盲部,退镜时对肠道进行仔细观察,寻找并记录病变部位、范围、形态等特征。阳性征象:肿块或不规则增生,尤其是腺瘤样息肉,黏膜颜色、质地或形状改变,存在溃疡、糜烂或其他异常病变,有出血或出肠分泌物。可疑病变取活检标本,送病理科检查。
1.3 血液指标检测
采集患者空腹外周静脉血,离心分离血清,采用酶联免疫吸附试验测定血清ESM-1、TuM2-PK水平。
1.4 观察指标
比较恶性组和良性组血清ESM-1、TuM2-PK水平及结肠镜检查结果,绘制受试者工作特征曲线(receiver operating characteristic curve,ROC)分析ESM-1、TuM2-PK单独及联合诊断结直肠癌的诊断效能,以病理检查结果为“金标准”,分析ESM-1、TuM2-PK、结肠镜单独及联合诊断结直肠癌的敏感度、特异度、准确度、阳性预测值、阴性预测值及Kappa值。
1.5 统计学分析
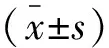
2 结果
2.1 恶性组与良性组血清ESM-1、TuM2-PK水平及结肠镜检查结果比较
恶性组血清ESM-1、TuM2-PK水平均高于良性组(P<0.05),结肠镜检查阳性率高于良性组(P<0.05)。见表1。
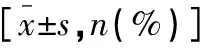
表1 恶性组与良性组血清ESM-1、TuM2-PK水平及结肠镜检查结果
2.2 结肠镜检查阳性与阴性患者血清ESM-1、TuM2-PK水平比较
结肠镜检查阳性患者血清ESM-1、TuM2-PK水平均高于结肠镜检查阴性组(P<0.05)。见表2。

表2 结肠镜检查阳性与阴性患者血清ESM-1、TuM2-PK水平
2.3 血清ESM-1、TuM2-PK单独及联合诊断结直肠癌的诊断价值
ROC曲线显示,ESM-1、TuM2-PK联合诊断结直肠癌敏感度及对应的曲线下面积(AUC)均高于单独诊断(P<0.05)。见表3及图1。
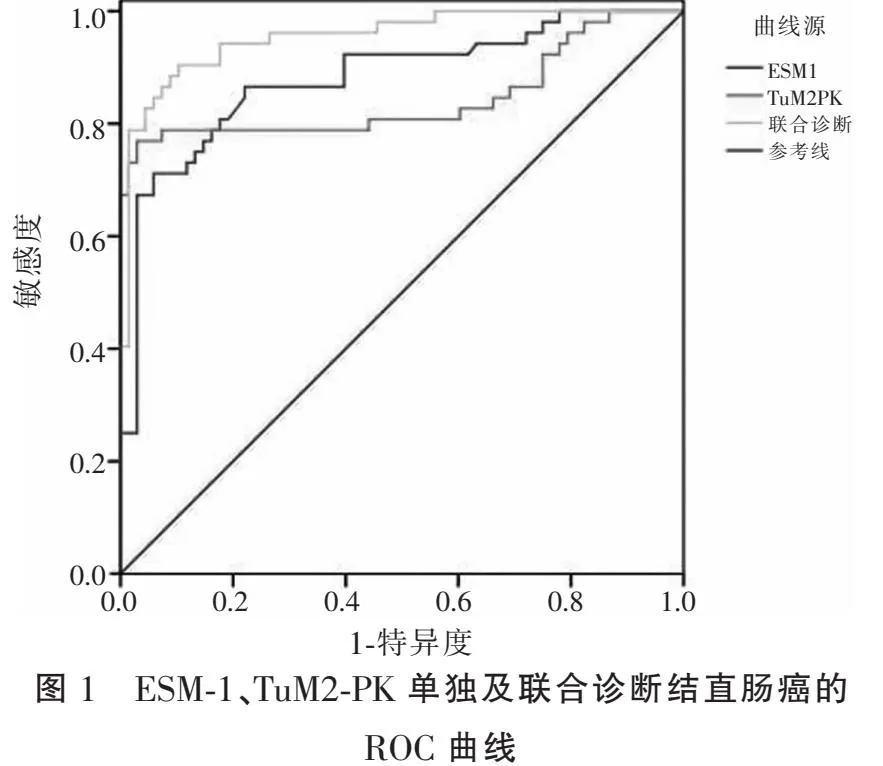
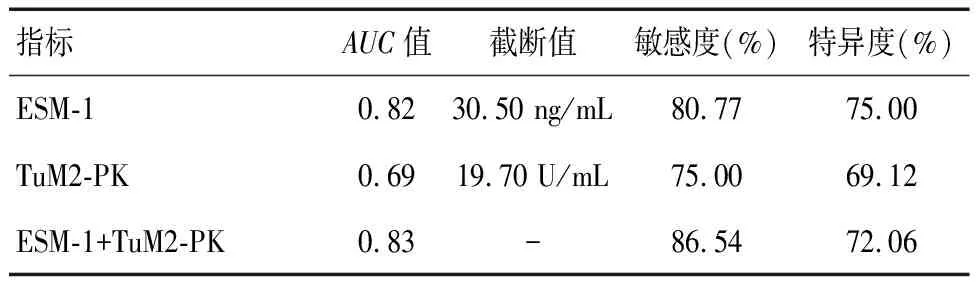
表3 血清ESM-1、TuM2-PK单独及联合诊断结直肠癌的诊断价值
2.4 血清ESM-1、TuM2-PK水平及结肠镜检查对的结直肠癌诊断效能分析
以病理诊断为“金标准”,血清ESM-1、TuM2-PK水平联合结肠镜诊断结直肠癌的敏感度、准确度及Kappa值均高于各单项诊断(P<0.05)。见表4。
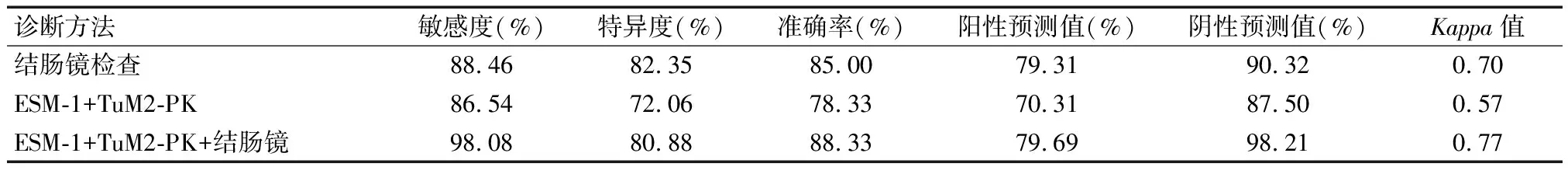
表4 血清ESM-1、TuM2-PK水平及结肠镜检查对的结直肠癌诊断效能
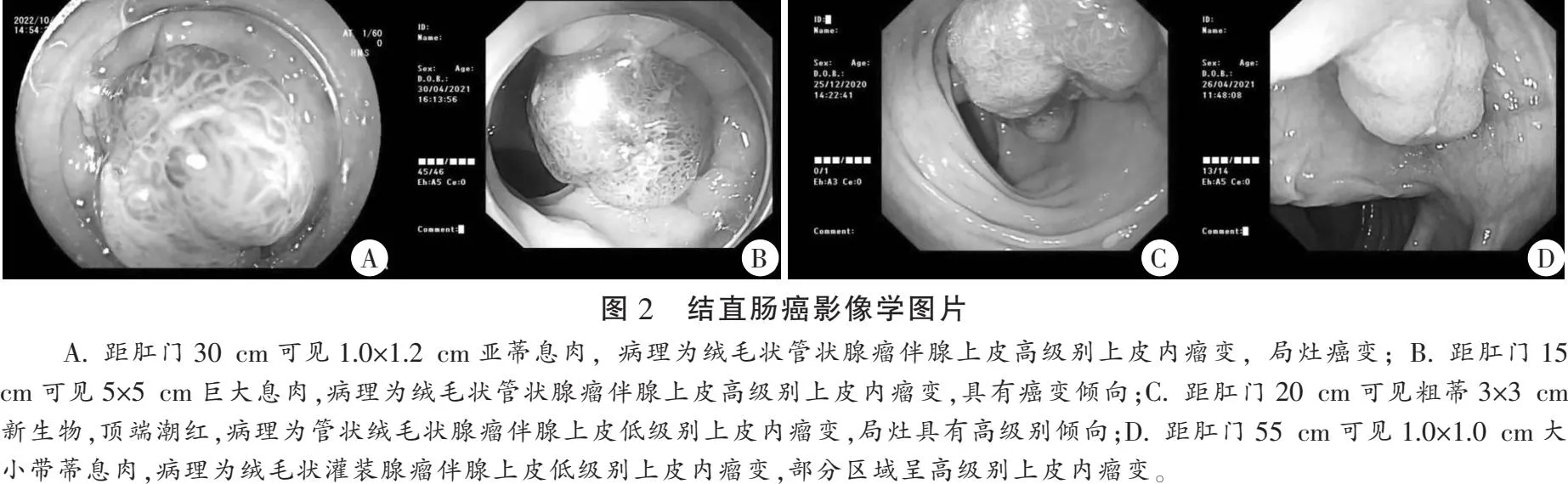
2.5 影像学表现
结直肠癌影像学表现。见图2。
3 讨论
早诊断、早治疗对于结直肠癌患者的预后至关重要,然而许多结直肠癌患者在确诊时已经进入中晚期,错过了最佳治疗时机,因此寻求一种敏感且特异的方法来提高早期结直肠癌的诊断效能具有重要的临床意义。
本研究发现,恶性组患者血清ESM-1和TuM2-PK水平均显著高于良性组。ESM-1主要表达于内皮细胞、肺泡上皮细胞、肾脏髓质细胞等细胞中,近年来研究发现,ESM-1在多种恶性肿瘤中表达上调,与肿瘤的侵袭、转移及预后密切相关[6-7]。恶性组ESM-1水平高于良性组的可能原因如下:(1)ESM-1与肿瘤的血管生成有关,而血管生成是肿瘤生长和转移的关键过程,而恶性肿瘤细胞可分泌细胞因子刺激血管生成,从而提高血液中ESM-1水平;(2)ESM-1在炎症反应中起着重要作用,可作为炎症和肿瘤进展的标志物,在恶性肿瘤中,炎症反应更为显著,导致ESM-1水平显著增加;(3)恶性肿瘤具有较高的增值率、侵袭性和转移潜力,这些特性可导致恶性肿瘤中ESM-1的表达和分泌更为活跃,表现为血清ESM-1水平升高[8-9]。TuM2-PK是一种细胞代谢酶,参与肿瘤细胞的能量代谢,既往相关研究[10-11]显示TuM2-PK在多种恶性肿瘤中表达上调,与肿瘤的生长、侵袭和预后相关。恶性组血清TuM2-PK水平高于良性组,可能原因是:TuM2-PK是一种在糖酵解过程中起作用的酶,与肿瘤细胞的代谢活动密切相关,恶性肿瘤快速增殖导致细胞代谢率增高,uM2-PK的活性和表达通常增加;恶性肿瘤的微环境通常更加复杂多变,导致TuM2-PK的表达和活性增强[12-13]。由此可见,血清ESM-1和TuM2-PK可作为结直肠癌的潜在生物标志物。
ROC曲线显示,血清ESM-1和TuM2-PK联合诊断结直肠癌的效能要优于它们各自单独诊断,这表明将两种生物标志物组合应用可提高早期结直肠癌的诊断效能。结肠镜检查的优势在于可直接观察肠道黏膜,发现早期结直肠癌如息肉、隆起型病变,部分早期病灶可在结肠镜下进行切除,实现微创治疗。但受到多种主客观因素的影响,单独依靠结肠镜诊断具有一定的漏诊、误诊风险[14-15]。本研究发现,血清ESM-1、TuM2-PK水平联合结肠镜诊断结直肠癌的敏感度与准确度均优于单独使用结肠镜诊断,这意味着结合血清生物标志物和结肠镜检查可以有效提高早期结直肠癌的诊断准确性,联合诊断的一致性检验Kappa值为0.77,提示与病理诊断一致性良好。
综上,结肠镜检查在结直肠癌的早期诊断中具有一定优势,结合血清ESM-1和TuM2-PK水平检测,可进一步提高早期结直肠癌的诊断准确度,血清ESM-1、TuM2-PK联合结肠镜对早期结直肠癌敏感度、准确度较高,具有较高的诊断效能,与病理检查具有良好的一致性,值得临床推广应用。

