猕猴桃细菌性溃疡病菌的分离鉴定与致病性分析
吴仲秋, 牛向丽, 汪雯静, 李 璇, 刘骏菲, 邬杰涛
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
猕猴桃(Actinidiaspp.)是一种多年生落叶藤本果树隶属于猴桃科猕猴桃属[1],因其果实独特的口感风味和丰富的营养成分而深受消费者喜爱。猕猴桃原产于中国,但其驯化却始于19世纪末20世纪初猕猴桃种质资源从中国流出后。在20世纪30年代新西兰驯化开发了绿果美味猕猴桃品种‘海沃德’(A.deliciosa‘Hayward’),并逐渐在世界各地引种。较大规模的商业化生产在20世纪80年代开始兴起[2],随后培育的中华猕猴桃(A.chinensis)‘Hort16A’、黄果品种‘金桃’、红果品种‘红阳’也被商业化,在中国、新西兰及欧亚等地广泛种植[3]。
在猕猴桃驯化和农业化种植早期,并未报道有严重病害。但伴随单一克隆品种的规模化种植,1984年在日本发现溃疡病,1989年分离丁香假单胞菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae,Psa)[4]。Psa是一种革兰氏阴性菌,通过气孔、皮孔、脱落疤痕、修剪切口等自然开口或伤口,可进入所有类型猕猴桃组织,并通过在维管系统中定植而实现系统性传播,危害猕猴桃的叶、芽、枝干等部位,出现叶斑坏死、枝干腐烂、嫩枝枯死、果斑结痂等溃疡病症状[5-7]。2008—2010年强致病性Psa在不同国家的不同品种猕猴桃种植区快速传播,导致溃疡病大爆发,对全球范围猕猴桃产区造成了持续的经济损失,也严重影响了我国猕猴桃产业的发展[8-10]。
目前,国内外对猕猴桃溃疡病的研究已取得显著进展,尤其是在溃疡病起源和传播方式、鉴定方法以及各猕猴桃种质资源的感病性等方面[11-16],而对Psa致病基因及其分子机制仍有待深入研究。因此,分离鉴定具有致病性差异的Psa菌株成为探讨其病原-宿主植物互作机制的一个重要切入点。
本研究利用采集于四川省(猕猴桃重要产区之一)不同种植区的溃疡病染病枝条,对Psa病原菌进行分离、鉴定,并通过植物接种对其致病性进行检测,以获取更具多样性的Psa国内菌株,用于后续遗传差异分析及致病机制研究。
1 材料与方法
1.1 实验材料
猕猴桃种植区的溃疡病染病枝条采集于四川省都江堰市、雅安市、宜宾市、马边彝族自治县,用于本研究中分离Psa病菌;猕猴桃品种‘红阳’(Actinidiachinensiscv.‘Hongyang’)、烟草(Nicotianabenthamiana)植株均由本实验室繁育种植, 用做溃疡病菌接种植物材料。
FastPfu DNA Polymerase购于北京全式金生物技术有限公司;Silwet L-77、a-萘乙酸、蛋白胨、6-苄氨基嘌呤、氯化镁、硫酸镁、磷酸氢二钾、无水乙醇、甘油、蔗糖、琼脂粉、琼脂糖等,均为国外原装或国产分析纯试剂。
KB(King’s B)培养基:取蛋白胨20.0 g、磷酸氢二钾1.5 g、硫酸镁1.5 g、琼脂15.0 g、甘油10 mL,溶于1 L去离子水中,121 ℃高压灭菌15 min;MS(Murashige and Skoog)培养基:取MS粉4.43 g、蔗糖20 g、琼脂6 g,溶于1 L去离子水中,调节pH值至5.8;猕猴桃组培苗继代培养基:取1 L MS培养基,高温高压灭菌后,冷却至55 ℃左右加入1 mg/mL 6-苄氨基嘌呤溶液1 mL、1 mg/mL a-萘乙酸溶液300 μL,分装于组织培养瓶备用。
1.2 实验方法
1.2.1 猕猴桃溃疡病菌的分离纯化与鉴定
将有明显溃疡病症状的猕猴桃采集枝条进行韧皮部取样,加入无菌水充分研磨,取上清,涂布于KB培养基,28 ℃培养36~48 h。选取具有丁香假单胞菌形态的细菌单菌落,进行多次KB平板划线培养,并将所获得的纯化菌落与已鉴定的Psa菌株(ScMcH、ScPzH)[17]进行形态学比较。
利用已报道的Psa病原菌特异引物[18]Psa-F1(TTTTGCTTTGCACACCCGATTTT)、Psa-R2(CACGCACCCTTCAATCAGGATG),对纯化菌株进行菌落聚合酶链式反应(polymerase chain reaction,PCR)。
分别对所扩增16S-23S DNA片段进行测序,然后将测序序列在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库进行比对。
1.2.2 ‘红阳’ 猕猴桃组织培养
取猕猴桃嫩茎为外植体材料,无菌处理后,将外植体置于MS培养基中生长,获得无菌苗。每隔约20 d进行1次继代培养,获得猕猴桃组培苗。组培室培养条件如下:温度为22 ℃,光照为3 500 lux,12 h光照/12 h黑暗。
1.2.3 溃疡病菌致病性检测
将分离纯化的Psa菌株划线于KB培养基,28 ℃培养36~48 h,以10 mmol/L MgCl2溶液分别稀释成2×1010CFU(colony forming units)的细菌悬浮液,向其中添加Silwet L-77(体积分数为0.025%)。取长势健康的猕猴桃组培苗浸没于上述细菌悬浮液中3 min[19],取出猕猴桃组培苗,于培养基中培养10~12 d,观察发病情况。以10 mmol/L MgCl2溶液平行处理的组培苗为负对照,实验独立重复3次,每个菌株侵染3~5株猕猴桃组培幼苗。
在侵染1 d后取出猕猴桃组培苗,进行拍照和菌落计数。按植株质量加入相应体积10 mmol/L MgCl2溶液,充分研磨,吸取上清液。将上清液以10 mmol/L MgCl2溶液进行梯度稀释。取稀释后菌液5 μL涂布于KB培养基表面,28 ℃培养36~48 h,进行平板菌落计数。实验独立重复3次,计数结果利用SPSS软件进行统计学分析。
1.2.4 烟草叶片超敏反应
将KB培养基活化的Psa菌株以10 mmol/L MgCl2溶液分别稀释为1×107、5×108CFU的细菌悬液。以无针头的1 mL无菌注射器将Psa菌液进行烟草叶片注射,并以MgCl2为负对照,对Psa菌株在烟草叶片中的超敏反应进行观察和拍照记录。实验独立重复3次,每个菌株注射3个烟草叶片。
2 结果分析
2.1 猕猴桃溃疡病菌分离分析
利用不同采集点获得的具有溃疡病症的猕猴桃枝条,按1.2.1所述实验方法进行病原分离。经多次划线纯化,初步获得了6个具有Psa形态特征的菌株。按照采样地点及样品植株品种,将所分离菌株分别命名为ScDjyH2、ScDjyH3(分离于四川都江堰种植区‘红阳’猕猴桃30°99′N,103°65′E)、ScMbJ1(分离于四川马边彝族自治县种植区‘金桃’猕猴桃 29°01′N,103°48′E)、ScYaH2(分离于四川雅安市种植区‘红阳’猕猴桃30°15′N,102°95′E)、ScYbH1 (分离于四川宜宾市种植区‘红阳’猕猴桃 28°76′N,104°40′E)、ScYbH2(分离于四川宜宾市种植区‘红阳’猕猴桃 28°75′N,104°64′E)。
纯化菌株在KB培养基上生长时,呈现为白色、圆形、光滑、微凸起、半透明状菌落,与已测序鉴定的Psa菌株ScMcH[17]具有相同形态学特征,如图1所示。图1中:左侧为Psa菌株ScDjyH2;右侧为Psa菌株ScMcH。
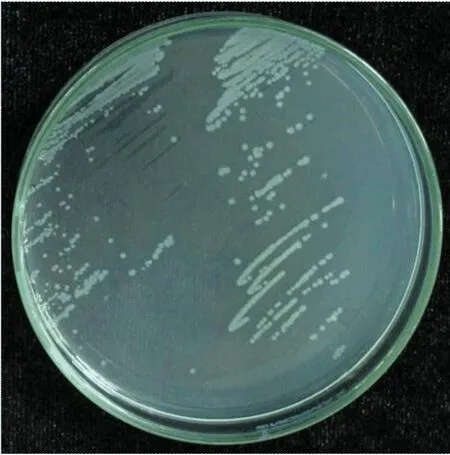
图1 分离菌株在KB培养基生长形态
2.2 分离菌株的PCR鉴定
利用Psa病原菌特异引物Psa-F1、Psa-R2,分别以6个分离菌株的单克隆培养菌液为模板,进行PCR鉴定,结果如图2所示。图2中:M为DNA marker;1~6依次为ScYbH1、ScYbH2、ScMbJ1、ScDjyH2、ScDjyH3、ScYaH2菌落扩增产物;+为正对照,ScMcH菌落扩增产物;-为负对照,未加入Psa的扩增产物。
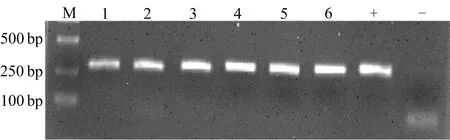
图2 分离菌株的PCR鉴定
从图2可以看出,6个分离菌株均显现阳性扩增片段(约280 bp),片段大小与对照菌株ScMcH相同,而未加入Psa菌液的负对照则未显示扩增条带。
进一步将各分离菌株的PCR扩增产物进行测序,并将所测定序列在NCBI数据库进行Blast比对。结果表明,所分离菌株的序列片段均与已登录Psa菌株具有最高相似性。其中ScDjyH2菌株PCR扩增测序片段的Blast比对结果如图3所示。
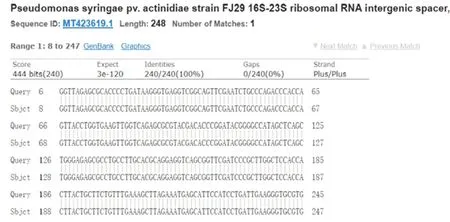
图3 ScDjyH2菌株PCR扩增测序片段的Blast比对
本文所分离的ScDjyH2与已报道的Psa菌株FJ29(中国科学院植物病理学研究室福建省农业科学院植物保护重点实验室分离)的16S-23S ribosomal RNA intergenic spacer序列完全一致。通过分子鉴定可知,所分离6个菌株为丁香假单胞菌猕猴桃致病变种。
2.3 Psa菌株对猕猴桃的致病性检测分析
为检测本实验所分离Psa菌株对宿主猕猴桃的致病能力,分别将6个菌株按1.2.3所述方法制备悬浮菌液后,进行‘红阳’猕猴桃组培幼苗的侵染。约10 d后,ScYbH2侵染的幼苗出现大面积褐色病斑,部分叶片从茎上脱落;ScDjyH2、ScYbH1侵染植株也显现感染症状,叶片有明显病斑;而ScMbJ1、ScDjyH3、ScYaH2侵染猕猴桃与MgCl2溶液处理的对照植株整体表型相似,无明显感染,仅在ScMbJ1侵染植株部分叶片出现小病斑,如图4所示。

图4 Psa菌株侵染‘红阳’猕猴桃组培10 d幼苗
进一步将侵染处理10 d的猕猴桃植株按1.2.3所述方法进行组织取样、研磨及菌落计数,结果如图5所示。
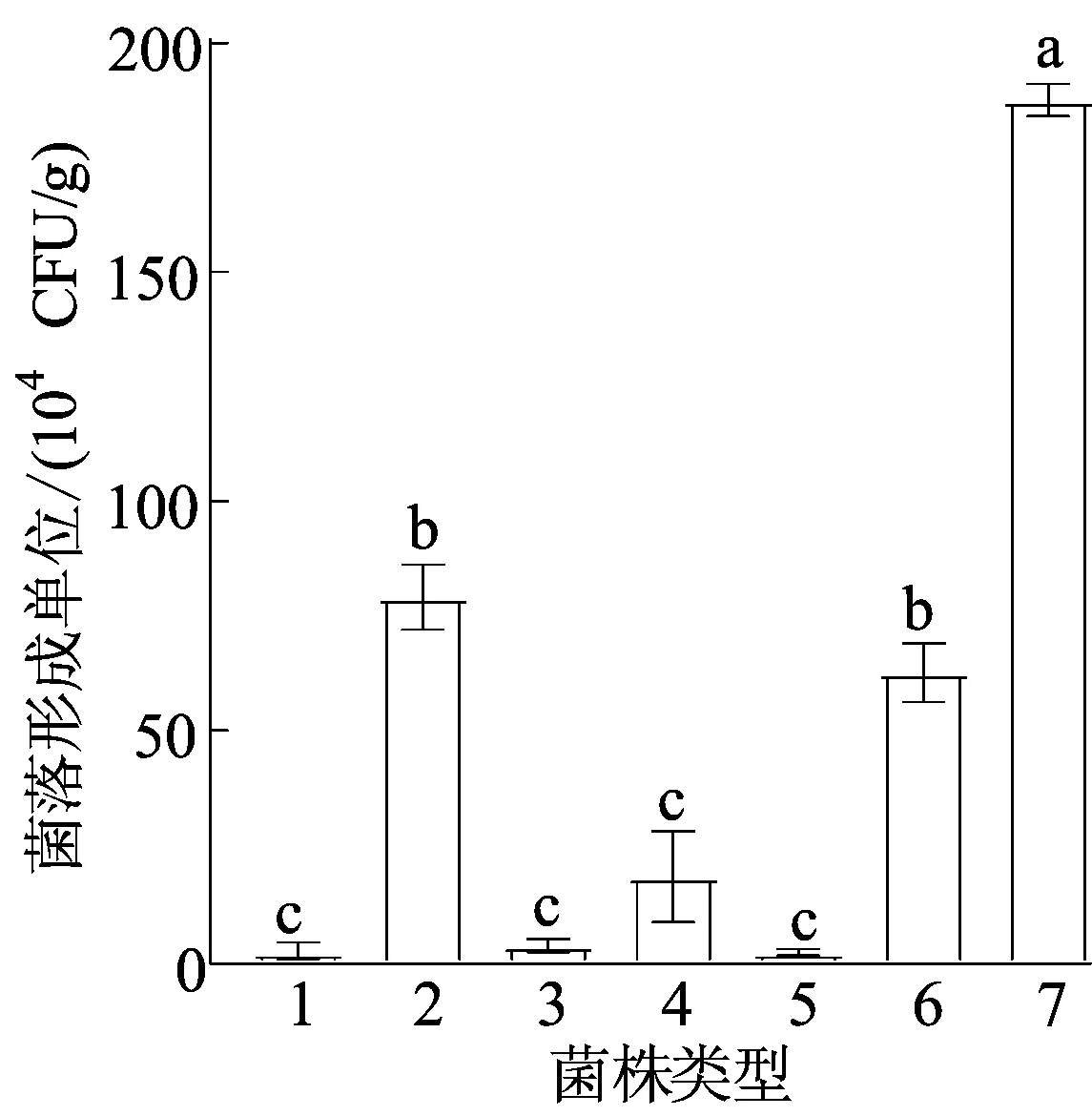
1.MgCl2 2.ScDjyH2 3.ScDjyH3 4.ScMbJ1 5.ScYaH2 6.ScYbH1 7.ScYbH2
从图5可以看出:MgCl2溶液处理植株中未有Psa菌落生长;显示明显病症的ScYbH2、ScDjyH2、ScYbH1侵染植株组织中的Psa菌落数分别为188×104、79×104、63×104CFU/g;ScMbJ1接种植株中Psa菌落数平均值为23×104CFU,而ScDjyH3、ScYaH2接种猕猴桃体内仅检测到很少量病原菌,与对照处理植株无显著性差异。图5中,不同字母表示有显著差异(P<0.05)。
由Psa菌株侵染接种后植株症状及菌落计数结果可知,本实验所分离菌株对宿主猕猴桃显示不同的致病性,其中:ScYbH2、ScDjyH2、ScYbH1具有较强致病性,其致病能力从大到小依次为ScYbH2、ScDjyH2、ScYbH1,后两者致病能力相差不大;ScDjyH3和ScYaH2则为弱致病菌株;ScMbJ1可使侵染植株体内有一定数目的病原菌增殖,具有一定致病性,虽与ScDjyH3和ScYaH2无统计学差异,但仍显现与两者不同。
2.4 Psa菌株的烟草叶片超敏反应
基于病原菌侵染细胞时所释放毒性效应蛋白对植物免疫系统的激活作用,利用烟草叶片系统可以快速检测植物对丁香假单胞病原菌的防御反应[20]。因此,除了如上述接种侵染宿主植物猕猴桃,还可通过将Psa菌液在烟草叶片中进行注射,进一步检测其免疫超敏反应激活能力。
将6个Psa分离菌株、2个对照菌株ScMcH、ScPzH以及MgCl2对照分别制备溶液,在同一烟草叶片上进行注射,观察注射部位植物组织的超敏反应,如图6所示。

1.MgCl2 2.ScPzH 3.ScDjyH3 4.ScYaH2 5.ScYbH2 6.ScDjyH2 7.ScMbJ1 8.ScYbH1 9.ScMcH
从图6可以看出,当注射Psa菌液(1×107CFU) 24 h后,开始在部分菌株的注射部位出现叶片组织坏死,至72 h时,注射接种ScYbH2、ScDjyH2、ScMbJ1的叶片区域显现细胞坏死超敏反应,但ScYbH1、ScDjyH3、ScYaH2未激活超敏反应。当注射菌液菌落数升至5×108CFU,ScYbH1也在72 h出现注射区域细胞坏死,而ScDjyH3、ScYaH2即使在高浓度长反应时间仍未能激活烟草叶片免疫超敏反应。
烟草免疫系统的激活反应状态与病原菌的致病性有一定关联,提示丁香假单胞病原菌是否向感染细胞释放植物可识别的毒性致病因子,从而导致植物激活免疫系统,诱导感染部分细胞坏死超敏反应,限制病原菌的定植与传播。检测结果表明,本实验所分离Psa菌株具有不同的超敏反应激活能力。同时,注射于同一叶片的对照菌株ScPzH、ScMcH分别显示未激活、激活超敏反应表型[17],MgCl2对照注射处理部位也无超敏反应发生,标示烟草叶片免疫超敏反应的稳定性和灵敏性。
3 讨 论
猕猴桃是一种重要的新兴经济作物,由于果实品质优异,随市场需求其种植面积和产量也在不断增加。目前,全世界每年生产(150~160)×104t猕猴桃,其中中国、新西兰和意大利占全球猕猴桃产量的90%[21-22]。我国是猕猴桃属植物的起源分布中心,野生资源丰富,具有独特的育种和栽培优势,也逐渐成为世界主要猕猴桃种植区[3]。但近年来,由Psa导致的溃疡病害已成为世界范围猕猴桃产业发展的主要威胁[23-24],尤其是近期田间新分离Psa菌株已显示对防治溃疡病最常用的铜杀菌剂、链霉素产生抗性,迫切需要研发基于致病机制的新的防治措施。
本文利用不同种植区染病猕猴桃进行Psa病原菌分离纯化与鉴定,获得了6个新的菌株。虽然形态学特征一致,但这些菌株显示了不同的致病能力。在致病性检测中选用中华猕猴桃红果品种‘红阳’的组培幼苗,‘红阳’是我国近年培育的优良红肉品种,但它对溃疡病菌不具抗性。利用幼苗浸泡进行病原接种,操作便捷,并可在较短时间内观察到染病症状,适用于Psa致病性或猕猴桃种质抗性的快速检测。猕猴桃为雌雄异株植物,利用杂交种子获取幼苗时可能会由于授粉雄株不同而导致实生苗遗传背景差异。通过组织培养营养繁殖则可保证实验植物材料的遗传一致性,且组培苗的无菌培养特性,也可避免病原接种实验中其他细菌或真菌的干扰。
在对本文所分离Psa菌株的检测中,ScYbH2、ScDjyH2、ScYbH1显示较强致病性,ScMbJ1具有一定的植株体内增殖能力,而ScDjyH3和ScYaH2则为弱致病菌株。在国外分离的2个弱致病菌株,发现其可能由于丁香假单胞菌Ⅲ型分泌系统调控基因hrpR/hrpS的插入突变,抑制了毒性效应蛋白的表达[25]。本课题组前期在我国猕猴桃种植区鉴定了另一独立突变事件:在hrpR基因内插入1 662 bp 的DNA移动元件,可使其读码框提前终止于插入序列中的终止密码,从而影响病原菌致病力[17]。在本文中,新分离菌株在宿主猕猴桃致病性、烟草免疫超敏反应中的多程度差异表型,提示Psa在快速传播中进化形成了丰富的遗传多样性。其中,分离于都江堰、雅安两地的ScDjyH3、ScYaH2菌株不具有明显的猕猴桃致病性,也不能激活烟草超敏反应;分离于马边彝族自治县的ScMbJ1显示较弱的猕猴桃致病力,但可在低浓度条件下激活烟草超敏反应;而ScYbH1具有较强猕猴桃致病性,但却在较高浓度下才激活烟草超敏反应。这些田间来源不同、表型多样的变异株将为后续溃疡病菌致病基因及其机制研究提供重要基础。

