石墨烯与六方氮化硼导电性差异的理论研究
李晓艳,刘晴,钟雨芙,罗培研,曾艳丽
河北师范大学化学与材料科学学院,石家庄 050024
等电子原理在中学化学和大学化学中均是一个很重要的概念[1],具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,称为等电子原理,满足等电子原理的微粒称为等电子体。等电子体间具有相似的结构和化学键性质,从而具有类似的熔沸点、导电导热性等物理性质[2]。六方氮化硼(h-BN)俗称“白石墨”,是石墨烯的等电子体。实验结果表明,二者均具有六角环状二维蜂窝晶格结构[3–7],其中石墨烯中六个C原子形成正六元环结构,C―C键长为1.42 Å[3–5](1 Å = 0.1 nm),六方氮化硼中B―N键长为1.45 Å[6,7]。从分子轨道理论角度进行分析,石墨烯和h-BN的成键形式类似。层内的每个原子均采用sp2杂化,形成的三个杂化轨道与周围的三个原子结合,形成3个σ键。每个原子均剩余1个p轨道,肩并肩重叠,形成离域π键。离域π键的形成有利于电的传导,因此石墨烯具有良好的导电性。但实验发现,六方氮化硼不导电,为电的绝缘体[8]。为解释二者导电性上存在差异的原因,我们采用量子化学方法结合电子密度拓扑分析等理论对石墨和六方氮化硼这对等电子体的微观结构进行了理论研究,探究了二者电子结构的差异。因C24和B12N12团簇的最稳定构型为非平面结构[9,10],为了研究方便,本文用C24H12作为石墨烯的模型分子,B12N12H12作为六方氮化硼分子的模型。
1 计算方法
使用Gaussian 16程序[11],在B3LYP/6-311+G(d)水平上对C24H12及B12N12H12进行了构型优化。对得到的稳定构型,采用AIMALL程序[12]对其进行“分子中的原子”理论分析,采用Multiwfn程序[13]进行电子定域函数等分析。自然键轨道分析采用Gaussian程序自带的NBO 3.0完成。
2 结果与分析
2.1 构型及轨道分析
优化得到的C24H12和B12N12H12的构型见图1,二者均为平面结构。C24H12具有D6h对称性,B12N12H12属于D3h点群。C24H12和B12N12H12均为六元环状蜂窝结构,其中C24H12中的六元环状结构为正六元环结构,相邻三个C原子间形成的键角为120.0°,计算得到的C―C键键长为1.420 Å。计算得到的B12N12H12中所有的B―N键长均相等,为1.449 Å,键角θ(B―N―B)为120.0°。我们计算得到的构型参数与实验值非常接近,说明我们所选择的计算方法和基组是可靠的。
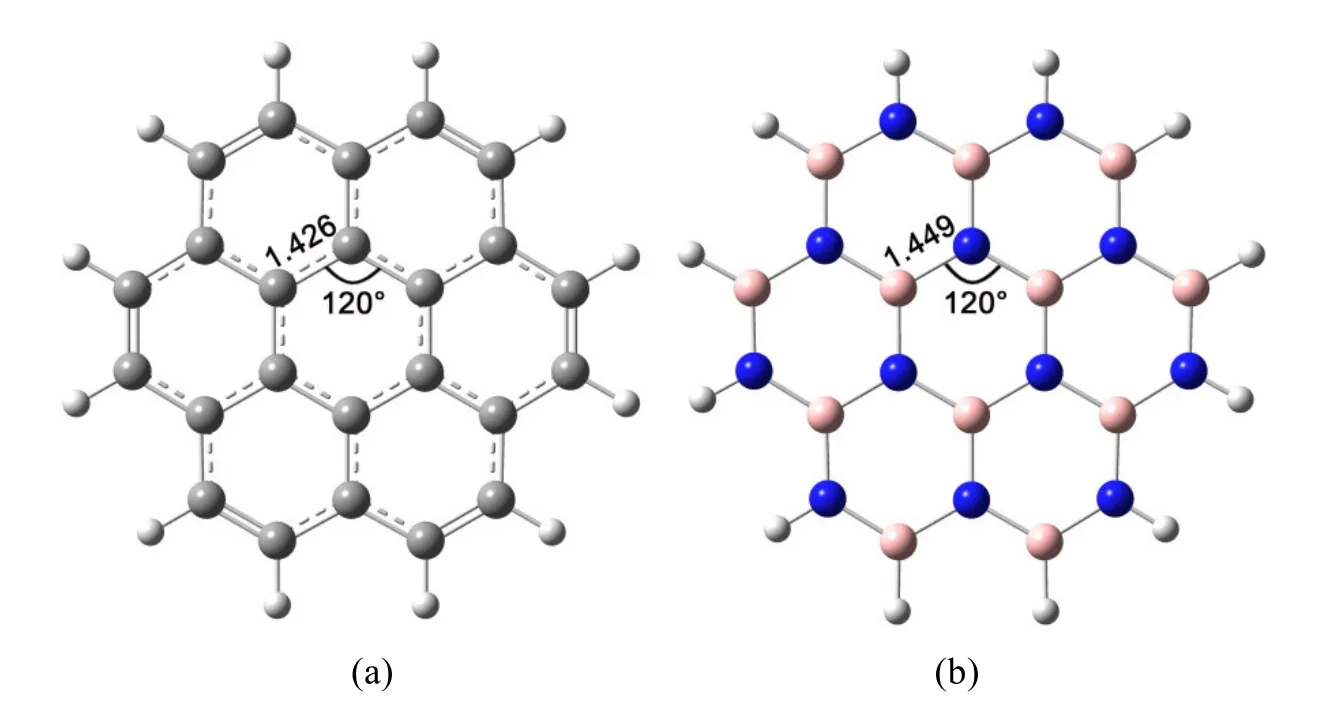
图1 C24H12 (a)和B12N12H12 (b)的平面结构
表1给出C24H12和B12N12H12体系的前线轨道图形和能级。如表1所示,C24H12和B12N12H12体系的前线轨道,最高占据轨道(HOMO)和最低空轨道(LUMO)轨道均为π型分子轨道。其中C24H12的HOMO轨道能级为−0.2118 a.u.,LUMO轨道能级为−0.0645 a.u.,HOMO轨道与LUMO轨道间的能量间隙为0.1473 a.u.。而B12N12H12体系中HOMO轨道能级为−0.2594 a.u.,LUMO轨道能级为−0.0154 a.u.,HOMO轨道与LUMO轨道间的能量间隙大于C24H12体系中HOMO轨道与LUMO轨道间的能量间隙,因此B12N12H12的导电能力比C24H12的导电能力差。
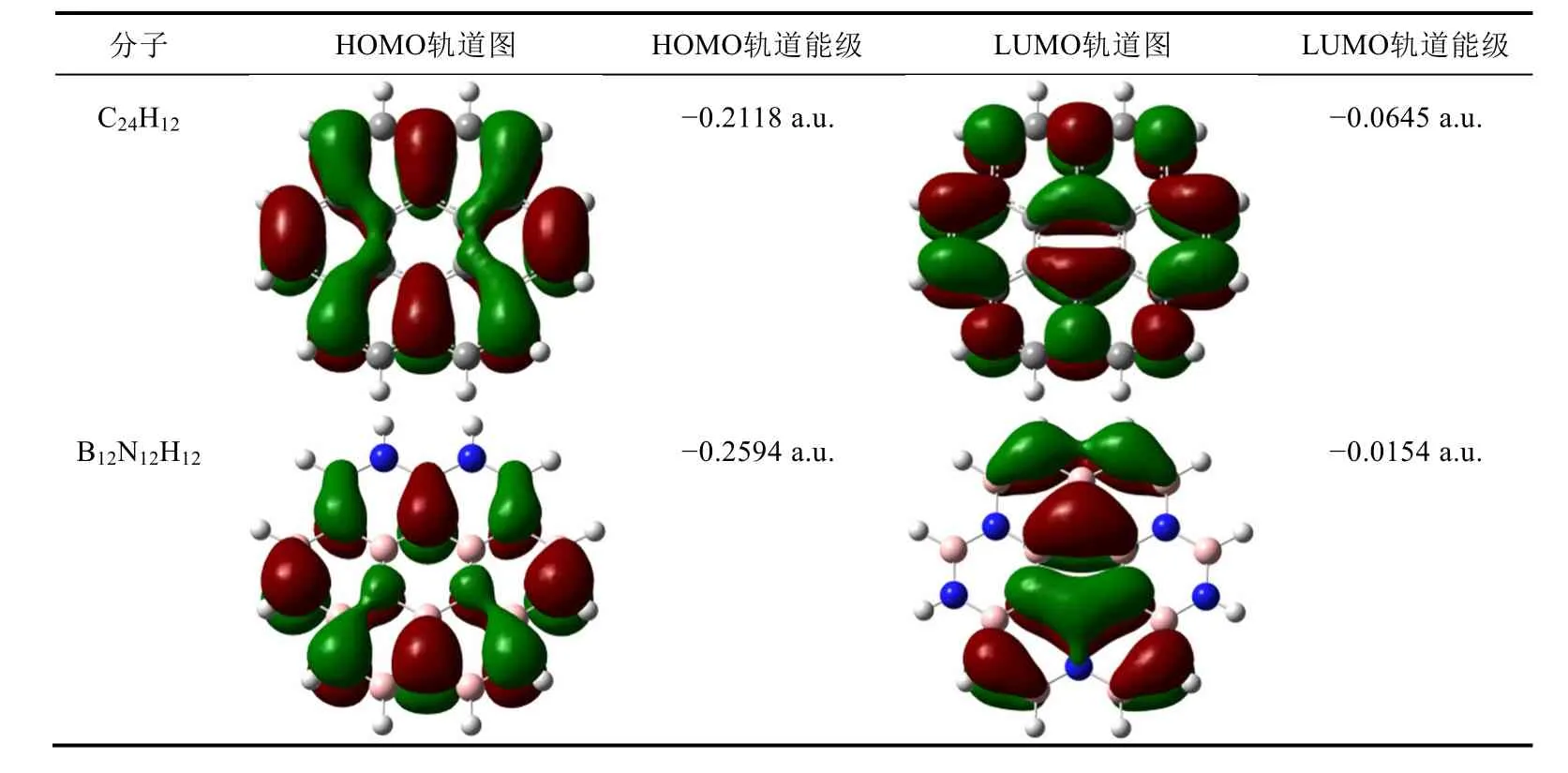
表1 C24H12和B12N12H12体系的前线轨道
图2给出C24H12(a)和B12N12H12(b)的自然键轨道(NBO)图。NBO分析显示,在C24H12和B12N12H12体系中,相邻的两个原子之间具有一个σ自然键轨道和一个π轨道存在。C24H12分子中C原子采用sp2杂化,两个相邻的C原子的sp2杂化轨道“头碰头”重叠形成关于键轴对称的σ轨道。剩余的p轨道“肩并肩”形成π键。在σ和π轨道中,两个C原子的贡献相同,各为50%。B12N12H12体系中相邻的BN间也是由一个σ轨道和一个π轨道组成。σ轨道由B和N原子的sp2杂化轨道组成,其中B原子的贡献为23.1%,N原子的贡献为76.9%。而π型轨道基本上是定域在N原子上的,N原子对π轨道的贡献为90.4%,B原子的贡献仅为9.6%。NBO轨道分析表明,石墨分子的π电子离域性好,容易导电;而B12N12H12体系的π电子主要定域在N原子上,所以h-BN不导电。
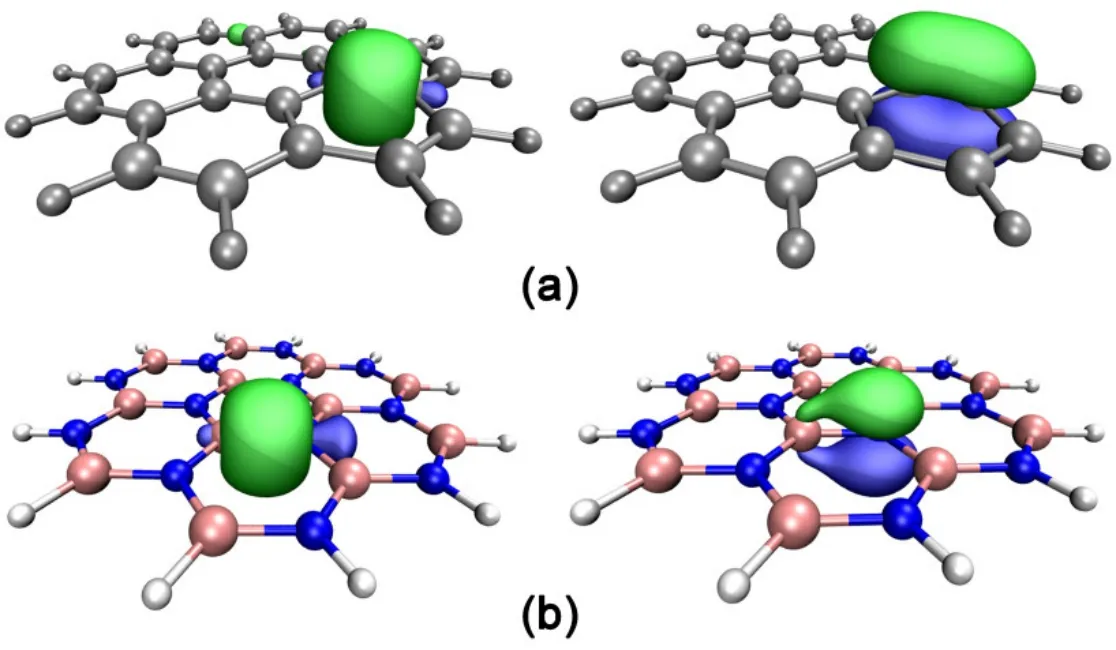
图2 C24H12 (a)和B12N12H12 (b)的NBO轨道图
2.2 电子密度拓扑分析
电子定域函数(ELF)理论是由Becke和Edgecombe[14]提出的用于讨论分子和原子中电子定域程度的物理量。ELF通过分析梯度场可以找到局部极大值和相应的盆(basin)。根据盆的突触级数,可以划分为核basin、价basin和多中心basin等。其中价basin内的电子布居数决定两原子间成键的强度和性质。表2给出C24H12和B12N12H12体系中相邻两原子间价basin内的电子布居数、各原子对该basin的贡献。由表2的数据可以看出,C24H12中C―C键的价域(Valance basin) V(C,C)和B12N12H12中B―N键的V(B,N)内的布居数基本相同,分别为2.60e和2.57e,说明C24H12和B12N12H12体系中相邻C―C键和B―N键的强度大于普通单键。V(C,C)内两个C原子的贡献相同,均为1.30e。结合ELF等值面图(图3a),说明在C24H12体系中,电子处于离域状态,所以石墨是电的良好导体。而B12N12H12中V (B,N)中的2.64e中N贡献很大,为2.35e,而B对V(B,N)的贡献仅为0.29e。结合ELF等值面图(图3b),证实了在B12N12H12中,电子基本上是定域在N原子上,离域性差,所以不导电。
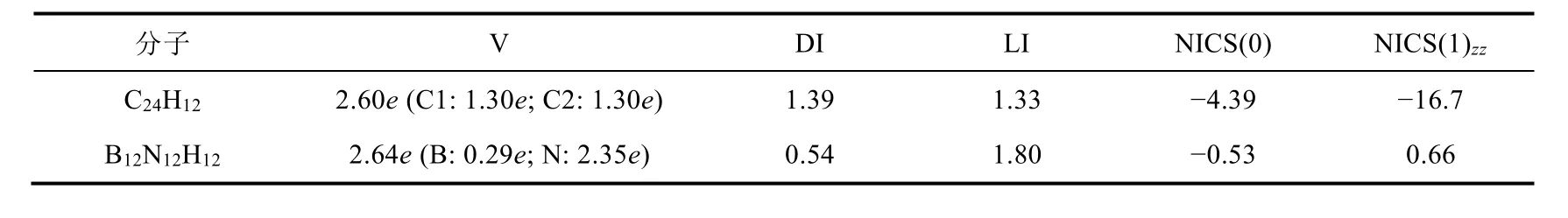
表2 C24H12和B12N12H12中价Basin(V)内的布居数、DI、LI及六元环中心的NICS (ppm)数值
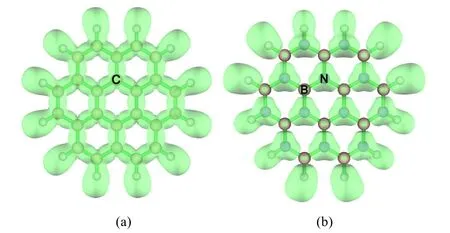
图3 C24H12 (a)和B12N12H12 (b)的ELF等值面图
“分子中的原子”理论(AIM)是Bader等人提出的电子密度拓扑分析理论[15,16]。其中,离域化指数(delocalization index,DI)衡量的是两个特定区域之间共享的电子对数。电子的定域性指数(localization index,LI)描述的是电子的运动被固定在特定空间范围内的程度。在一定空间内,LI越大,电子的定域性越高,说明电子被限制在这个区域内的程度越高。由表2中的数据可以看出,C24H12体系中,离域化指数DI(C,C) = 1.39,数值较大,说明电子在C与C之间的离域较大,所以石墨是电的良好导体。C24H12体系中两个相邻C原子间定域化指数LI(C,C)为1.33,与其盆内布居数2.60相差较大,表明V(C,C)内的电子容易与外界电子发生交换。在B12N12H12中,离域化指数DI(B,N)为0.54,数值较小,说明电子在B与N之间的离域较小。而定域化指数LI(B,N)为1.80,数值较大,电子主要定域在N原子上,因此h-BN不导电。
2.3 核独立化学位移(NICS)和磁感应电流密度(AICD)分析
核独立化学位移(NICS)是衡量环状化合物芳香性的重要指标,也是体系中是否存在环电流的重要体现[17,18]。NICS(0)指的是环中心处的磁屏蔽值的负值,NICS(1)是环上方1 Å处的数值,尤其是垂直于环平面方向的NICS(1)zz,几乎消除了σ轨道影响,可以更好的描述π芳香性[17,18]。表2分别给出了C24H12和B12N12H12体系中六元环中心处的NICS(0)和NICS(1)zz值。其中,C24H12体系NICS(0)和NICS(1)zz均为负值,说明C24H12具有π芳香性。即C24H12体系中具有π环电流的存在,所以石墨是电的良好导体。而B12N12H12体系的NICS(0)基本等于0,而NICS(1)zz为正值。说明B12N12H12为芳香性,不具有环电流,所以不导电。
磁感应电流密度(AICD)分析是用来描述体系离域化程度的等值面图[19,20]。一般来说,如果体系中电子在整体或者某个部分有很强的离域性,当外加一个垂直于分子平面的磁场时,在相应区域会产生一圈显著的感应环形电流。由图4给出的AICD图可以看出,C24H12分子的总电子环电流图和π电子环电流图中可以看到有明显的感应环电流存在,证实C24H12分子中的π电子是离域的。而B12N12H12体系中未形成明显的环电流,说明B12N12H12的电子是定域的,不导电。
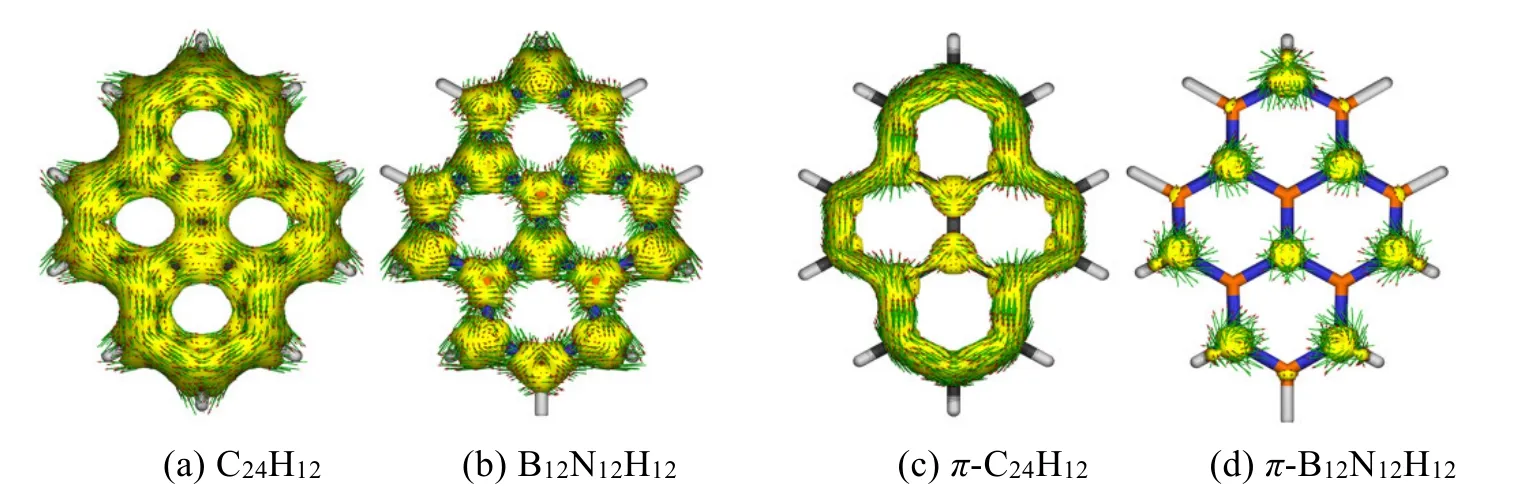
图4 C24H12和B12N12H12的总电子环电流(a, b)和π电子环电流(c, d)图
3 结语
通过对C24H12和B12N12H12体系的量子化学计算结果,结合分子轨道、自然键轨道、分子中原子理论、电子定域函数、核独立化学位移和磁感应电流密度等分析。石墨中存在离域大π键,HOMO和LUMO轨道间的能级差小,π电子在整个分子体系内离域,具有明显的π芳香特征,并形成显著的磁感应环电流,因此石墨是电的良好导体。B12N12H12中的π电子基本上定域在N原子处,未形成明显的环电流,HOMO和LUMO轨道间的能级差大,所以h-BN不导电。研究结果有助于从微观角度更好地认识石墨和六方氮化硼导电性的差异,并且加深学生对等电子体、定域、离域π键等基本概念的理解。

