基于Klotho/血管紧张素Ⅱ1型受体信号通路探讨大蒜素对盐敏感性高血压模型大鼠肾脏的影响
赵伟,张瑶,2,唐荣杰,2,霍迎新,2,廉秋芳,2
作者单位:1.712000 陕西省咸阳市,延安大学咸阳医院心血管内科 2.716000 陕西省延安市,延安大学医学院
肾脏在维持血压稳定方面发挥着重要作用,且长期血压负荷值偏高会造成肾脏损伤[1]。盐敏感性高血压(salt sensitive hypertension,SSH)是一种特殊类型的高血压,研究发现,与原发性高血压病(essential hypertension,EH)相比,SSH患者肾脏损伤更为严重,分析其原因为高盐摄入所致血压升高及高盐本身均可导致肾脏损伤[2]。目前,临床上阻止或逆转SSH患者肾脏损伤的方法仍然有限。大蒜素是大蒜中的主要生物活性物质。现代研究表明,大蒜素具有广泛的药理活性,其对肠道菌群紊乱、血脂代谢异常、癌症等具有一定治疗作用[3-5]。近年来大蒜素作为一种肾脏保护药物备受关注,研究表明,补充外源性大蒜素能有效减轻肾缺血再灌注损伤模型大鼠肾脏损伤、局部炎症损伤及氧化应激损伤,减少肾脏细胞凋亡,进而改善肾功能[6];此外,大蒜素还能抑制慢性肾衰竭模型大鼠炎症相关信号通路,降低炎症因子水平,减轻肾脏纤维化,进而保护肾功能[7]。基于此,本研究基于Klotho/血管紧张素Ⅱ 1型受体(angiotensin Ⅱ type 1 receptor,AT1R)信号通路探讨大蒜素对SSH模型大鼠肾脏的影响,以期为SSH药物研发提供理论参考。
1 材料与方法
1.1 实验时间
本实验时间为2022年2—6月。
1.2 实验动物
健康SPF级Dahl盐敏感大鼠24只,雄性,8周龄,体质量200~250 g,购自北京维通利华实验动物技术有限公司。饲养环境:温度(22±2)℃,相对湿度(55±2)%,12 h光照/12 h黑暗交替进行,自由饮食和摄水。将24只Dahl盐敏感大鼠随机分为正常盐组、高盐组和高盐+大蒜素组,每组8只。动物实验方案经延安大学医学院动物伦理委员会审核批准(编号:2021-41)。
1.3 主要实验药物、试剂及仪器
(1)药物:大蒜素购自上海创赛科技有限公司(纯度≥98%,生产批号:PA02571)。(2)试剂:尿蛋白定量测试盒(货号:C035-2-1)、血肌酐测定试剂盒(货号:C011-2-1)均购自南京建成生物工程研究所有限公司,HE染色试剂盒(货号:C0105S)购自上海碧云天生物技术有限公司,Masson染色试剂盒(货号:B1130)购自北京普利莱基因技术有限公司,丙二醛检测试剂盒(CEA597Ge 96T)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(SES134Ra 96T)、谷胱甘肽(glutathione,GSH)检测试剂盒(CEA294Ge 96T)购自博奥派克生物科技有限公司,Klotho抗体(货号:DF10309)购自Affinity Biosciences公司,AT1R抗体(货号:ab124734)购自Abcam公司,TRIzol(货号:10296028)、SuperScriptⅢ逆转录试剂盒(11752050)、PCR mix(4472920)购自Invitrogen公司,BCA蛋白质定量试剂盒(型号:MD913053)、SDS-PAGE凝胶配制试剂盒(型号:MD911919)购自北京百奥思科生物医学技术有限公司。(3)仪器:多参数监护仪(型号:PM-9000GTA)购自湖南瑞博科技有限公司,酶标仪(型号:Model 550)购自Bio-Rad公司,化学发光成像仪(型号:chemiscope 6100)购自上海勤翔科学仪器有限公司,荧光定量PCR仪(型号:StepOne Software)购自Applied Biosystems公司,电泳仪(型号:EPS 300)购自Bio-Rad公司,凝胶成像仪(型号:2500)购自Bio-Rad公司,凝胶成像系统(型号:GelDoc-It310)购自上海巴玖实业有限公司,化学发光成像系统(型号:170-8280)购自Bio-Rad公司。
1.4 干预方法
正常盐组大鼠给予0.3%氯化钠饲料喂养。高盐组和高盐+大蒜素组大鼠制备SSH模型,具体如下:参考文献[8],采用8%氯化钠饲料喂养大鼠,在此基础上,高盐+大蒜素组大鼠给予大蒜素16 mg/kg,口服。三组大鼠均干预4周。大鼠尾动脉收缩压升高且发生肾脏纤维化提示造模成功。
1.5 观察指标
1.5.1 尾动脉收缩压
干预前及干预1、2、3、4周的同一时间,采用多参数监护仪测量大鼠平静状态下尾动脉收缩压,每只大鼠连续测量3次,取平均值。
1.5.2 肾功能指标
干预4周后对大鼠进行称重并采用代谢笼收集其24 h尿液,严格按照尿蛋白定量测试盒操作说明书检测尿蛋白;之后采用10%水合氯醛腹腔注射麻醉大鼠,取5 ml腹主动脉血,3 500~4 000 r/min离心10 min(离心半径8 cm),分离血清,严格按照血肌酐测定试剂盒操作说明书检测血肌酐水平。之后摘取大鼠双肾并称重,计算肾脏重量/体质量(kindey weight/body weight,KW/BW)比值。
1.5.3 肾组织病理学改变
干预4周后,取大鼠适量左肾组织,采用4%多聚甲醛溶液固定,然后洗涤、脱水,根据HE染色及Masson染色试剂盒说明书进行操作,脱水、透明、封固后在光镜下观察肾组织病理学改变。
1.5.4 氧化应激指标
干预4周后,采用酶联免疫吸附试验检测大鼠肾组织丙二醛、SOD、GSH水平,具体如下:取大鼠适量右肾组织,根据丙二醛、SOD、GSH检测试剂盒操作说明书检测肾组织丙二醛、SOD、GSH水平。实验独立进行3次。
1.5.5 Klotho、AT1R表达水平
干预4周后,采用免疫组化染色法检测大鼠肾组织Klotho、AT1R表达水平,具体如下:将肾脏组织进行石蜡包埋,切割5 μm石蜡切片并固定于60 ℃恒温箱中,在水中采用二甲苯和梯度乙醇溶液脱蜡,采用枸橼酸钠缓冲液修复。采用PBS洗涤3次,每次持续3 min。加入已稀释的一抗并于4 ℃环境下过夜,采用PBS洗涤后再次添加二抗,并在37 ℃环境下孵育30 min。通过光学显微镜观察Klotho、AT1R表达水平。
1.5.6 Klotho、AT1R mRNA相对表达量
干预4周后,采用RT-qPCR法检测大鼠肾组织Klotho、AT1R mRNA相对表达量,具体如下:取适量右肾组织并置于液氮中研磨,使用TRIzol提取总RNA,分别在260、280 nm波长处测定RNA溶液的吸光度。取适量RNA溶液按照SuperScript Ⅲ逆转录试剂盒将RNA合成cDNA,然后对cDNA进行PCR,以β-actin为内参。RT-qPCR引物序列见表1。PCR条件:95 ℃持续5 min,然后进行40次扩增循环(95 ℃ 10 s,58 ℃ 20 s,72 ℃20 s)。反应体系包括2 μl cDNA、6 μl ddH2O、10 μl PCR mix、1 μl正向引物和1 μl反向引物。目的基因mRNA相对表达量=2-(ΔCt目的基因-ΔCt参照基因)。实验独立进行3次。
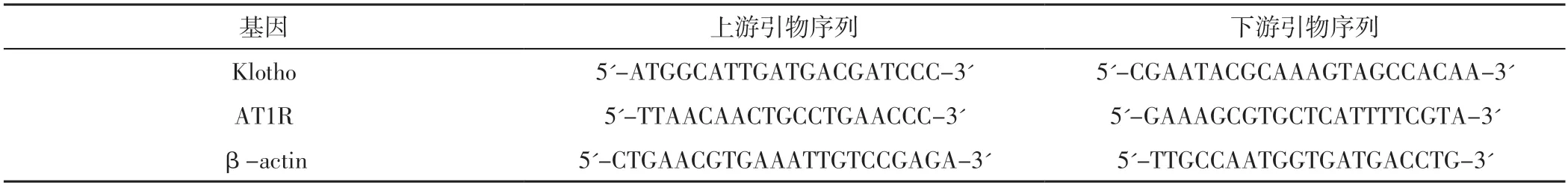
表1 RT-qPCR引物序列Table 1 RT-qPCR primer sequences
1.5.7 Klotho、AT1R蛋白相对表达量
干预4周后,采用Western blot法检测肾组织Klotho、AT1R蛋白相对表达量,具体如下:将肾小管上皮细胞与裂解液在冰上孵育15 min,12 000 r/min离心10 min(离心半径6.2 cm),收集上清液。采用BCA蛋白质定量试剂盒检测细胞上清液中蛋白浓度,绘制标准曲线。通过SDS-PAGE凝胶配制试剂盒分离蛋白质,然后转移到PVDF膜上;采用1×TBST配置的3%脱脂牛奶封闭液封闭1 h,然后将PVDF膜放一抗孵育过夜;采用1×TBST浸泡10 min后弃掉1×TBST,重复3次。将PVDF膜放入二抗孵育2 h;采用1×TBST浸泡10 min后弃掉1×TBST,重复3次。采用发光液浸湿PVDF膜后将其置于化学发光成像系统进行显影,采用Image J软件分析目的蛋白条带灰度值,以目的蛋白条带灰度值/参照蛋白灰度值表示目的蛋白相对表达量。实验独立进行3次。
1.6 统计学方法
应用GraphPad Prism 8.0.2软件进行数据处理。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey检验。以P<0.05为差异有统计学意义。
2 结果
2.1 尾动脉收缩压
高盐组和高盐+大蒜素组大鼠均造模成功。干预前,三组大鼠尾动脉收缩压比较,差异无统计学意义(P>0.05);干预1、2、3、4周,三组大鼠尾动脉收缩压比较,差异有统计学意义(P<0.05)。干预1周,高盐组大鼠尾动脉收缩压高于正常盐组,差异有统计学意义(P<0.05);干预2、3、4周,高盐组大鼠尾动脉收缩压高于正常盐组,高盐+大蒜素组大鼠尾动脉收缩压低于高盐组,差异有统计学意义(P<0.05),见表2。
表2 三组大鼠干预前后尾动脉收缩压比较(±s,mmHg,n=8)Table 2 Comparison of tail artery systolic blood pressure among the three groups of rats before and after intervention
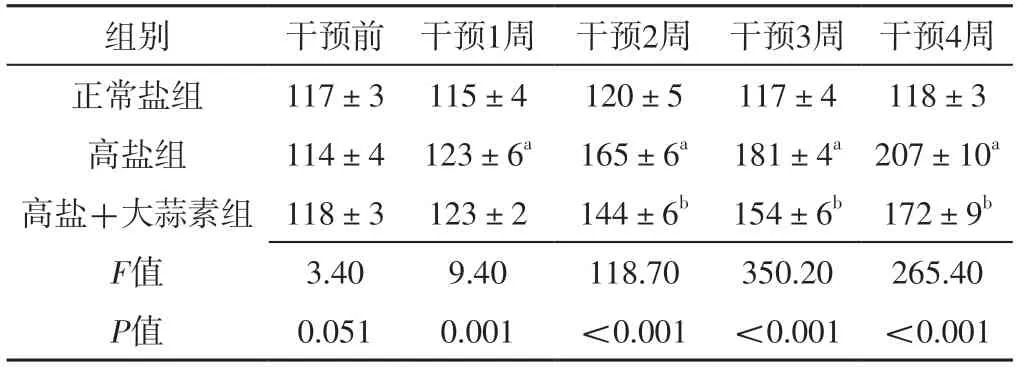
表2 三组大鼠干预前后尾动脉收缩压比较(±s,mmHg,n=8)Table 2 Comparison of tail artery systolic blood pressure among the three groups of rats before and after intervention
注:a表示与正常盐组比较,P <0.05;b表示与高盐组比较,P<0.05;1 mmHg=0.133 kPa。
组别干预前 干预1周 干预2周 干预3周 干预4周正常高盐组117±3 115±4120±5117±4 118±3盐组114±4 123±6a 165±6a 181±4a 207±10a高盐+大蒜素组 118±3 123±2144±6b 154±6b 172±9b F值3.409.40118.70350.20265.40 P值0.0510.001<0.001 <0.001 <0.001
2.2 肾功能指标
干预4周后,三组大鼠尿蛋白、血肌酐、KW/BW比值比较,差异有统计学意义(P<0.05);干预4周后,高盐组大鼠尿蛋白、血肌酐、KW/BW比值高于正常盐组,高盐+大蒜素组大鼠尿蛋白、血肌酐、KW/BW比值低于高盐组,差异有统计学意义(P<0.05),见表3。
表3 三组大鼠干预4周后肾功能指标比较(±s,n=8)Table 3 Comparison of renal function indexes among the three groups of rats at 4 weeks after intervention

表3 三组大鼠干预4周后肾功能指标比较(±s,n=8)Table 3 Comparison of renal function indexes among the three groups of rats at 4 weeks after intervention
注:KW/BW=肾脏重量/体质量;a表示与正常盐组比较,P<0.05;b表示与高盐组比较,P<0.05。
组别尿蛋白(mg/L) 血肌酐(μmol/L) KW/BW比值正常盐组5.50±1.1624.14±0.810.66±0.06高盐组高盐+大蒜素13.67±1.18a43.02±0.88a1.19±0.19a组9.21±0.96b29.83±0.76b0.88±0.12b F值109.901 124.0031.30 P值<0.001<0.001<0.001
2.3 肾组织病理学改变
HE染色结果显示,正常盐组大鼠肾小球与肾小管结构清晰,形态正常;与正常盐组相比,高盐组大鼠肾小球囊腔增大且轮廓不规则,肾小球基底膜增厚,肾小管上皮细胞肥大,呈空泡变性,肾间质伴有炎性细胞浸润;与高盐组相比,高盐+大蒜素组大鼠肾组织病理损伤相对减轻,局部可见少量炎性细胞浸润,见图1。Masson染色结果显示,与正常盐组相比,高盐组视野内观察到大量胶原纤维沉积,肾组织纤维化严重;与高盐组相比,高盐+大蒜素组大鼠肾组织纤维化明显减轻,见图2。
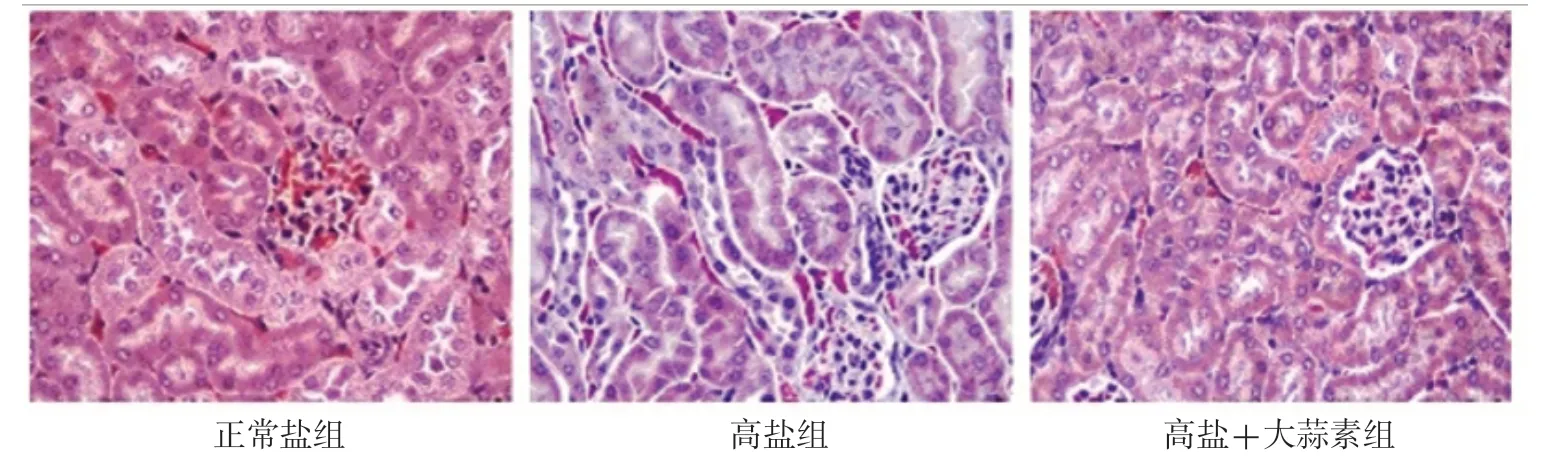
图2 三组大鼠肾组织Masson染色结果(×400)Figure 2 Masson staining results of renal tissue among the three groups of rats
2.4 氧化应激指标
干预4周后,三组大鼠肾组织丙二醛、SOD、GSH水平比较,差异有统计学意义(P<0.05);干预4周后,高盐组大鼠肾组织丙二醛水平高于正常盐组,肾组织SOD、GSH水平低于正常盐组,差异有统计学意义(P<0.05);干预4周后,高盐+大蒜素组肾组织丙二醛水平低于高盐组,肾组织SOD、GSH水平高于高盐组,差异有统计学意义(P<0.05),见表4。
表4 三组大鼠干预4周后肾组织氧化应激指标比较(±s,n=3)Table 4 Comparison of oxidative stress indexes of renal tissue among the three groups of rats at 4 weeks after intervention
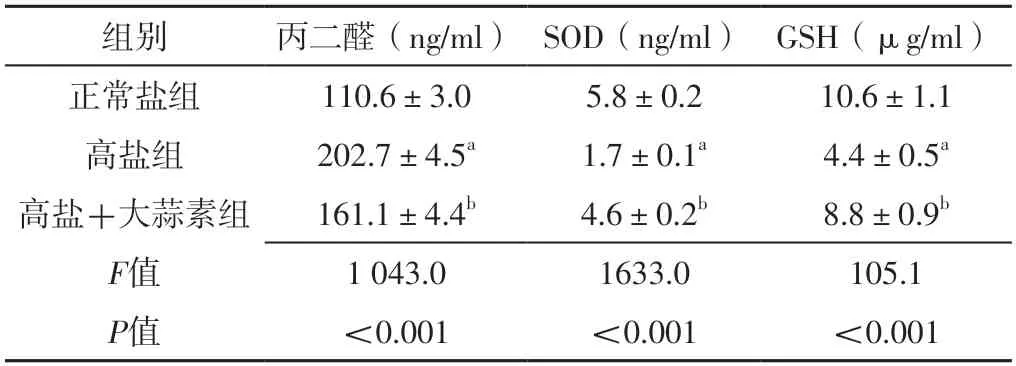
表4 三组大鼠干预4周后肾组织氧化应激指标比较(±s,n=3)Table 4 Comparison of oxidative stress indexes of renal tissue among the three groups of rats at 4 weeks after intervention
注:SOD=超氧化物歧化酶,GSH=谷胱甘肽;a表示与正常盐组比较,P<0.05;b表示与高盐组比较,P<0.05。
组别丙二醛(ng/ml) SOD(ng/ml) GSH(μg/ml)正常盐组110.6±3.05.8±0.210.6±1.1高盐组盐+大蒜素202.7±4.5a1.7±0.1a4.4±0.5a高组161.1±4.4b4.6±0.2b8.8±0.9b F值1 043.01633.0105.1 P值<0.001<0.001<0.001
2.5 Klotho、AT1R表达水平及其mRNA、蛋白相对表达量
干预4周后,三组大鼠肾组织Klotho、AT1R表达水平及其mRNA、蛋白相对表达量比较,差异有统计学意义(P<0.05);干预4周后,高盐组大鼠肾组织Klotho表达水平及其mRNA、蛋白相对表达量低于正常盐组,AT1R表达水平及其mRNA、蛋白相对表达量高于正常盐组,差异有统计学意义(P<0.05);干预4周后,高盐+大蒜素组大鼠肾组织Klotho表达水平及其mRNA相对表达量、蛋白高于高盐组,AT1R表达水平及其mRNA、蛋白相对表达量低于高盐组,差异有统计学意义(P<0.05),见表5、图3~4。
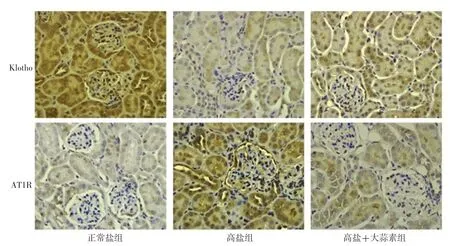
图3 三组大鼠免疫组化染色结果(×400)Figure 3 Results of immunohistochemical staining among the three groups of rats

图4 Western blot法检测三组大鼠Klotho、AT1R蛋白相对表达量的SDS-PAGE图Figure 4 SDS-PAGE diagram of relative expression of Klotho,AT1R protein detected by Western blot method among the three group of rats
表5 三组大鼠干预4周后肾组织Klotho、AT1R表达水平及其mRNA、蛋白相对表达量比较(±s,n=3)Table 5 Comparison of expression level,mRNA relative expression,protein relative expression of Klotho and AT1R of renal tissue among the three groups of rats at 4 weeks after intervention

表5 三组大鼠干预4周后肾组织Klotho、AT1R表达水平及其mRNA、蛋白相对表达量比较(±s,n=3)Table 5 Comparison of expression level,mRNA relative expression,protein relative expression of Klotho and AT1R of renal tissue among the three groups of rats at 4 weeks after intervention
注:a表示与正常盐组比较,P<0.05;b表示与高盐组比较,P<0.05。
组别Klotho表达水平AT1R表达水平Klotho mRNA相对表达量 AT1R mRNA相对表达量Klotho蛋白相对表达量AT1R蛋白相对表达量正常盐组0.32±0.020.23±0.031.03±0.091.04±0.080.92±0.010.32±0.02高盐组0.21±0.05a0.39±0.08a0.51±0.06a1.63±0.09a0.37±0.03a0.83±0.04a高盐+大蒜素组 0.29±0.02b0.26±0.02b0.82±0.10b1.28±0.06b0.59±0.02b0.65±0.03b F值10.968.6327.9643.99471.20201.50 P值0.0090.017<0.001<0.001<0.001<0.001
3 讨论
高血压是慢性肾脏病(chronic kidney disease,CKD)的主要原因,仅次于糖尿病,是加剧患者CKD患者肾功能恶化的重要因素[9]。众所周知,饮食习惯与高血压的发病密切相关,尤其是高盐饮食。研究表明,高达50%的EH为高盐引起,其被称为SSH[10]。研究表明,天然植物化合物(natural plant compounds,NPC)在高血压及其靶器官损伤的治疗中发挥着重要作用[11-12]。在临床研究中,几种NPC已被证明具有肾脏保护作用,其主要通过激活抗氧化防御系统及抑制促炎信号通路而改善肾脏病患者预后[13]。因此,本研究以NPC为切入点,基于Klotho/AT1R信号通路探讨大蒜素对SSH模型大鼠肾功能的影响。
本研究结果显示,干预1周,高盐组大鼠尾动脉收缩压高于正常盐组;干预2、3、4周,高盐组大鼠尾动脉收缩压高于正常盐组,高盐+大蒜素组大鼠尾动脉收缩压低于高盐组;干预4周后,高盐组大鼠尿蛋白、血肌酐、KW/BW比值高于正常盐组,高盐+大蒜素组大鼠尿蛋白、血肌酐、KW/BW比值低于高盐组。HE染色结果显示,与正常盐组相比,高盐组大鼠肾小球基底膜增厚,肾小管上皮细胞肥大,呈空泡变性,肾间质伴有炎性细胞浸润;与高盐组相比,高盐+大蒜素组大鼠肾组织病理损伤相对减轻,局部可见少量炎性细胞浸润。Masson染色结果显示,与正常盐组相比,高盐组视野内观察到大量胶原纤维沉积,肾组织纤维化严重;与高盐组相比,高盐+大蒜素组大鼠肾组织纤维化明显减轻。提示高盐饮食喂养Dahl盐敏感大鼠可成功制备SSH模型,且SSH模型大鼠伴有肾组织损伤、胶原纤维沉积及肾功能降低,而补充大蒜素能有效降低SSH模型大鼠收缩压,减轻其肾组织损伤、胶原纤维沉积,改善其肾功能。LIU等[14]研究发现,大蒜素可有效降低自发性高血压模型大鼠血压,并通过抑制钙调蛋白激酶Ⅱ/核因子κB信号通路而保护大鼠血管和心脏,提示大蒜素对血压升高引起的靶器官损伤具有一定治疗作用。此外,大蒜素还对不同原因肾功能损伤具有保护作用,如其能保护肾组织免受环孢素A引起的肾毒性与氧化应激损伤,进而减少肾小管萎缩和坏死[15]。再者,大蒜素对血压和肾功能的影响与氯沙坦相当[16]。
氧化应激损伤是活性氧(reactive oxygen species,ROS)产生的一种负面作用,其是导致多种疾病的重要因素,其中肾脏特别容易受到氧化还原失衡和氧化应激损伤的影响[17]。研究报道,高盐喂食Dahl盐敏感大鼠能够诱导肾脏髓质中ROS含量增加,但不影响大脑中ROS含量,提示高盐饮食介导的氧化应激损伤与肾脏密切相关[18];此外,血压升高可通过直接或间接作用促进肾脏ROS表达增加[19]。丙二醛可以反映氧自由基含量、脂质过氧化水平及氧自由基对肾组织的损伤程度。SOD和GSH作为主要抗氧化酶,在清除氧自由基方面发挥了至关重要的作用,其活性可以反映肾脏清除氧自由基和抵抗脂质过氧化的能力。本研究结果显示,干预4周后,高盐+大蒜素组肾组织丙二醛水平低于高盐组,肾组织SOD、GSH水平高于高盐组,提示SSH模型大鼠存在氧化应激损伤,而大蒜素能有效减轻其氧化应激损伤。
Klotho蛋白作为一种抗衰老蛋白,与肾脏及肾脏疾病有关。一方面,Klotho蛋白主要在肾脏远曲小管表达[20];另一方面,肾脏病发病过程中伴随Klotho蛋白水平下降,且补充Klotho蛋白能缓解甚至逆转多种因素造成的肾脏损伤[21]。此外,Klotho蛋白能抑制肾脏氧化应激损伤,其缺乏已被证明会增加内源性ROS的生成,并加剧氧化应激损伤[22];相反,外源性补充Klotho可有效增强机体抗氧化防御能力,下调ROS表达水平,进而减轻氧化应激损伤[23]。本课题组前期研究发现,Klotho蛋白能与AT1R结合,进而抑制AT1R表达及其介导的氧化应激损伤,且对高盐诱导的肾细胞损伤具有保护作用[24]。本研究结果显示,干预4周后,高盐组大鼠肾组织Klotho表达水平及其mRNA、蛋白相对表达量低于正常盐组,AT1R表达水平及其mRNA、蛋白相对表达量高于正常盐组;干预4周后,高盐+大蒜素组大鼠肾组织Klotho表达水平及其mRNA、蛋白相对表达量高于高盐组,AT1R表达水平及其mRNA、蛋白相对表达量低于高盐组;提示SSH模型大鼠Klotho蛋白表达下调,AT1R表达上调,肾脏氧化应激损伤加重;而补充大蒜素能有效上调Klotho蛋白表达,抑制AT1R表达,进而减轻肾脏氧化应激损伤,表明大蒜素对SSH模型大鼠的肾脏保护作用与其调控Klotho/AT1R信号通路、减轻肾脏氧化应激损伤相关。
4 结论
综上所述,大蒜素能有效改善SSH模型大鼠肾功能,减轻其肾组织损伤、胶原纤维沉积及肾脏氧化应激损伤,其机制可能与大蒜素调控Klotho/AT1R信号通路有关。
作者贡献:赵伟进行文章的构思与设计,并撰写论文;张瑶进行结果的分析与解释;赵伟、唐荣杰、霍迎新进行实验实施;张瑶、霍迎新进行数据整理;赵伟、廉秋芳进行论文修订;廉秋芳进行文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

