薰衣草高效快繁体系的探究
张钰茜 王爱凡 李雪龙 冷晓宇 苏秀娟

摘 要:通过植物组织培养技术,以筛选出薰衣草快速繁殖的最优培养条件。以2个品种薰衣草品种法国蓝和太空蓝的种子为外植体,对外植体的消毒方式、增殖分化和生根培养的最适培养基和激素配比进行研究分析。结果表明:法国蓝与太空蓝种子萌发率最高、污染率最低的处理方式分别为10% NaClO 15~20 min和10% H2O25 min;当GA3濃度为600 mg·L-1时,法国蓝和太空蓝浸种时间分别为16 h和24 h时,种子的萌发率最高。法国蓝和太空蓝的最佳增殖分化培养基分别为MS+0.1 mg·L-1NAA+0.2 mg·L-1TDZ,MS+0.05 mg·L-1NAA+0.2 mg·L-1TDZ。法国蓝和太空蓝最佳生根培养基均为1/2 MS+0.2 mg·L-1NAA。本研究建立了薰衣草快速繁殖体系,为薰衣草优良种质的快速繁殖、扩大培养、推广应用提供技术性参考。
关键词:薰衣草;赤霉素(GA3);增殖分化;生根;快速繁殖
中图分类号:S573+.9 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2024.01.003
The Study on Efficient Rapid Propagation System of Lavender
ZHANG Yuqian1, 2, WANG Aifan1, 2, LI Xuelong1, 2, LENG Xiaoyu1, 2, SU Xiujuan1, 2
(1 .College of Agriculture, Xinjiang Agricultural University, Urumqi, Xinjiang 830052,China; 2. Lavender Institute of Xinjiang Agricultural University / Key Laboratory of Crop Genetic Improvement and Germplasm Innovation, Urumqi, Xinjiang 830052, China)
Abstract:The purpose of this study was to screen out the optimal culture conditions for rapid propagation of lavender by plant tissue culture technology.The seeds of two lavender varieties French Blue and Space Bluewere used as explants to study and analyze the disinfection methods of explants, the optimal medium and the ratio of hormones for proliferation, differentiation and rooting culture. The results showed that the treatment methods with the highest germination rate and the lowest contamination rate of French Blue and Space Blue seeds were 10% NaClO 15-20 min and 10% H2O25 min, respectively. When the gibberellin (GA3) concentration was 600 mg·L-1, the germination rate of French Blue and Space Bluewas the highest after soaking seed for 16 h and 24 h, respectively. The best proliferation and differentiation medium ofFrench Blue was MS+0.1 mg·L-1NAA+0.2 mg·L-1TDZ, and MS+0.05 mg·L-1NAA+0.2 mg·L-1TDZ was the optimal proliferation and differentiation medium for Space Blue. The best rooting medium of French Blue and Space Blue was 1/2MS+0.2 mg·L-1NAA. In this study, a rapid propagation system of lavender was established, which could provid a technical foundation for the rapid propagation, culture expanding, popularizing and application of fine germplasms of lavender.
Key words: lavender; gibberellin (GA3); proliferation and differentiation ; rooting ; rapid reproduction
薰衣草(Lavandula angustifolia Mill.)为唇形科薰衣草属的多年生草本植物[1],其根系发达,性喜干燥、耐寒、耐干旱性强。薰衣草花期通常在6—8月,花、叶片、茎上有白色绒毛和油腺,油腺破裂可散发香味[2]。薰衣草精油被广泛应用于化妆品、香水中[3]。研究表明,薰衣草精油对杀虫、抑菌、抗氧化活性有抑制作用[4],对病理学疼痛有缓解作用[5],且能改善睡眠质量[6]。此外,薰衣草在风景园林观赏[7]、医疗保健、食品[8]等领域都开展了广泛的研究和应用。新疆与天然香料生产大国法国同处30~45 °N,气候环境适合香料作物的生长,是世界三大薰衣草产地之一。新疆薰衣草主要分布在伊犁哈萨克自治州霍城县、伊宁县、察布查尔锡伯族自治县、兵团等地。目前,新疆薰衣草主栽品种主要有法国蓝、太空蓝、杂花和701,其中法国蓝和太空蓝的种植面积约占新疆薰衣草种植面积的80%。根据薰衣草品种的不同特征,可将薰衣草分为精油提取、干花制作,及其他加工产品等类型。法国蓝精油品质较好,主要用于精油提取,精油平均产量为0.373 kg·km-2,销售占比高达80%;太空蓝主要以干花模式销售。此外,法国蓝和太空蓝薰衣草花轮数较多,花束整齐,花色艳丽,具有较高的观赏价值,极大地促进了新疆伊犁旅游业的发展。
伊犁是中国薰衣草种苗的主要产地,种苗销售量约占全国的75%。种苗质量取决于种苗的繁育技术,随着市场对薰衣草种苗质量的提高,传统的育种方法已无法满足市场需求,利用植物组织培养技术可缩短优质薰衣草种苗的育种年限。薰衣草种子小,种皮角质化外包蜡质,具有休眠现象[9]。自然条件下,发芽率不到10%[10]。植物激素可提高薰衣草种子的萌发率。张福平等[11]研究发现,GA3、6-BA、IBA等植物激素对种子萌发有影响,其中GA3对薰衣草种子萌发的促进效果最佳。张瑞麟等[12]提出,低浓度的GA3和6-BA有利于薰衣草种子的萌发。株秀峰等[13]以薰衣草嫩莖为外植体诱导出大量丛生芽,不同植物激素对薰衣草芽诱导效果不同,诱导出的芽形态各异。6-BA和NAA激素组合对薰衣草芽诱导的增殖速度快,增殖倍数可达3.1倍[14]。张俊等[15]对宽叶薰衣草愈伤组织诱导的研究表明,光培养下的愈伤组织颜色呈嫩绿色、愈伤紧密,暗培养的愈伤组织呈灰白色、水浸状、愈伤较疏松。丛生芽诱导的激素组合为2,4-D和6-BA,该激素组合也适用于狭叶薰衣草[16]。薰衣草有37个种、100多个品种[17],不同基因型的培养条件及激素配比不同,同基因型的诱导条件不同,其出苗长势不同。本研究针对目前薰衣草种苗质量良莠不齐的现状,以法国蓝和太空蓝薰衣草种子和茎段为外植体,通过筛选最适激素配比和浓度,拟建立高效的薰衣草快繁体系,为攻克薰衣草苗木高效快速繁育关键技术提供理论依据。
1 材料与方法
1.1 材料
试验材料为新疆农业大学薰衣草研究所当年收获的法国蓝、太空蓝薰衣草种子,种子净度高、饱满、健全无病虫害。
1.2 方法
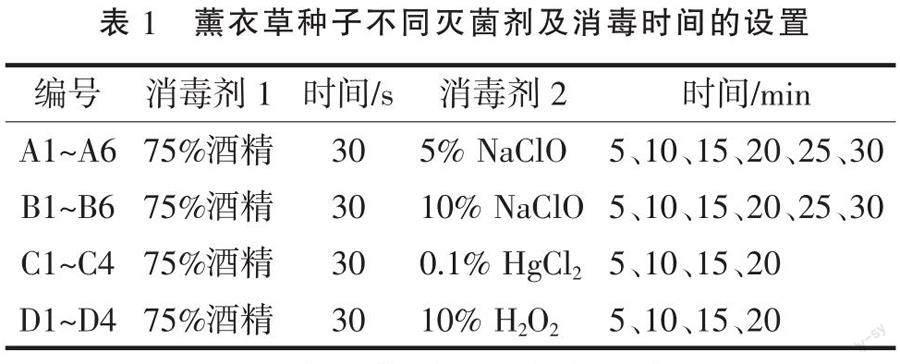
1.2.1 种子的选择与表面灭菌 将适量大小均匀、颗粒饱满的薰衣草种子置于离心管中,用蒸馏水润洗9~10次后晾干备用。在无菌条件下,用75%酒精浸泡种子30 s,用无菌水润洗3~5次,经不同灭菌剂进行处理后,用无菌水润洗3~5次,最后接种于MS培养基中。每组21颗,重复3次。每天记录污染数与发芽数,30 d后统计种子的污染率和萌发率(表1)。
污染率=污染种子数/播种总数×100%(1)
发芽率=发芽种子数/播种总数×100%(2)
1.2.2 GA3处理薰衣草种子 (1)浸种法。GA3浸种的浓度设为200、400、600 mg·L-1,浸种的时间设为8、16、24 h,另设一组样品(CK)不做任何处理;浸种后蒸馏水润洗9~10次,再置于超净工作台进行灭菌处理。每组21颗,重复3次。基本培养基为:MS+30 g·L-1蔗糖+7 g·L-1琼脂。
(2)混培法。GA3混培法共设5种处理(分别为0、0.5、1.0、1.5、2.0 mg·L-1GA3),每个处理使用种子21粒,重复3次。接种后,置于26 ℃培养室进行暗培养,观察并记录种子的萌发情况。
苗长、根长统计:每组随机测量10株苗的苗长、根长并求平均值(发芽不足10株的全测)。
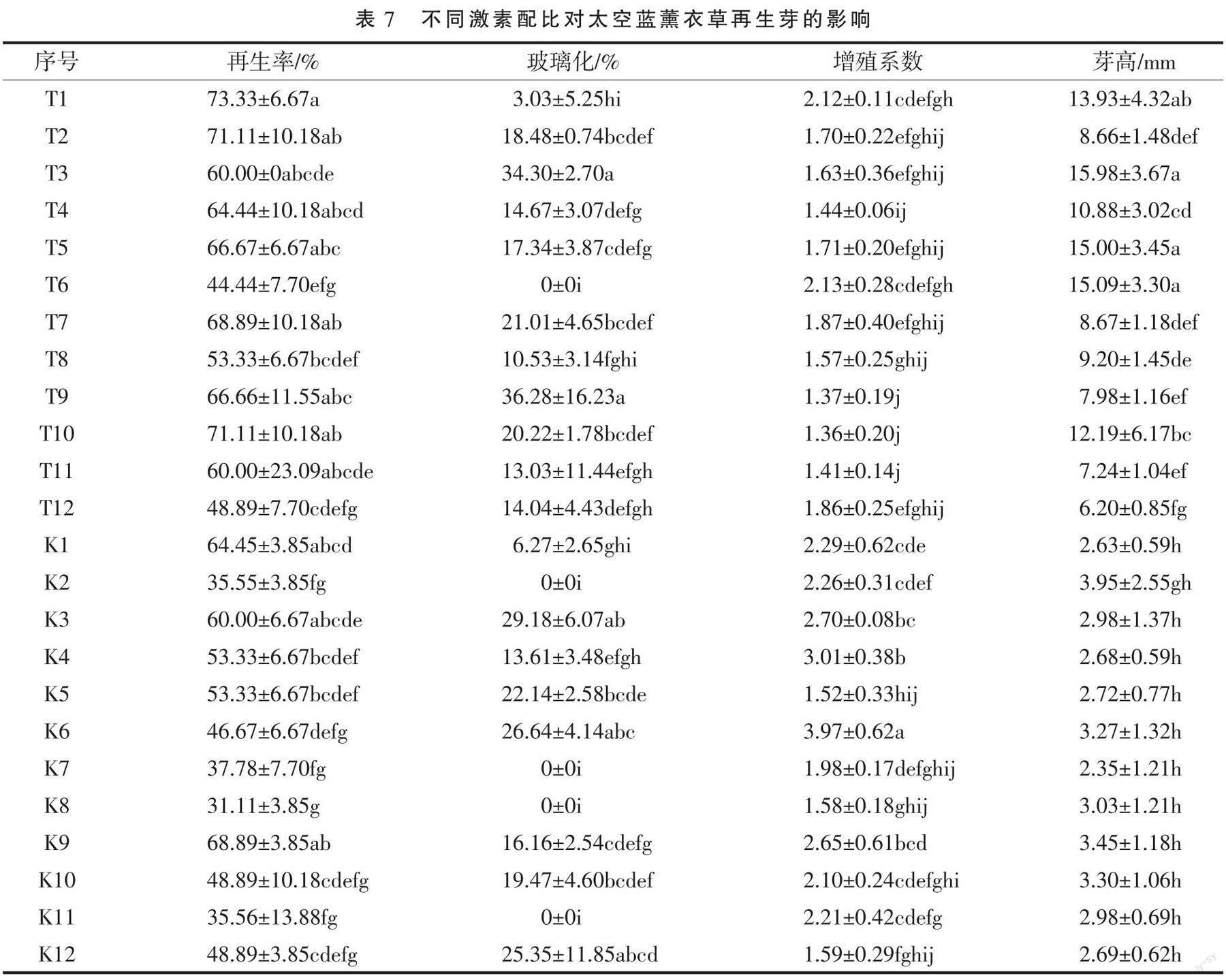
1.2.3 薰衣草增殖与分化培养 以法国蓝、太空蓝无菌苗茎段为外植体,在MS培养基中添加不同NAA、TDZ、2,4-D和KT激素配比(表2),每个处理接种15~25个外植体;30 d后统计出芽率、增殖系数,并测量其芽的高度。
1.2.4 生根培养 挑选2 cm左右的无菌苗,转接至MS、1/2MS且添加不同浓度NAA的培养基上,30 d后统计其生根率,测量根长及根条数。培养条件为25~26 ℃,16 h光照,8 h黑暗,光照强度为2 400 lx。
1.2.5 移栽 将根系发育良好的无菌苗在培养室内进行炼苗(打开瓶盖,倒入适量无菌水以软化培养基),1~2 d后,用无菌水洗净根部培养基并移栽至已灭菌的基质(营养土 ∶ 珍珠岩 ∶ 蛭石=3 ∶ 2 ∶ 1)。在薰衣草苗上方盖半个透明塑料空瓶,5~7 d长出嫩芽后,表明芽已存活,去掉塑料空瓶,置于阳光充足的地方培养30 d。
1.2.6 数据处理 使用OneNot和Excel 2019软件对数据进行整理统计,SPSS 26.0软件对数据进行分析,Origin软件作图。
2 结果与分析
2.1 不同灭菌方法对薰衣草种子消毒及发芽的影响
种子表面消毒是无菌播种的首要前提,适宜的消毒方法有利于减少材料的损失和外植体的污染。由表3可知,不同消毒剂对法国蓝和太空蓝薰衣草种子的消毒效果不同。用H2O2和HgCl2对法国蓝种子进行消毒,污染率和发芽率都较低,且无显著差异;10% NaClO的灭菌效果普遍优于5% NaClO。对于太空蓝种子,5% NaClO处理(5~30 min)时,种子的污染率随着消毒时间的增加而下降;用10% NaClO和5% NaClO处理种子5 min时,污染率最高,其污染率均高于40%,且与其他处理差异显著;使用10% H2O2处理时,污染率均低于3.17%,且发芽率显著高于其他处理组;而使用0.1% HgCl2处理种子(5~20 min)时,污染率均为0。通过设置4种消毒剂不同处理时间,以薰衣草种子污染率和萌发率为指标来确定最佳的灭菌方法。结果表明:法国蓝种子用10%NaClO消毒15~20 min时污染率较低,且发芽率高达84%;太空蓝种子最佳消毒方法为10% H2O2处理15 min,发芽率可达66.67%。
2.2 GA3对薰衣草生长的影响
2.2.1 GA3对薰衣草种子萌发的影响 GA3浸种后,薰衣草种子第3 天开始萌发;而混培法则需要6~7 d种子才会萌发。由表4和表5可知,经GA3处理后的种子其发芽率显著高于对照组,且浸种法种子的萌发率优于混培法。GA3浸种法处理法国蓝种子,种子的发芽率随GA3处理浓度的增加而增加(图1);同一浓度,种子发芽率随着处理时间的增加呈先增后降的趋势;600 mg·L-1GA3浸種16 h,种子的发芽率高达92.06%。对于太空蓝种子,用200 mg·L-1GA3浸种时,发芽率随着浸种时间的增加呈先升后降的趋势;当GA3的浓度为400 mg·L-1和600 mg·L-1时,发芽率随着浸种时间的增加而增加(图1);当600 mg·L-1GA3浸种24 h时,太空蓝的发芽率高达92.06%。
2.2.2 GA3对薰衣草芽及根生长的影响 由图1可知,GA3处理后薰衣草芽和根的长势均优于对照组。当用200 mg·L-1GA3浸种时,法国蓝的芽长和根长随着处理时间的增加呈上升趋势,而太空蓝的芽长和根长则随着浸种时间的增加呈先升后降的趋势。当GA3浓度为400 mg·L-1和600 mg·L-1时,太空蓝的芽长随着处理时间的增加而增加。由图2可知,通过混培法处理种子,法国蓝和太空蓝最适宜的GA3浓度分别为2、1 mg·L-1。由图3可知,浸种法处理的薰衣草种子,芽长势较好但根系不发达;而混培法处理的,根系较为发达,但芽长势细弱,幼苗不易存活。因此,一定浓度的GA3对薰衣草种子进行处理能提高种子的发芽率和芽的长势。
2.3 不同激素对薰衣草不定芽增殖的影响
将长势良好的茎段接种到分化培养基上,3~7 d开始萌动。K1~K12激素配比诱导法国蓝薰衣草不定芽大多发生畸形,玻璃化显著高于T1~T12,芽高显著低于T1~T12(表6);在NAA和TDZ激素组合中,随着TDZ浓度的增加,不定芽畸形的概率越高。NAA和TDZ激素组合太空蓝薰衣草的再生率和芽高优于2,4-D和KT激素组合(表7)。综上所述,添加了0.1 mg·L-1NAA和0.2 mg·L-1TDZ的MS培养基对法国蓝分化再生芽的效果最好,芽的诱导率高达97.33%,增殖系数为5.18;而添加了0.05 mg·L-1NAA和0.2 mg·L-1TDZ的MS培养基对太空蓝不定芽增殖的效果最好,其芽诱导率达73.33%,增殖系数为2.12。
2.4 薰衣草不定根的诱导
将薰衣草接种到生根培养基上,6~10 d后薰衣草开始生根。由表8和表9可知,在MS培养基中,生根率随着NAA浓度的增加而增加;在1/2MS培养基中,薰衣草的生根率、根长均随着NAA浓度的升高而降低。添加了NAA的1/2MS培养基中,薰衣草生根条数优于MS的生根数。由图5可知,将法国蓝接种到添加了NAA的MS培养基上,所生的根发黑。对于太空蓝,在普通MS培养基中所生的根较长,主根上侧根很少;而添加了NAA的MS培养基中,主根比未添加NAA培养基中的根粗,侧根也较多。因此,薰衣草最佳的生根培养基为1/2MS+0.2 mg·L-1NAA,且法国蓝和太空蓝薰衣草的生根率分别为87.3%、85.71%,根长分别为37.53、37.09 mm,生根条数分别为11.33、6.67。
3 讨论与结论
种子萌发率是衡量种子活力的重要指标,种子萌发率与其活力成正比,萌发率越高,出苗越整齐。薰衣草种子休眠期较长,未经解除休眠的种子出苗率极低[10]。杨阳等[14]对小姑娘薰衣草、法国薰衣草、狭叶薰衣草种子的萌发研究表明,不经任何处理的薰衣草种子,发芽率显著低于试验组,其发芽率分别为5.7%、6.3%、6%。消毒液类型、浓度、消毒时间都影响薰衣草种子的萌发率。相比于NaClO和H2O2,HgCl2对法国蓝种子的消毒效果较差,污染率和发芽率相对较低;而对太空蓝种子的消毒效果最好,但种子不萌发。由此推测,HgCl2作为种子消毒剂,灭菌效果较为彻底,时效短且高效;但HgCl2对种子也有一定的毒害作用,与于倩等[15]和覃顺旺等[18]的结论一致。值得注意的是,消毒剂能在一定程度上促进薰衣草种子的萌发。法国蓝种子萌发率随着5% NaClO(5~30 min)处理时间的增加而升高;随着10% NaClO(5~30 min)处理时间的增加先升后降。对于太空蓝,种子萌发率随着10% H2O2(5~20 min)处理时间的增加呈先降后升再降的趋势。因此,在生产中根据不同品种选择合适的消毒剂能显著提高种子的萌发率。
薰衣草种子活力偏低的原因可能是种子休眠造成的,GA3作为植物生长激素,能在一定程度上打破种子休眠[19]、促进种子在逆境下萌发[20],能大大缩短种子发芽的时间。本研究表明,经过不同浓度的GA3浸种后,法国蓝和太空蓝薰衣草种子的活力都得到了提高,但GA3对种子萌发率的促进作用不同。在GA3浓度相同的条件下,随着处理时间的增加,法国蓝种子的萌发率呈先升后降的趋势;但随着GA3浓度的增加,浸种时间的增加,太空蓝种子的萌发率呈上升的趋势。这说明高浓度GA3对种子的萌发有促进作用,但因品种特性差异,GA3浸种时间对种子萌发影响的差异较大。600 mg·L-1GA3的效果最好,薰衣草种子的萌发率都高达92%,但法国蓝和太空蓝对该浓度GA3的耐受力不同,浸种的最佳时间分别是16、24 h。GA3对薰衣草种子的萌发率有较大的影响,能最大限度的打破薰衣草种子的休眠,因此在生产中使用GA3浸种是非常必要的。生长素与细胞分裂素的种类和浓度配比是影响愈伤组织诱导的重要因素[21]。适当地调节生长素与细胞分裂素的种类和浓度配比[22],可以提高不定芽的诱导率。杨鑫等[23]以薰衣草叶片和茎段为外植体材料诱导愈伤组织,发现2种愈伤组织产生的丛生芽没有区别。本研究以法国蓝和太空蓝薰衣草茎段为外植体,使用不同NAA和TDZ、2,4-D和KT激素配比诱导再生芽,发现使用2,4-D和KT诱导的再生芽,切口能诱导出大量黄绿色愈伤(图4),诱导出的苗玻璃化较为严重,有少量畸形苗;NAA和TDZ激素组合切口处诱导出的愈伤较少,芽的长势较快。法国蓝和太空蓝最佳增殖分化培养基分别为MS+0.1 mg·L-1NAA+0.2 mg·L-1TDZ和MS+0.05 mg·L-1NAA+0.2 mg·L-1TDZ。
White、MS和1/2MS培养基常用于薰衣草生根培养。何家涛等[24]在White培养基中添加IBA或NAA后薰衣草的生根率较高;且添加了NAA,生的根会稍壮[25]。王会[26]在薰衣草生根培养中发现,随着NAA浓度的增高,易形成愈伤组织,薰衣草生根条数和生根率也大大提高,但后期炼苗会因愈伤组织糜烂而影响苗的存活率,故生根培养时NAA浓度不宜过高。本研究发现,法国蓝和太空蓝薰衣草最佳的生根培养基都为1/2 MS+0.2 mg·L-1NAA,与邵明月等[27]、克热木汗·吾斯曼[28]的研究结果一致。
本研究以法国蓝和太空蓝薰衣草为研究对象,通过对种子的萌发率、不定芽的生殖分化效率和生根培养等情况进行系统研究,建立了高效的薰衣草组织培养快繁体系,为薰衣草快速规模化繁育种苗提供技术参考。
参考文獻:
[1] 魏琮, 李克勤, 张迎春, 等. 薰衣草的花药培养(初报)[J]. 陕西师大学报(自然科学版), 1979, 7(1): 113-118.
[2] 李晓婷, 常铭阳, 苑泽宁. 植物生长调节剂对薰衣草繁殖的影响机制研究进展[J]. 现代农业科技, 2018(17): 121-123.
[3] 陈丽娟, 沈彩华, 张昕昕, 等. 化学诱变剂及赤霉素对狭叶薰衣草种子萌发的影响[J]. 种子, 2012, 31(12): 1-4, 8.
[4] AL-ANSARI M M, ANDEEJANI A M I, ALNAHMI E, et al. Insecticidal, antimicrobial and antioxidant activities of essential oil from Lavandula latifolia L. and its deterrent effects on Euphoria leucographa[J]. Industrial Crops and Products, 2021, 170: 113740.
[5] ARDAHAN AKG?L E, KARAKUL A, ALTIN A, et al. Effectiveness of lavender inhalation aromatherapy on pain level and vital signs in children with burns: a randomized controlled trial[J]. Complementary Therapies in Medicine, 2021, 60: 102758.
[6] HER J, CHO M K. Effect of aromatherapy on sleep quality of adults and elderly people: a systematic literature review and meta-analysis[J]. Complementary Therapies in Medicine, 2021, 60: 102739.
[7] 廖凌璐. 不同栽培基质对盆栽薰衣草生长发育的影响[D]. 长沙: 湖南农业大学, 2018: 2-5.
[8] 彭国敏, 商成杰. 香熏疗法的保健功能及其在纺织品上的应用[C]//“诺葳杯”第九届全国印染后整理学术研讨会论文集. 北京: 中国纺织工程学会, 2014: 68-71.
[9] 王志彦, 何三军, 蔡德义, 等. GA3处理对蒙斯特薰衣草种子发芽的影响[J]. 天津农业科学, 2019, 25(5): 13-17.
[10] 常文静. GA3和6-BA浸种对薰衣草种子萌发的影响[J]. 天津农业科学, 2019, 25(4): 15-17, 37.
[11] 张福平, 马海宣. 薰衣草种子发芽试验研究[J]. 中国种业, 2007(11): 38-40.
[12] 张瑞麟, 李志宏, 范敏, 等. 不同处理对薰衣草种子萌发和扦插生根的影响[J]. 新疆农业大学学报, 2007, 30(2): 54-56.
[13] 朱秀峰, 杨兰钦, 张妙霞, 等. 唇形科若干香科植物组织培养[C]//第二届全国植物组织培养、脱毒快繁及工厂化生产学术研讨会论文集. 北京: 中国农业科学技术出版社, 2004: 410-417.
[14] 周辉明, 陈燕, 罗庆国. 薰衣草微繁技术初探[J]. 现代园艺, 2006(5): 6.
[15] 张俊, 蒋桂华, 倪苏, 等. 光照对宽叶薰衣草愈伤组织诱导的影响[J]. 成都中医药大学学报, 2011, 34(1): 83-85, 93.
[16] 王婵, 陈丽娟, 程明华, 等. 狭叶薰衣草离体培养技术研究[J]. 海南师范大学学报(自然科学版), 2012, 25(4): 435-437,469, 479.
[17] 张振国, 郭丹丽, 赖刚刚, 等. 4种薰衣草耐高温潮湿性评价[J]. 江苏农业科学, 2023, 51(8): 119-123.
[18] 覃顺旺, 王跃华, 俸世洪, 等. 不同消毒方法对山莨菪种子消毒及萌发的影响[J]. 安徽农业科学, 2023, 51(4): 185-188.
[19] KWON H J, SHIN S L, KIM Y R, et al. Effects of temperature, gibberellic acid, and KNO3 treatments on seed germination of the wild plant Maesa japonica[J]. Seed Science and Technology, 2020, 48(1): 65-72.
[20] 李亚涛. 薰衣草种子的休眠机制及其解除策略的研究[D]. 乌鲁木齐: 新疆农业大学, 2010: 28-30.
[21] 廖菲菲, 杨保莲, 杨润深, 等. 掌叶木胚性愈伤组织及体胚诱导的影响因素研究[J/OL]. 分子植物育种: 1-19[2023-12-01]. http://kns.cnki.net/kcms/detail/46.1068.S.20230330.1031.008.html.
[22] 刘珊, 陈全家, 苏秀娟, 等. 英国薰衣草愈伤再生体系的建立[J]. 新疆农业科学, 2010, 47(1): 73-77.
[23] 杨鑫, 詹爽, 彭尽晖, 等. 狭叶薰衣草的离体培养及挥发性成分的分析[J]. 热带亚热带植物学报, 2020, 28(1): 84-90.
[24] 何家涛, 王会, 董珍文, 等. 薰衣草茎段再生体系的建立[J]. 江西农业学报, 2006, 18(4): 91-93.
[25] 蘇琛. 薰衣草离体培养技术研究[J]. 湖北农业科学, 2012, 51(3): 623-625.
[26] 王会. 薰衣草组织培养试验简报[J]. 上海农业科技, 2006(3): 107.
[27] 邵明月, 叶子优, 陈梦菲, 等. 羽叶薰衣草的组织培养[J]. 现代农业科技, 2011(22): 50-51.
[28] 克热木汗·吾斯曼. 薰衣草高效再生体系的建立及萜类合成酶基因的遗传转化[D]. 乌鲁木齐: 新疆农业大学, 2021: 20-21.
收稿日期:2023-12-20
基金项目:自治区重点研发计划项目(2022B02036-1);自治区伊犁州科技计划项目(YZ2022B001);自治区重大科技专项(2022A03004-1)
作者简介:张钰茜(1998—),女,贵州遵义人,在读硕士生,主要从事薰衣草遗传育种研究。
通讯作者简介:苏秀娟(1980—),女,新疆昌吉人,教授,硕士生导师,主要从事薰衣草遗传育种研究。
王爱凡(1989—),女,广西河池人,讲师,博士,主要从事薰衣草遗传育种研究。

