银杏内酯B调控miR-155-5p对高糖诱导肾小管上皮细胞凋亡的影响
秦美灵,吴春丽,陈延玲,廉波,尚海玉,韩英
(济南市中西医结合医院,1.内分泌科;2.治未病中心;3.财务科,山东 济南 271100)
肾小管上皮细胞损伤与糖尿病肾病密切相关,长期的高糖刺激可引发过量活性氧产生,诱导肾细胞氧化应激和炎症反应,促进肾小管上皮细胞凋亡,导致肾小管损伤[1-4]。银杏内酯B(ginkgolide B,GB)是从银杏叶中提取的活性成分,具有抗炎、抗氧化、抗凋亡等作用[5]。GB对糖尿病肾病具有保护作用,可降低糖尿病肾病小鼠的高血糖、血清总胆固醇和甘油三酯浓度,减少尿白蛋白排泄,改善肾脏损伤,是糖尿病肾病的有效治疗选择[6];但其作用机制尚不明确。微小RNA(microRNA,miRNA)属于短链非编码RNA分子,可通过靶向调控靶基因表达而参与多种生理病理过程。miR-155-5p是一种与炎症反应有关的miRNA,在糖尿病肾病中表达上调,可能与患者的疾病分期或糖尿病肾病的发病机制有关,是糖尿病肾病诊断和治疗的重要靶点[7]。本研究通过高糖(high glucose,HG)诱导肾小管上皮细胞损伤模型,拟探讨GB能否通过调控miR-155-5p抑制HG诱导的肾小管上皮细胞凋亡及炎症反应。
1 材料与方法
1.1 材料与试剂
上海诗丹德提供GB(纯度≥98%);上海通派生物提供人肾小管上皮细胞HK-2;美国Thermo Fisher提供Trizol试剂;美国Invitrogen提供Lipofectamine2000;北京天根生化提供反转录、SYBR Green试剂盒;广州锐博生物提供anti-miR-NC、anti-miR-155-5p、miR-NC、miR-155-5p mimics;北京索莱宝提供凋亡检测试剂盒;上海酶联生物提供IL-6、TNF-α检测试剂盒;美国Abcam提供兔抗人Bcl-2相关X蛋白(BCL2-associated X protein,Bax)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体;美国CST提供内参GAPDH抗体、山羊抗兔IgG二抗。
1.2 方法
1.2.1 细胞培养、分组与转染 将HK-2细胞在25 mmol/L 葡萄糖的DMEM培养基培养24 h[8],取对数生长期细胞记为HG组。加入含有浓度为5.5 mmol/L葡萄糖的DMEM培养基培养24 h,记为NG组。HG+低剂量GB组(HG+GB-L组,25 μmol/L GB[9]与25 mmol/L葡萄糖的DMEM培养基培养24 h)、HG+中剂量GB组(HG+GB-M组,50 μmol/L GB与25 mmol/L葡萄糖的DMEM培养基培养24 h)、HG+高剂量GB组(HG+GB-H组,100 μmol/L GB与25 mmol/L葡萄糖的DMEM培养基培养24 h)、HG+anti-miR-NC组(转染anti-miR-NC后用25 mmol/L葡萄糖的DMEM培养基处理24 h)、HG+anti-miR-155-5p组(转染anti-miR-155-5p后用25 mmol/L葡萄糖的DMEM培养基处理24 h)、HG+GB+miR-NC组(转染miR-NC后用100 μmol/L GB与25 mmol/L葡萄糖的 DMEM培养基共同处理24 h)、HG+GB+miR-155-5p组(转染miR-155-5p mimics后用100 μmol/L GB与25 mmol/L葡萄糖的 DMEM培养基共同处理24 h)。
1.2.2 流式细胞术检测细胞凋亡率 将1.2.1中各组HK-2细胞离心取上清,按照凋亡检测试剂盒说明书检测凋亡情况。
1.2.3 ELISA法检测炎性因子水平 将1.2.1中各组HK-2细胞取上清液,按照ELISA试剂盒说明书检测IL-6、TNF-α的水平。
1.2.4 RT-qPCR检测miR-155-5p的表达水平 将1.2.1中各组HK-2细胞用Trizol试剂盒提取总RNA,并用逆转录试剂盒得到cDNA,随后进行qRT-PCR,采用2-△△Ct法计算miR-155-5p相对表达水平。
1.2.5 Western blot检测Bax、Bcl-2蛋白表达量 将1.2.1中各组HK-2细胞破碎后提取总蛋白,用BCA试剂盒进行浓度定量,按步骤将蛋白SDS-PAGE电泳、转膜,5 %脱脂奶粉封闭2 h,在4 ℃下加入一抗Bcl-2、Bax、(1∶1 000)和GAPDH过夜孵育,清洗,在4 ℃下加入二抗(1∶3 000),孵育2 h。用ECL发光显影,观察拍照,各条带灰度值用Image J软件处理分析。
1.3 统计学分析
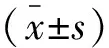
2 结果
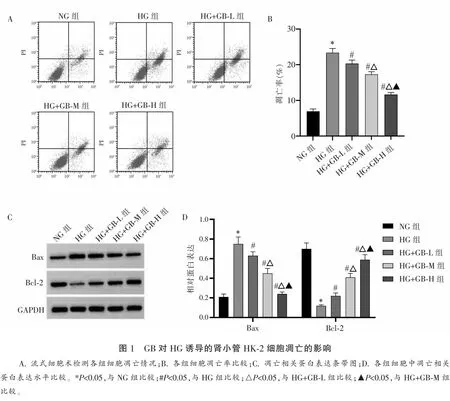
2.1 GB对HG诱导的HK-2细胞凋亡情况比较
与NG组比较,HG组细胞凋亡率、Bax蛋白水平升高,Bcl-2蛋白水平降低(P<0.05);与HG组比较,GB不同剂量组细胞凋亡率、Bax水平降低,Bcl-2升高,且呈剂量依赖性(P<0.05)。见图1。
2.2 GB对HG诱导的HK-2细胞炎性因子比较
与NG组比较,HG组细胞培养上清液中IL-6、TNF-α的水平升高(P<0.05);而GB不同剂量组细胞培养上清液中IL-6、TNF-α水平降低(P<0.05),且呈剂量依赖性。见图2。
2.3 GB对HG诱导的HK-2细胞中miR-155-5p表达的影响
与NG组比较,HG组HK-2细胞中miR-155-5p的表达量升高(P<0.05),而GB不同剂量组HK-2细胞中miR-155-5p表达降低(P<0.05),且呈剂量依赖性。见图3。
2.4 miR-155-5p转染效率的检测
与anti-miR-NC组比较,anti-miR-155-5p组miR-155-5p的表达量降低(P<0.05);与miR-NC组比较,miR-155-5p组miR-155-5p的表达量升高(P<0.05)。见图4。
2.5 抑制miR-155-5p对HG诱导的HK-2细胞凋亡、炎性因子的影响
与HG+anti-miR-NC组比较,HG+anti-miR-155-5p组细胞凋亡率、Bax蛋白水平和细胞培养上清液中IL-6、TNF-α水平降低,Bcl-2蛋白水平升高(P<0.05)。见图5。
2.6 过表达miR-155-5p对GB处理的HG诱导的HK-2细胞凋亡、炎性因子的影响
与HG+GB+miR-NC组比较,HG+GB+miR-155-5p组细胞凋亡率和Bax蛋白水平升高(P<0.05),Bcl-2蛋白水平降低(P<0.05),IL-6、TNF-α的水平升高(P<0.05),表明过表达miR-155-5p可减弱GB对HG诱导的HK-2细胞凋亡、炎性因子的影响。见图6。

3 讨论
高血糖诱发的肾小管细胞损伤在糖尿病肾病的发病机制中起关键作用[10]。此外,糖尿病肾病的发生发展与高血糖引起的炎症和细胞凋亡有关,调节炎症和细胞凋亡是减轻高糖诱导的肾细胞损伤的重要途径[11]。本研究中,HG诱导的肾小管上皮细胞凋亡率升高,IL-6、TNF-α水平增加,且Bax蛋白水平升高,Bcl-2蛋白水平降低,与既往的研究[12-13]结果一致,表明肾小管上皮细胞损伤模型构建成功。
GB是一种植物来源的萜类化合物,是银杏叶提取物中的天然生物活性成分之一,具有抗血小板聚集、抗炎、抗氧化、清除自由基等多种药理活性[14-16]。Li等[17]以高糖培养的大鼠肾小管上皮细胞为对象,使用高效液相色谱串联质谱法(LC-MS/MS)对银杏叶提取物的生物活性成分进行分析发现,GB是银杏叶提取物中对糖尿病肾病具有预防作用的潜在生物活性成分之一。本研究中,GB能抑制HG诱导的肾小管上皮细胞凋亡,并降低HG刺激下肾小管上皮细胞中IL-6、TNF-α水平,表明GB可抑制HG诱导的肾小管上皮细胞炎症因子表达和细胞凋亡,对高糖诱导的肾小管上皮细胞发挥保护作用。
糖尿病肾病患者肾脏组织中可见丰富的miRNA表达,且表达量可在一定程度上反映患者的病情,miRNA与糖尿病肾病进展密切相关[18-19]。其中炎症相关的多功能基因miR-155-5p在糖尿病肾病患者肾组织、血清和尿液中均呈高表达[20-21];其高表达与糖尿病肾病患者的严重程度有关[22]。此外,miR-155-5p在糖尿病肾病肾小管损伤中发挥重要作用,其表达敲低可减轻HG诱导的肾小管上皮细胞损伤[23]。本研究中,HG诱导的肾小管上皮细胞中miR-155-5p的表达量升高,抑制miR-155-5p表达可抑制HG诱导的肾小管上皮细胞凋亡,并可降低IL-6、TNF-α水平;表明下调miR-155-5p表达可减轻HG诱导的肾小管上皮细胞损伤,与既往的研究[23]结果一致。Guo等[24]发现,在糖尿病肾病大鼠模型和HG诱导的大鼠肾小管上皮细胞中miR-155-5p表达增加,二氢杨梅素可通过下调miR-155-5p的表达来抑制糖尿病肾病大鼠肾间质纤维化和HG诱导的肾小管上皮细胞纤维化,提示miR-155-5p可能为糖尿病肾病诊断和治疗的重要靶点。本研究中,GB可降低HG诱导的肾小管上皮细胞中miR-155-5p的表达量,过表达miR-155-5p可减弱GB对HG诱导的肾小管上皮细胞损伤的改善作用,提示GB可能通过抑制miR-155-5p的表达来减轻HG诱导的肾小管上皮细胞损伤。
综上,GB可通过抑制细胞凋亡及炎症因子表达来减轻高糖诱导的肾小管上皮细胞损伤,其作用机制可能与抑制miR-155-5p的表达有关。

