药用植物狗牙根的化学成分及其抗炎活性研究
刘 佳,范苏苏,杨思琦,唐丽萍,张 旋,李 鲜
(昆明医科大学 药学院暨云南省天然药物药理重点实验室,云南 昆明 650500)
狗牙根[Cynodondactylon(L.) Pers.]为禾本科(Poaceae)狗牙根属(Cynodon)植物,又名百慕大草、绊根草、行仪芝,在中国有2 个种和1 个变种[1-2].狗牙根全草入药,其味苦、微甘、入肝经,具有祛风活络、解热止血、解毒等功效,民间用于痨伤吐血、跌打损伤、疮疡肿毒、痢疾等疾病的治疗[3].
目前从狗牙根中分离得到的化学成分有茋类化合物和木脂素类化合物,其初提物表现出抗癌、抗病毒、抗关节炎、利尿等药理作用[4].但是对于狗牙根的化学成分和抗炎活性成分的研究还较少[5-6].为进一步开发和利用药用植物狗牙根,阐明其抗炎活性的物质基础,本实验综合利用正相、反相硅胶柱色谱、Sephadex LH-20 凝胶柱色谱、半制备液相色谱等色谱方法对狗牙根中的化学成分进行了分离纯化,并通过NMR 和MS 等现代波谱技术鉴定了16 个化合物,其中15 个化合物为首次从该植物中分离得到.后又利用Griess 法,对狗牙根中的11个黄酮类化合物和3 个蒽醌类化合物进行了体外抗炎活性研究,结果显示,在RAW264.7 炎症细胞模型上,化合物2、3和14显著抑制NO 生成,其IC50值分别为2.74、2.35、3.61 μmol/L.
1 实验材料与方法
1.1 仪器和材料Brucker AM-4 Avance 600 型核磁共振仪(德国Brucker 公司),半制备高效液相色谱仪(上海科哲公司),薄层色谱硅胶GF 254(0.20-0.25 mm)和柱层析用硅胶(0.054~0.077 mm,200~300 目)(青岛海洋化工厂),RP-18(Merk 公司),大孔吸附树脂D101(上海莱特公司),葡聚糖凝胶Sephadex LH-20(GE Healthcare),MCI-gel CHP-20P(日本三菱),Scientific Multiskan Go 酶标仪(美国Thermo Scientific 公司);地塞米松(北京索莱宝生物科技有限公司),一氧化氮检测试剂盒(碧云天生物技术有限公司),色谱纯甲醇和乙腈(上海星可公司);其余分析纯试剂购自于天津致远化学试剂有限公司,显色剂为10%硫酸-乙醇溶液.
1.2 植物来源植物样品于2021 年4 月采自云南临沧,由昆明医科大学唐丽萍教授鉴定,植物标本现存放于昆明医科大学药学院.
2 实验方法
2.1 化合物的提取和分离干燥狗牙根全草18.0 kg,粉碎后用95%乙醇加热回流提取4 次,减压浓缩合并提取液后得到浸膏1 140 g,浸膏用大孔树脂D101 进行脱色,脱色后的样品394 g 经正相硅胶柱层析(0.054~0.077 mm,200~300 目),使用石油醚、氯仿、乙酸乙酯、丙酮、甲醇依次洗脱,薄层色谱检测,得到A~E 5 个部位.
B 部位(45 g)用MCI 柱层析(甲醇-水,体积比0:100→100:0)和丙酮洗脱,得到9 个部位Fr B1~B9,其中Fr B9 采用正相硅胶柱层析(石油醚-乙酸乙酯,体积比100:1→2:1)得化合物15(2.5 g)和化合物16(2.5 g).
C 部位(110.6 g)经硅胶柱层析(石油醚-乙酸乙酯,体积比100∶1→1∶100)和甲醇洗脱,得到16 个部位(Fr C1~C16).Fr C2 经Sephadex LH-20凝胶柱层析后得到化合物13(3.4 mg).Fr C5 经正相硅胶柱层析(石油醚-乙酸乙酯,体积比50∶1→1∶3)、Sephadex LH-20 凝胶柱层析得到化合物14(6.7 mg).Fr C6 经ODS 反相柱层析(甲醇-水,体积比50∶50→100∶0)得到8 个部位(Fr C6-1~C6-8),其中Fr C6-3 和Fr C6-4 经Sephadex LH-20 凝胶柱层析得到化合物2(13.3 mg)、化合物3(1.9 mg)和化合物12(2.6 mg).Fr C8 采用正相硅胶柱层析法(石油醚-乙酸乙酯,体积比30∶1→1∶5,后用甲醇洗脱)后得3 个部位(Fr C8-1~C8-3),Fr C8-3 经Sephadex LH-20 凝胶柱层析得到化合物1(10.7 mg).Fr C10 和Fr C11 经ODS 反相柱层析法(甲醇-水,体积比35∶65→100∶0)得到5 个部位(Fr C10-1~C10-5)和8 个部位(Fr C11-1~C11-8),其中Fr C10-3 经Sephadex LH-20 凝胶柱层析得化合物4(2.3 mg);Fr C11-5 经Sephadex LH-20 凝胶柱层析、半制备HPLC(乙腈-水,体积比43∶57)和制备薄层色谱法得到化合物11(6.3 mg).Fr C12 和Fr C14经ODS 反相柱层析法(甲醇-水,体积比30∶70→100∶0)后分别得到11 个部位(Fr C12-1~C12-11)和5 个部位(Fr C14-1~C14-5),对Fr C12-4 采用Sephadex LH-20 凝胶柱层析、半制备HPLC(甲醇-水,体积比47∶53)得化合物5(3.6 mg);Fr C12-6经半制备HPLC(53%甲醇-水,体积比53∶47)后采用制备薄层色谱得化合物6(12.7 mg)、化合物7(5.7 mg)和化合物8(3.7 mg);Fr C14-1 经正相硅胶柱层析(二氯甲烷-甲醇,体积比15∶1→3∶1,后用甲醇洗脱)后得到5 个部位(Fr C14-1-1~C14-1-5),Fr C14-1-2 经Sephadex LH-20 凝胶柱层析、半制备HPLC(乙腈-水,体积比20∶80)得到化合物10(6.3 mg);Fr C14-2 经Sephadex LH-20 凝胶柱层析、半制备HPLC(乙腈-水,体积比30∶70)后得化合物9(4.7 mg).化合物1~16的结构如图1 所示.

图1 化合物1~16 的结构式Fig.1 Chemical structures of compounds 1-16
2.2 化合物的抗炎活性筛选实验分组:①空白组:各孔接种RAW264.7 细胞,细胞培养液为含10% FBS 的DMEM 完全培养基;②对照组:各孔接种RAW264.7 细胞,细胞培养液含10% FBS 的DMEM 完全培养基和1 μg/mL LPS;③不同浓度给药组:RAW264.7 细胞接种于孔内,细胞培养液为含有10% FBS 的DMEM 完全培养基和1 μg/mL LPS 和不同浓度的化合物;④阳性对照组:各孔接种RAW264.7 细胞,细胞培养液含10% FBS 的DMEM 完全培养基和1 μg/mL LPS 和地塞米松.
选取细胞生长状态较好的RAW264.7 细胞,待细胞融合程度达80%~90%时,PBS 清洗2 次,吹打细胞使贴壁细胞悬浮后再用含10% FBS 的DMEM 完全培养基重悬为单细胞悬液后进行细胞计数调整细胞浓度为1×105mL-1.取出新96 孔板,每孔加入100 μL RAW264.7 细胞悬液接种细胞,并在加液四周加入PBS 避免边缘效应,随后放入37 ℃、体积分数为5%的CO2细胞培养箱中培养.24 h 后移液枪吸弃旧培养基,根据分组加入不同的细胞培养液继续培养24 h,24 h 后吸出培养液于1 500 r/min 离心5 min,吸取上清,根据NO 检测试剂盒加样,使用酶标仪在波长550 nm 下检测每孔的吸光度,根据公式计算NO 含量和NO 抑制率,最后再用SPSS17.0 软件计算出化合物的抗炎活性的IC50值.公式如下:
NO 抑制率=[1-(实验孔OD 值-空白孔OD 值)/(对照孔OD 值-空白孔OD 值)]×100%.
3 结果与讨论
3.1 化合物的结构鉴定化合物1黄色针晶;ESI-MSm/z:329[M-H]-,C17H14O7;1H NMR (DMSOd6,600 MHz)δH: 12.94 (1H,s,5-OH),7.25 (2H,s,H-2′,6′),6.80 (1H,s,H-3),6.36 (1H,d,J=2.0 Hz,H-8),6.04 (1H,d,J=2.0 Hz,H-6),3.85 (6H,s,3′,5′-OCH3);13C NMR (DMSO-d6,150 MHz)δC: 181.0 (C-4),168.7 (C-2,4′),163.1 (C-7),161.3 (C-9),157.7(C-5),148.5 (C-3′,5′),141.4 (C-1′),119.3 (C-10),104.2 (C-2′,6′),102.8 (C-3),99.9 (C-6),94.8 (C-8),56.3 (3′,5′-OCH3).以上数据与文献[7]报道基本一致,故将化合物1鉴定为苜蓿素.
化合物2黄色固体;ESI-MSm/z:299[M-H]-,C16H12O6;1H NMR (DMSO-d6,600 MHz)δH: 12.96(1H,s,5-OH),10.87 (1H,brs,7-OH),10.00 (1H,brs,4′-OH),7.57 (1H,m,H-6′),7.56 (1H,m,H-2′),6.93 (1H,d,J=8.9 Hz,H-5′),6.90 (1H,s,H-3),6.51(1H,d,J=2.1 Hz,H-8),6.20 (1H,d,J=2.2 Hz,H-6),3.88 (3H,s,5′-OCH3);13C NMR (DMSO-d6,150 MHz)δC: 181.8 (C-4),164.2 (C-7),163.7 (C-2),161.5 (C-5),157.3 (C-9),150.7 (C-4′),148.0 (C-3′),121.5 (C-1′),120.4 (C-6′),115.8 (C-5′),110.2 (C-2′),103.7 (C-10),103.2 (C-3),98.8 (C-6),94.0 (C-8),55.8 (OCH3).以上数据与文献[8]报道基本一致,故将化合物2鉴定为chrysoeriol.
化合物3黄色粉末;ESI-MSm/z:255[M-H]-,C15H12O4;1H NMR (丙 酮-d6,600 MHz,)δH: 8.12(1H,d,J=8.9 Hz,H-6′),7.83 (1H,d,J=15.0 Hz,Hβ),7.76 (2H,d,J=8.6 Hz,H-2,6),7.73 (1H,d,J=16.0 Hz,H-α),6.92 (2H,d,J=8.6 Hz,H-3,5),6.46 (1H,dd,J=2.4,8.8 Hz,H-5′),6.37 (1H,d,J=2.3 Hz,H-3′);13C NMR (丙 酮-d6,150 MHz)δC: 192.9 (C=O),167.7 (C-4′),165.7 (C-2′),161.2 (C-4),145.3 (C-β),133.4 (C-6′),131.9 (C-2,6),127.6 (C-1),118.3 (Cα),116.9 (C-3,5),114.6 (C-1′),108.8 (C-5′),103.8(C-3′).以上数据与文献[9]报道基本一致,故将化合物3鉴定为isoliquiritigenin.
化合物4红色固体;ESI-MSm/z:581[M-H]-,C30H30O12;1H NMR (CD3OD-d4,600 MHz)δH: 7.08(2H,s,H-2′,6′),6.94 (1H,s,H-2′′),6.80 (1H,d,J=3.2 Hz,H-6′′),6.76 (1H,s,H-5′′),6.74 (1H,s,H-3),6.40 (1H,s,H-8),6.15 (1H,s,H-6),4.64 (1H,m,H-8′′),4.56 (1H,d,J=6.0 Hz,H-7′′),4.16 (1H,dt,J=8.5,3.3 Hz,H-9′′),3.94 (1H,dd,J=12.0,4.7 Hz,H-9′′),3.83 (6H,s,3′,5′-OCH3),3.80 (3H,s,3′′-OCH3),3.19 (3H,s,7′′-OCH3),1.92 (3H,s,9′′-OAc);13C NMR (CD3OD-d4,150 MHz)δC: 183.9 (C-4),172.6 (9′′-OAc),166.3 (C-7),165.4 (C-5),163.4(C-2),159.5 (C-9),154.8 (C-3′,5′),149.0 (C-4′′),147.9 (C-3′′),141.7 (C-4′),130.6 (C-1′′),127.6 (C-1′),122.1 (C-6′′),116.2 (C-5′′),112.3 (C-2′′),105.8(C-3),105.6 (C-10),105.0 (C-2′,6′),100.4 (C-6),95.3 (C-8),85.8 (C-7′′),83.5 (C-8′′),65.6 (C-9′′),56.9 (3′,5′-OCH3),57.3 (3′-OCH3),56.5 (7′′-OCH3),20.9 (9′′-OAc).以上数据与文献[10]报道基本一致,故将化合物4鉴定为tricin 4′-O-(threoβ-guaiacyl-(7′-O-methyl-9′-O-acetyl)-glyceryl) ether.
化合物5黄色粉末;ESI-MSm/z:285[M-H]-,C15H10O6;1H NMR (CD3OD-d4,600 MHz)δH: 7.39(2H,m,H-2′,6′),6.91 (1H,d,J=8.4 Hz,H-5′),6.54(1H,s,H-3),6.44 (1H,d,J=2.0 Hz,H-8),6.21 (1H,d,J=2.1 Hz,H-6);13C NMR (CD3OD-d4,150 MHz)δC: 183.8 (C-4),166.5 (C-7),166.3 (C-2),163.2 (C-5),159.5 (C-9),151.2 (C-4′),147.1 (C-3′),123.6 (C-6′),120.3 (C-1′),116.8 (C-5′),114.1 (C-2′),105.2(C-10),103.8 (C-3),100.3 (C-6),95.1 (C-8).以上数据与文献[11]报道基本一致,故将化合物5鉴定为木犀草素.
化合物6黄色粉末;ESI-MSm/z:525[M-H]-,C27H26O11;1H NMR (CD3OD-d4,600 MHz)δH: 7.23(2H,s,H-2′,6′),7.01 (1H,d,J=1.9 Hz,H-2′′),6.82(1H,dd,J=8.2 Hz,1.9 Hz,H-6′′),6.75 (1H,d,J=8.1 Hz,H-5′′),6.48 (1H,s,H-8),6.22 (1H,d,J=2.0 Hz,H-6),4.93 (1H,d,J=5.3 Hz,H-7′′),4.47 (1H,m,H-8′′),3.70 (2H,dd,J=12.1,3.4 Hz,H-9′′α,H-9′′β),3.93 (6H,s,3′,5′-OCH3),3.84 (3H,s,3′′-OCH3);13C NMR (CD3OD-d4,150 MHz)δC: 183.0 (C-4),167.3 (C-7),165.5 (C-2),163.5 (C-5),159.8 (C-9),155.1 (C-3′,5′),148.9 (C-3′′),147.3 (C-4′′),140.8(C-4′),134.1 (C-1′′),128.2 (C-1′),121.2 (C-6′′),115.9 (C-5′′),111.9 (C-2′′),106.1 (C-3),105.6 (C-2′,6′),105.4 (C-10),100.8 (C-6),95.7 (C-8),87.8(C-8′′),74.5 (C-7′′),62.2 (C-9′′),57.2 (3′,5′-OCH3),56.6(3′′-OCH3).以上数据与文献[12]报道基本一致,故将化合物6鉴定为tricin 4′-O-(erythro-βguaiacy-lglyceryl) ether.
化合物7黄色粉末;ESI-MSm/z:495[M-H]-,C26H24O10;1H NMR (CD3OD-d4,600 MHz)δH: 7.22(2H,d,J=8.5 Hz,H-2′′,6′′),7.16 (2H,s,H-2′,6′),6.73 (2H,d,J=8.1 Hz,H-3′′,5′′),6.65 (1H,s,H-3),6.41 (1H,brs,H-8),6.16 (1H,brs,H-6),4.93 (1H,d,J=5.4 Hz,H-7′′),4.43 (1H,td,J=5.4,3.3 Hz,H-8′′),3.96 (1H,d,J=5.5 Hz,H-9′′),3.94 (6H,s,3′,5′-OCH3),3.68 (1H,dd,J=12.1,3.3 Hz,H-9′′);13C NMR (CD3OD-d4,150 MHz)δC: 183.7 (C-4),170.3(C-7),165.2 (C-2),163.2 (C-5),159.5 (C-9),157.8(C-4′′),154.9 (C-3′,5′),140.4 (C-4′),133.1 (C-1′′),129.1 (C-6′′),127.9 (C-1′),115.7 (C-3′′,5′′),105.8(C-3),105.1 (C-10,2′,6′),100.6 (C-6),95.4 (C-8),87.5 (C-8′′),74.0 (C-7′′),61.8 (C-9′′),56.9 (C-10′′).以上数据与文献[13]报道基本一致,故将化合物7鉴定为calquiquelignan D.
化合物8黄色粉末;ESI-MSm/z:495[M-H]-,C26H24O10;1H NMR (CD3OD-d4,600 MHz)δH: 7.45(1H,d,J=8.4 Hz,H-2′′),7.45 (1H,d,J=8.4 Hz,H-6′′),7.27 (2H,s,H-2′,H-6′),6.76 (1H,d,J=8.3 Hz,H-3′′),6.76 (1H,d,J=8.3 Hz,H-5′′),6.73 (1H,s,H-3),6.49 (1H,s,H-8),6.22 (1H,s,H-6),5.03 (1H,d,J=6.7 Hz,H-7′′),4.29 (1H,m,H-8′′),3.97 (6H,s,3′,5′-OCH3),3.80 (1H,dd,J=12.0,4.0 Hz,H-9′′β),3.40 (1H,dd,J=12.1,3.5 Hz,H-9′′α);13C NMR(CD3OD-d4,150 MHz)δC: 183.5 (C-4),166.7 (C-7),164.9 (C-2),162.9 (C-5),159.3 (C-9),157.9 (C-4′′),154.4 (C-3′,5′),140.7 (C-4′),132.5 (C-1′′),130.9(C-6′′),129.0 (C-2′′),127.8 (C-1′),116.6 (C-3′′),115.6 (C-5′′),105.6 (C-3),105.0 (C-2′,6′),104.8 (C-10),100.3 (C-6),95.1 (C-8),88.6 (C-8′′),74.0 (C-7′′),61.7 (C-9′′),56.7 (3′,5′-OCH3).以上数据与文献[13]报道基本一致,故将化合物8鉴定为calquiquelignan E.
化合物9黄色粉末;ESI-MSm/z:637[M-H]-,C32H30O14;1H NMR (吡 啶-d5,600 MHz)δH: 7.72(1H,s,H-6′),7.59 (1H,s,H-7′′′),7.42 (2H,s,H-2′′′,6′′′),7.36 (1H,s,H-3′),6.83 (1H,s,H-8),6.76 (2H,d,J=11.5 Hz,H-3′′′,5′′′),6.71 (1H,s,H-3),6.57(1H,s,H-6),6.54 (1H,d,J=16.0 Hz,H-8′′′),5.32(1H,d,J=11.8 Hz,H-1′′),4.65 (1H,s,H-6′′),4.24(1H,s,H-6′′),3.92 (3H,s,2′-OCH3),3.91 (3H,s,4′-OCH3),3.81(1H,m,H-5′),3.67 (1H,d,J=2.3 Hz,H-3′′),3.62 (1H,d,J=2.3 Hz,H-2′′),3.55 (1H,s,H-4′′);13C NMR(吡 啶-d5,150 MHz)δC: 183.0 (C-4),167.6 (C-9′′′),165.2 (C-2),164.1 (C-7),163.9 (C-5),160.7 (C-4′′′),158.0 (C-9),149.5 (C-2′),149.0(C-4′),146.1 (C-7′′′),142.4 (C-5′),135.3 (C-2′′′,6′′′),126.4 (C-1′′′),121.1 (C-1′),116.8 (C-3′′′,5′′′),115.0 (C-8′′′),111.2 (C-6′),106.8 (C-10),106.2 (C-3′),104.5 (C-3),101.8 (C-1′′),100.8 (C-6),95.7 (C-8),78.5 (C-3′′),75.7 (C-5′′),74.8(C-2′′),71.7 (C-4′′),64.6 (C-6′′),56.7 (2′-OCH3),55.9 (4′-OCH3).以上数据与文献[14]报道基本一致,故将化合物9鉴定为5,5′-dihydroxy-2′,4′-dimethoxy-flavone-7-Oβ-D-(6′′-O-Z-p-coumaroyl)-glucopyranoside.
化合物10黄色粉末;ESI-MSm/z:417[M-H]-,C21H22O9;1H NMR (吡啶-d5,600 MHz)δH: 8.19 (1H,dd,J=8.9,3.2 Hz,H-5),7.52 (2H,d,J=5.6 Hz,H-2′,6′),7.41 (2H,d,J=5.5 Hz,H-3′,5′),6.92 (1H,dd,J=8.7,1.7 Hz,H-6),6.84 (1H,d,J=1.6 Hz,H-8),5.69(1H,dd,J=7.8,3.0 Hz,H-1′′),5.54 (1H,d,J=13.0 Hz,H-2),4.58 (1H,m,H-6′′),4.40 (4H,m,H-2′′,3′′,4′′,6′′),4.16 (1H,m,H-5′′),3.19 (1H,dd,J=16.4,12.8 Hz,H-3α),2.94 (1H,d,J=16.7 Hz,H-3β);13C NMR (吡啶-d5,150 MHz)δC: 190.6 (C-4),166.8 (C-7),164.5 (C-8a),159.0 (C-6′),133.5 (C-1′),129.78 (C-5),128.7 (C-2′,6′),117.3 (C-3′,5′),114.9 (C-4a),112.1 (C-6),104.1 (C-8),102.3 (C-1′′),80.2 (C-2),79.3 (C-3′′),78.8 (C-5′′),75.2 (C-2′′),71.5 (C-4′′),62.6 (C-6′′),44.8 (C-3).以上数据与文献[15]报道基本一致,故将化合物10鉴定为4 ′-hydroxy-2,3-dihydroflavone 7-β-D-glucopyranoside.
化合物11黄色固体;ESI-MSm/z:539[M-H]-,C28H28O11;1H NMR (CD3OD-d4,600 MHz)δH: 7.03(2H,s,H-2′,6′),6.90(1H,s,H-2′′),6.77 (1H,m,H-6′′),6.75 (1H,s,H-5′′),6.65 (1H,s,H-3),6.45 (1H,s,H-8),6.19 (1H,s,H-6),4.46 (1H,s,H-7′′),4.29(1H,dd,J=11.8,3.2 Hz,H-8′′),3.91 (1H,m,H-9′′),3.86 (6H,s,3′,5′-OCH3),3.85 (3H,s,7′′-OCH3),3.82 (3H,s,3′′-OCH3),3.74 (1H,m,H-9′′);13C NMR (CD3OD-d4,150 MHz)δC: 183.8 (C-4),166.6(C-7),165.2 (C-2),163.2 (C-5),159.4 (C-9),154.7(C-3′,5′),148.8 (C-3′′),147.4 (C-4′′),140.5 (C-4′),131.1 (C-1′′),127.6 (C-1′),122.1 (C-6′′),115.6 (C-5′′),112.2 (C-2′′),105.7 (C-3),105.4 (C-10),104.9(C-2′,6′),100.4 (C-6),95.3 (C-8),86.6 (C-8′′),83.8(C-7′′),61.9 (C-9′′),56.9 (7′′-OCH3),56.8 (3′,5′-OCH3),56.4 (3′′-OCH3).以上数据与文献[16]报道基本一致,故将化合物11鉴定为tricin 4′-O-(threoβ-guaiacyl-(7′′-O-methyl)-glyceryl) ether.
化合物12红色粉末;ESI-MSm/z:285[M-H]-,C15H10O6;1H NMR (丙 酮-d6,600 MHz)δH: 12.23(1H,s,8-OH),7.74 (1H,s,H-4),7.30 (1H,s,H-2),7.26 (1H,d,J=2.4 Hz,H-5),6.63 (1H,d,J=2.4 Hz,H-7),4.78 (2H,s,H-11);13C NMR (丙酮-d6,150 MHz)δC: 191.3 (C-9),182.5 (C-10),168.3 (C-6),166.3 (C-8),163.4 (C-1),153.7 (C-3),136.7 (C-10a),134.5 (C-4a),121.7 (C-2),118.1 (C-4),115.5 (C-9a),110.8 (C-5),109.9 (C-8a),108.9 (C-7),63.8 (C-11).以上数据与文献[17]报道基本一致,故将化合物12鉴定为ω-hydroxyemodin.
化合物13红色粉末;EI-MSm/z:254[M]+,C15H10O4;1H NMR (丙 酮-d6,600 MHz)δH: 12.62(1H,brs,1-OH),8.12 (1H,d,J=8.5 Hz,H-8),7.66(1H,d,J=2.5 Hz,H-5),7.58 (1H,s,H-4),7.29 (1H,d,J=8.5 Hz,H-7),7.12 (1H,s,H-2),2.47 (3H,s,H-11);13C NMR(丙酮-d6,150 MHz)δC: 189.2 (C-9),183.4(C-10),166.8 (C-6),163.6 (C-1),148.1 (C-3),136.2(C-10a),134.5 (C-4a),130.6 (C-8),125.4 (C-8a),124.5 (C-2),122.9 (C-7),120.9 (C-4),115.1 (C-9a),113.5 (C-5),21.9 (C-11).以上数据与文献[18]报道基本一致,故将化合物13鉴定为phomarin.
化合物14橙黄色固体;ESI-MSm/z:329[M-H]-,C17H14O7;1H NMR (DMSO-d6,600 MHz)δH: 13.37(1H,s,8-OH),13.31 (1H,s,6-OH),12.98 (1H,s,2-OH),7.75 (1H,s,H-4),7.10 (1H,s,H-5),3.81(3H,s,1-OCH3),3.79 (3H,s,7-OCH3),2.26 (1H,s,H-3);13C NMR (DMSO-d6,150 MHz)δC: 186.7 (C-9),180.6 (C-10),158.7 (C-6),157.1 (C-8) 156.7 (C-2),147.4 (C-1),140.1 (C-7),131.7 (C-3),128.7 (C-10a),126.0 (C-4),124.1 (C-4a) 124.1 (C-9a),110.2 (C-8a),108.8 (C-5),61.1 (7-OCH3),59.8 (1-OCH3),16.6 (C-3).以上数据与文献[19]报道基本一致,故将化合物14鉴定为aurantio-obtusin.
化合物15和16白色粉末;EI-MSm/z:414[M]+,C29H50O;EI-MSm/z:412[M]+,C29H48O.波谱数据与文献[20]报道基本一致,故将化合物15和16的混合物鉴定为β-谷甾醇和豆甾醇的混合物.
3.2 化合物的抗炎活性结果从表1 可看出,化合物2、3、6、8和14的NO 抑制率IC50值均低于阳性对照药物地塞米松,其中化合物2、3和14显著抑制NO 生成,其IC50值分别为2.74、2.35 μmol/L和3.61 μmol/L,化合物4NO 抑制率与阳性对照药相当,其余化合物与阳性对照药物地塞米松相比均未显示抗炎活性.
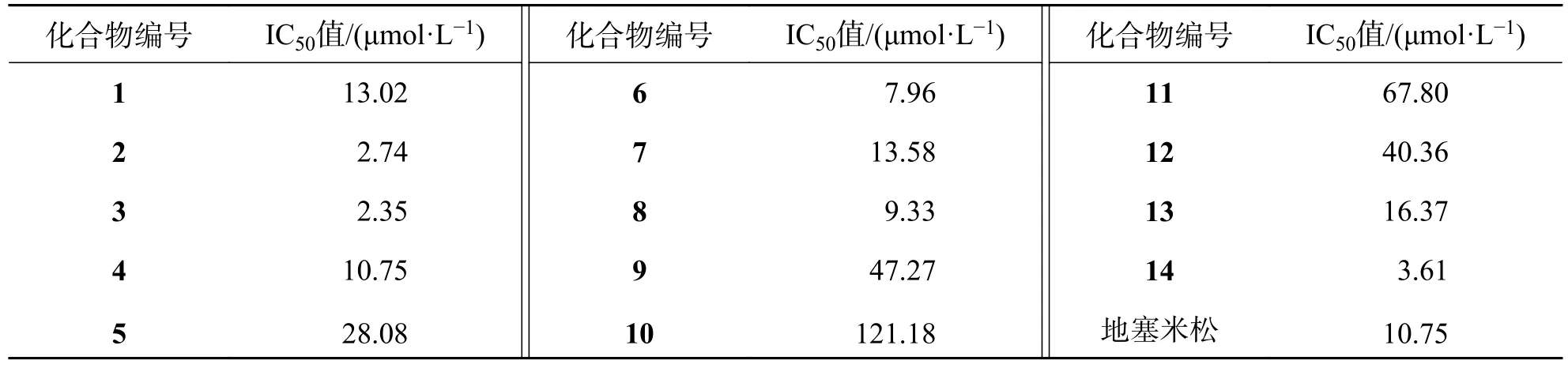
表1 14 个化合物的NO 抑制率IC50 值Tab.1 The NO inhibition rate IC50 of 14 compounds
3.3 讨论综合运用正相、反相硅胶柱色谱、Sephadex LH-20 凝胶柱色谱、半制备液相色谱等色谱方法对药用植物狗牙根的化学成分进行了分离纯化;运用核磁共振和质谱等波谱方法鉴定了16 个化合物,其中除化合物5 外其余化合物均为首次从该植物中分离得到.本文报道的16 个化合物的结构类型包括黄酮类、蒽醌类和甾体类化合物,其中化合物1~11 为黄酮类化合物,化合物12~14 为蒽醌类化合物,化合物15~16 为甾体类化合物.
抗炎活性实验结果表明,化合物2、3 和14 表现出显著的抗炎活性,抗炎活性的构效关系初步分析认为苯环上酚羟基和羟基甲氧基化是影响狗牙根中黄酮类、蒽醌类抗炎活性能力的原因之一[21].实验结果表明狗牙根草中黄酮类化合物和蒽醌类化合物的抗炎活性可能与抑制NO 的生成有关,但化合物的抗炎作用机制还需进一步研究.本文首次揭示了黄酮类化合物和蒽醌类化合物是狗牙根中抗炎活性成分之一,为合理开发狗牙根的药用资源提供了科学依据.

