3例N-甲基-D-天冬氨酸受体和髓鞘少突胶质细胞糖蛋白双抗体阳性脑炎分析
朱 琳, 蒋 , 俞 龙, 吴 健, 殷梦媚, 黄君文, 马灿灿
(扬州大学临床医学院/扬州大学附属苏北人民医院, 1. 神经内科, 2. 老年医学科,3. 影像科, 江苏 扬州, 225000)
髓鞘少突胶质细胞糖蛋白(MOG)是一种中枢神经系统少突胶质细胞和髓鞘表面的蛋白。MOG抗体相关疾病(MOGAD)是一种中枢神经系统炎性脱髓鞘疾病,典型表现为视神经炎、横贯性脊髓炎、脑干脱髓鞘和急性播散性脑脊髓炎[1]。抗N-甲基-D-天冬氨酸受体(NMDAR)脑炎是最常见的自身免疫性脑炎,以癫痫发作、精神症状、行为异常、认知障碍等临床症状为特征[2], 在一部分人群中,抗 NMDAR 脑炎可能与MOGAD相继或同时发生[3-4], 表现出复杂的临床症状,使疾病更加难以识别,这类疾病被称为MOGAD和抗NMDAR 脑炎重叠综合征(MNOS)。NMDAR抗体和MOG抗体双阳性在临床上非常罕见,在抗NMDAR脑炎或MOGAD患者中,双抗体阳性的发生率不足10%[5]。本研究观察3例罕见的MNOS患者的临床表现,旨在增强对MNOS临床谱的认识,以降低误诊率,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析 2021年12月—2023年1月在苏北人民医院神经内科诊治的3例MNOS患者的资料,收集相关临床资料并进行门诊和(或)电话随访。本研究经医院伦理委员会批准并获得患者书面知情同意。
1.2 研究方法
详细登记患者的人口统计学信息,包括性别、发病年龄、体质量指数(BMI)、临床症状、合并肿瘤或其他合并症、影像学指标、检验学指标(脑脊液常规、生化、自身免疫性抗体、血清学检查)、脑电图等资料。随访6~18个月。采用基于细胞转染的间接免疫荧光法(CBA)对自身免疫性脑炎抗体及中枢神经系统脱髓鞘抗体进行检测,患者标本被外送至广州欧蒙医学检验公司、金域检验公司或江苏先声医学诊断有限公司进行检测。
2 结 果
2.1 患者临床特征
3例患者均为男性,发病年龄中位数为30(28, 43)岁,中位BMI为23.10(22.40, 27.44) kg/m2。
2.2 临床病史及特点
3例患者中, 2例出现复发。病例1为复发患者, 2次发病前均无明确感染史,既往有病毒性脑炎史; 病例2发病前有摔伤骨折史, 2年前有MOG抗体阳性的视神经炎病史; 病例3发病前有上呼吸道感染史,发病前4个月接种新型冠状病毒疫苗。
所有患者均发作癫痫。病例1第1次发病出现癫痫、意识水平下降(嗜睡),癫痫表现为全身强直性发作; 2个月后复发,表现为脱髓鞘症状: 左下肢无力伴左上肢麻木、行走不稳、左眼视物模糊、复视。病例2表现为发热、头痛、头晕、视物变形(癫痫发作前)、癫痫(全身强直性发作)。病例3表现为典型的抗NMDAR脑炎,包括癫痫发作(全身强直性发作)、精神行为异常(情绪性格改变、烦躁不安、反应迟钝、幻听幻视)、近事记忆力障碍、言语障碍(缄默、不能正常交流)、发热。
2.3 脑脊液分析
2.3.1 脑脊液常规检测: 脑脊液检查中,3例患者脑脊液均轻度异常,均出现细胞数量轻度增高[(11~38)× 106/L], 以单核细胞为主; 脑脊液压力除病例3外均轻度升高; 仅病例1复发时脑脊液蛋白水平出现轻度增高。所有患者急性期及复发期脑脊液葡萄糖、氯化物含量均正常,脑脊液病毒、细菌、结核菌涂片及真菌检测结果均为阴性,见表1。
2.3.2 特异性抗体: 3例患者均存在脑脊液NMDAR抗体、血清MOG抗体阳性。病例1第1次发病时表现为脑脊液NMDAR抗体阳性、病原学检测阴性,复发时出现MOG抗体。病例2脑脊液NMDAR抗体和血清、脑脊液MOG抗体同时阳性,脑脊液IgG-寡克隆区带(OB)阳性。病例3 NMDAR抗体和MOG抗体同时出现阳性,治疗后2周复查结果显示脑脊液NMDAR抗体转阴,但血清MOG抗体滴度并未减低(1∶1 000)、脑脊液MOG抗体阳性(1∶1+)。血清及脑脊液中其他自身免疫性脑炎抗体、脱髓鞘抗体谱均为阴性,见表1。
2.4 其他实验室检查
病例3患者甲状腺功能轻微异常,血清游离甲状腺素(FT4)稍微升高,其余2例患者甲状腺功能均正常。所有患者甲状腺相关抗体、肿瘤标志物筛查结果均为阴性。
2.5 影像学检查
3例患者头颅磁共振成像(MRI)均存在幕上病灶,且病灶主要存在于幕上脑组织,在T2液体衰减反转恢复序列(T2-FLAIR)成像上均显示高信号(见图1),其中单侧病灶2例,双侧病灶1例。病例1第1次发病头颅MRI未见病灶,头颅磁共振动脉自旋标记灌注成像技术(ASL)显示右侧额叶、左后部大脑镰区灌注增高; 复发时头颅MRI检查可见左侧半卵圆中心及两侧脑室后角旁、脑干、四脑室旁类圆形及斑片状长T1信号影,弥散加权成像(DWI)呈低信号,T2-FLAIR呈高信号,呈“煎蛋征”改变,增强可见病灶中心明显强化; ASL显示,左后部大脑镰区灌注增高,左侧额顶颞枕叶及右侧小脑半球脑血流量(CBF)灌注稍减低。病例2头颅MRI检查显示,右侧颞叶皮层异常信号,存在脱髓鞘可能,片状长T1、长T2信号影, T2-FLAIR、表观弥散系数(ADC)为高信号, DWI呈等信号或略高信号,增强后未见明显强化; ASL显示,两侧大脑及小脑皮层呈弥漫性高灌注,以右侧最为显著,见图2。病例3发病初期头颅MRI未显示病灶,病程中显示右侧额叶及胼胝体压部斑片状T2-FLAIR高信号; 发病初期头颅ASL见两侧额颞叶、岛叶、海马高灌注,治疗后显示原颅内弥漫性灌注增高区基本好转,其余左侧额颞叶CBF轻度增高。患者脑电图表现为正常或轻度异常,主要表现为慢波。
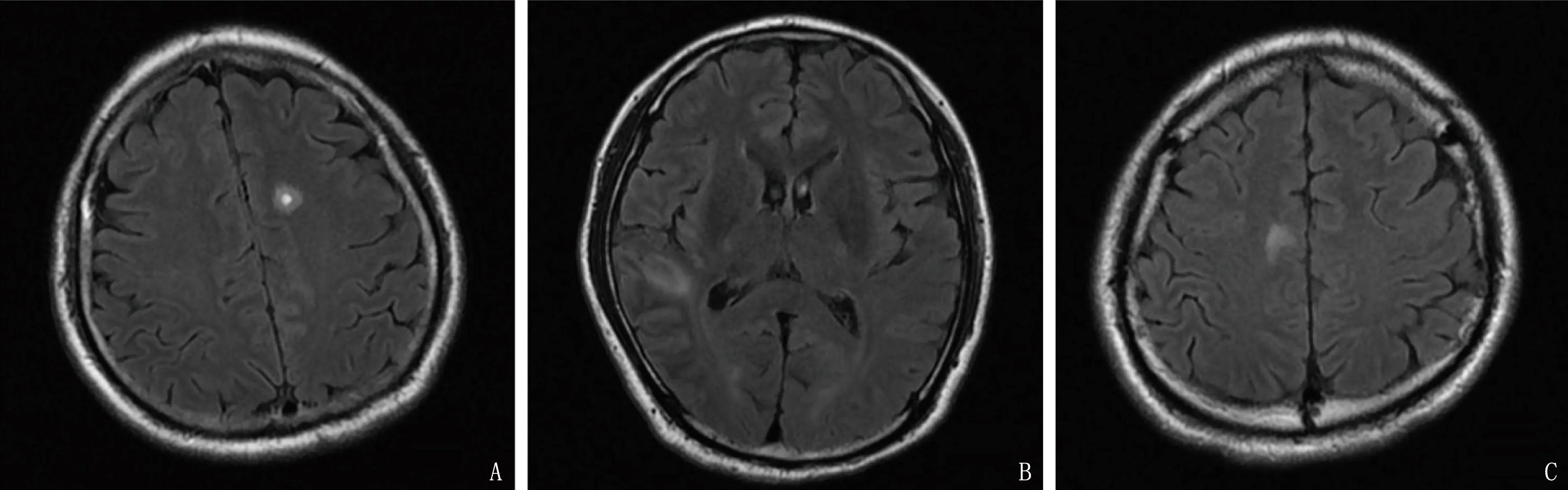
A: 病例1左侧半卵圆中心; B: 病例2右侧颞叶皮层; C: 病例3右侧额叶见T2-FLAIR高信号。
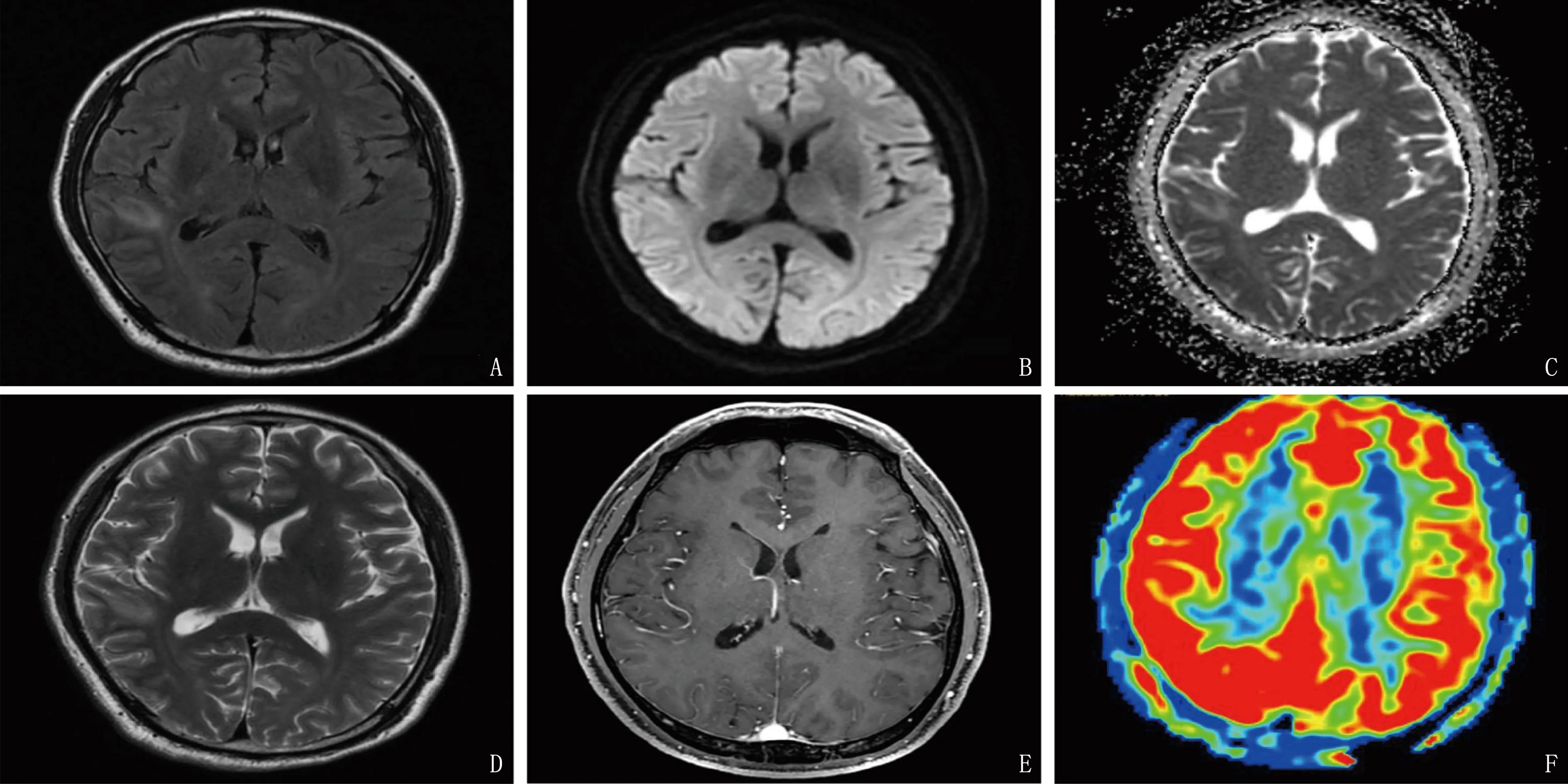
A: 右侧颞叶皮层 T2-FLAIR高信号; B: DWI呈等信号或略高信号; C: ADC高信号; D: T2加权高信号; E: 增强未见明显强化; F: ASL显示两侧大脑弥漫性高灌注,右侧最为显著。
2.6 治疗及结局
所有患者均接受了一线免疫抑制治疗(大剂量激素或丙种球蛋白0.4 g/kg静脉点滴,共治疗5 d), 同时给予抗癫痫、控制精神症状或调节情绪等对症支持治疗。病例2因既往使用激素后出现股骨头坏死,此次发病未使用激素。病例1、病例2出院后继续口服吗替麦考酚酯。所有患者经免疫治疗后症状基本完全好转。
2.7 预后随访
3例患者中有2例患者出现复发。病例 1 第1次发病脑脊液NMDAR 抗体滴度1∶10, 此次发病后2个月后复发,复发时脑脊液MOG抗体滴度为1: 32, 血清抗体滴度为1∶100。随访至今,患者主诉记忆力减退[大专学历,简易精神状态量表(MMSE)评分为29分、蒙特利尔认知评估量表(MoCA)评分为21分],未再出现癫痫发作,视力恢复可,肢体麻木、无力状况好转,复查头颅MRI结果显示,未见明显病灶。病例2于2年前第1次发病,血清MOG抗体滴度1∶100, 1年前复测血清MOG抗体转阴,遗留股骨头坏死,此次发病后随访至今,患者未出现癫痫发作,无其他不适症状,未再复查NMDAR及MOG抗体滴度,复查头颅MRI结果显示,原右侧颞叶皮层异常信号未见显示。病例3此次发病治疗后2周复查脑脊液NMDAR抗体转阴,血清MOG抗体滴度并未减低,出院后3个月复查血清MOG抗体阴性,患者出院后未出现癫痫发作,无精神行为异常,记忆力和言语交流正常,复查头颅MRI未见病灶。
3 讨 论
抗 NMDAR 脑炎患者可同时或相继出现脱髓鞘疾病的临床和(或)MRI特征,而脱髓鞘疾病患者出现如精神症状、认知障碍等不典型的症状时,提示存在疾病重叠的可能[4]。本研究中, 3例MNOS男性患者临床表现各有特点,且较为罕见。MOG-IgG和NMDAR-IgG可能共存,因为自身抗原共同表达于少突胶质细胞表面,免疫细胞在靶向少突胶质细胞时可能攻击MOG和NMDAR的抗原,随后在脑脊液和血清中产生相应抗体[6]。因此,一种新的MOG和NMDAR抗体共存的概念被称为MNOS。事实上,最近病例报道同时存在MOG和NMDAR 抗体[7-8]。MNOS目前病因和发病机制尚不明确,可能系嗜神经病毒感染触发[9], 肿瘤不太可能是MNOS的触发因素,因为既往报道以及本研究MNOS患者均未发现肿瘤[10]。
据报道, 1.7%~2.7%的抗NMDAR脑炎患者中存在重叠的MOGAD[4, 8, 11]。抗NMDAR脑炎主要症状包括认知功能障碍、精神障碍、癫痫发作、运动障碍、意识下降、言语障碍、自主神经功能障碍和大脑皮层受损导致的中枢性低通气[2]。与经典的抗NMDAR脑炎相比, MNOS除了表现出抗NMDAR脑炎的主要症状外,还表现出肢体无力、感觉障碍、视觉障碍等非典型症状[7]。肢体无力是MNOS患者最常见的非典型症状[10]。本组病例1复发时出现肢体麻木无力、视物模糊、复视等非典型症状,但患者初次发病时表现为癫痫发作、嗜睡,被误诊为单纯的抗NMDAR脑炎。因此,当抗NMDAR脑炎患者出现累及视神经和脊髓的症状(如视力下降、肢体运动或感觉障碍等)时,应考虑MOGAD共存。
脱髓鞘疾病的非典型临床表现包括发热、癫痫、头痛以及大脑皮层症状,如失语、精神障碍和记忆障碍,而这些非典型症状在MOG抗体相关脑皮质脑炎(CCE)中较常见[12]。本研究病例2患者同时出现MOG抗体相关CCE和抗NMDAR脑炎,表现为发热、头晕、头痛、视物变形、癫痫发作。已有报道[13]表明, MOG抗体相关CCE可共存抗NMDAR脑炎。MOG抗体相关CCE是MOGAD的一种罕见临床表型[14], 此概念最早由OGAWA R等[15]报道。MOG抗体相关CCE最突出的临床表现为癫痫发作,约82.6%的患者出现癫痫发作[12], 其他临床特征包括发热、头痛、脑病、局灶性皮质特征等[12, 14]; 头颅MRI表现为单侧或双侧的皮质T2-FLAIR高信号[14], 累及大脑皮层和脑沟,但不累及皮层下和深部白质,部分存在软脑膜强化,常见颅内压增高,脑脊液细胞增多伴蛋白水平升高[15]。本组病例2患者头颅MRI提示,右侧颞叶皮层出现异常信号,符合MOG抗体相关CCE影像学特征。发热、头痛、癫痫发作等症状在病毒性脑炎、抗NMDAR脑炎中很常见,但此类不典型的临床特征和脑脊液改变常使得MNOS患者在发病早期被误诊。因此,对于怀疑有中枢神经系统脱髓鞘疾病或抗NMDAR脑炎的患者,建议同时检测病毒、自身免疫性脑炎抗体和中枢神经系统脱髓鞘抗体。
病例2患者血清MOG抗体滴度较低(1∶10), 因此应谨慎出现假阳性结果的可能。但据报道[16], 低滴度阳性的MOG-IgG在正确的临床背景下(如脑炎患者)是有意义的。此外,单侧皮质脑炎急性发作的患者被认为具有较高的MOGAD前瞻性预测概率和较低的假阳性MOG-IgG结果风险[17]。因此,推测在本研究病例中,MOG-IgG假阳性的潜在风险可能相对较低。总之,对于表现为发热、头痛、癫痫发作及单侧皮质MRI检查异常信号的脑炎患者,应尽早进行自身免疫性脑炎抗体和MOG抗体的同时测定,以免漏诊。
MOG和NMDAR两种抗体相关症状在MNOS中可同时或先后出现。大部分MNOS患者最先出现抗NMDAR脑炎相关症状,如认知行为异常、认知功能下降、癫痫等[18]。这是否与第1次发病时的突出表型(抗NMDAR脑炎)有关,目前尚不清楚,需进一步研究及长期随访。本组病例3患者MOG-IgG和 NMDAR-IgG 同时阳性,但临床症状主要表现为抗 NMDAR脑炎症状,这可能归因于重叠的抗NMDAR脑炎。未来的研究将确定两种抗体(MOG-IgG和NMDAR-IgG)如何相互作用来发挥致病作用。
抗NMDAR脑炎患者头颅MRI多正常或表现为轻微、短暂和非特异性的异常信号,主要为T2-FLAIR高信号,通常累及大脑和海马的皮质和皮质下区域,但有时会影响基底节[9]。MOGAD患者头颅MRI检查可见大的、多灶同时累及小脑幕上和幕下白质、深层灰质尤其基底节和丘脑的病灶,少数患者表现为单发孤立的大病灶; 累及视神经时可见双侧视神经的明显强化,脊髓受累表现为长节段横断性脊髓病灶[9]。既往报道[3, 19]显示, MNOS患者多为幕上病变,包括内侧颞叶、海马、胼胝体、基底节区、丘脑、下丘脑,少数为幕下和脊髓病变[10], 本研究病例也有同样的变现。WANG M等[18, 20]发现在抗NMDAR脑炎期间,尚未发生脱髓鞘临床或血清学(即MOG-IgG的存在)迹象的情况下,单侧、幕上病灶更为多见,且未见脊髓内病变,而脱髓鞘发作时的MRI检查显示Gd增强、双侧、幕下和脊髓病变更常见。本研究纳入的患者均存在幕上病灶,单侧病灶多见,可累及脑干,未见脊髓病灶。MOG-IgG的检测通常与临床脱髓鞘事件有关,本研究病例在复发时(即临床恶化的第2次发作时), MRI上的脱髓鞘病变与MOG-IgG同时被检测。因此在临床或影像学表现为脱髓鞘的患者中, MOG-IgG检测可能是合理的。
大剂量糖皮质激素和静脉注射免疫球蛋白(IVIg)是主要的治疗手段,大多数MNOS患者在急性期对一线免疫治疗反应良好[3, 18]。尽管抗NMDAR脑炎和脱髓鞘疾病的初始类固醇治疗方法相似,但后续治疗和预后不同。病例1最初表现为抗NMDAR脑炎,仅予以一线免疫治疗,但不久后复发出现脱髓鞘发作,再次予以一线免疫治疗和吗替麦考酚酯维持治疗后转为无症状,目前预后良好。病例3予以一线免疫治疗后症状好转,目前未复发。因此尽早正确识别MNOS有助于改善患者临床预后。同时,针对这些疾病的治疗方案也不尽相同,例如抗NMDAR脑炎往往需要针对突出的精神症状、认知功能障碍等进行针对性治疗和康复,而存在癫痫发作的患者则需要针对性抗癫痫治疗。研究[21]认为,MNOS患者对一线免疫治疗的反应倾向于MOGAD患者。当MOG抗体与NMDAR抗体共存时,可能由于MOG抗体的存在,使得抗NMDAR脑炎对一线免疫治疗的反应更好。虽然急性期MNOS患者对糖皮质激素和IVIg治疗效果好,但因存在更高的复发风险,对一线治疗的反应可能更多变[22]。抗NMDAR脑炎的复发率为4%~26%, MOGAD的复发率为60%~90%, 而MNOS的复发率更接近于MOGAD[18]。因此, MOG抗体可能在MNOS复发中发挥重要作用。
《中国自身免疫性脑炎诊治专家共识(2022年版)》指南[2]指出,针对自身免疫性脑炎,一线免疫治疗效果不佳或复发病例可使用二线免疫治疗(利妥昔单抗与静脉使用环磷酰胺)或长期(维持)免疫治疗(吗替麦考酚酯与硫唑嘌呤,主要用于复发病例), MNOS患者亦如此。研究[18]表明, MNOS患者复发后免疫治疗仍有效。对MNOS进行免疫治疗后,部分患者NMDAR及MOG滴度随临床好转而下降。然而,目前尚不清楚滴度的变化主要由强化免疫治疗方案或是临床病程的发展引起,且患者复发与初始抗体滴度水平是否有关尚未有相关报道,未来可针对性进行进一步研究。
既往此类疾病报道[3, 23]显示其在儿童中多见,成人少见,本研究病例均为成年男性,且临床表型罕见,因此,本研究病例具有较高的报道价值。由于MNOS疾病罕见,其本研究纳入的病例数较少,且均为成人患者,可能存在一定偏倚。回顾性分析存在一定局限性,影响了抗体检测的可获得性。CBA法检测抗体是近年才出现的检测方法,但由于技术的限制,本研究可能忽略了患者既往病史。
综上所述, MNOS患者中抗NMDAR脑炎可同时或相继出现脱髓鞘疾病的临床和(或)MRI特征,且患者临床表现复杂多样,不典型症状更要求增强对MNOS的认识,尽早识别和及时治疗。

