新疆葡萄酒中的酚类物质对LO2细胞自噬的影响
王妍凌,陈杉彬,赵文梅,尹丽萍,黎进雪,张海鹏,张金萍,黄翠,吕嘉伟,武运*,薛洁*
1(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐,830052) 2(中国食品发酵工业研究院有限公司,北京,100015)3(国家酒类品质与安全国际联合研究中心,北京,100015)
葡萄酒是单种或多种葡萄进行发酵后产生的天然酒精型饮品[1],含有多酚、氨基酸、维生素等活性物质[2]。其中多酚类物质含量最为丰富[3]。目前检测的葡萄酒中酚类物质主要包括黄烷-3-醇类、黄酮醇类、对羟基苯甲酸类、对羟基肉桂酸类等[4]。杨志伟等[3]检测出葡萄酒中含有29种单体酚类物质。一些单体酚类物质已经被报道具有一定的功能活性[5]。如儿茶素具有抗氧化、抗炎的功能[6]、槲皮素具有抗氧化、抗增殖、抗炎、保肝等作用[7]、山奈酚具有心脏保护、神经保护、抗炎、抗糖尿病、抗氧化、抗菌、抗肿瘤和抗癌等活性[8]。由于葡萄酒中多酚类物质的种类和含量受到葡萄原料及酿造工艺、产区经纬度的影响[9],因此,相当一部分葡萄酒中的多酚类物质带有产区特征。新疆葡萄酒是我国葡萄酒中不可或缺的一部分,为了分析其产区特点,本课题前期对其进行检测发现水杨酸、芥子酸、橙皮苷、表儿茶素没食子酸酯在新疆葡萄酒中含量较高[10]。研究表明橙皮苷具有抗氧化、抗炎和预防内质网应激和DNA损伤的作用[11]。水杨酸、芥子酸具有一定的抗氧化活性[10],其他生物活性尚未报道。表儿茶素没食子酸酯是儿茶素中的一种单体,目前报道较多是表没食子儿茶素没食子酸酯,而关于表儿茶素没食子酸酯功效的报道较少[12-13]。
细胞自噬是指由自噬相关基因介导,在细胞内形成一种双层膜结构包裹待降解物,并将其运送到溶酶体通过膜融合形成自噬溶酶体,由自噬溶酶体中的一系列水解酶消化包裹待降解底物,以此来支持细胞自身代谢和某些细胞器更新的过程[14]。此过程高度保守,细胞自噬的异常与多种疾病发生发展密切相关[15]。如自噬可以通过调节脂肪生成、脂肪分解、蛋白聚集体和RNA降解,参与神经退行性疾病、代谢性疾病、心血管疾病、癌症等疾病的发生、发展[16]。同时自噬在一些肝脏疾病[如病毒性肝炎、酒精性肝病、非酒精性肝病、急性肝损伤、与α1-抗胰蛋白酶(α-1-antitryp sin,AT)缺乏相关的肝病、肝纤维化]中也具有一定的保护作用[17-18]。因此,自噬常被应用于分析物质活性功能以及调节细胞自噬的药物筛选[19-20]。
本研究利用LO2细胞,基于细胞自噬的活性变化分析了新疆葡萄酒中水杨酸、芥子酸、橙皮苷、表儿茶素没食子酸酯4种单体酚类物质对人源正常肝细胞的影响,为具有肝脏保护性的天然来源的功能物质筛选、葡萄酒加工工艺提升、葡萄酒品质提高以及葡萄酒相关产品开发提供理论依据和新的思路。
1 材料与方法
1.1 材料与试剂
橙皮苷、表儿茶素没食子酸酯、芥子酸,水杨酸,上海源叶生物科技有限公司;RPMI-1640培养基(roswell park memorial institute 1640,RPMI-1640),美国Gibco公司;EBSS培养基(Earle′s balanced salts, EBSS),0.25%胰蛋白酶,美国Sigma-Aldrich公司;BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司;胎牛血清、链霉素、青霉素,美国Hyclone公司;CCK-8溶液(cell counting Kit-8, CCK-8),日本Dojindo Molecular Technologies公司;磷酸盐缓冲液(phosphate buffered solution, PBS)、聚偏氟乙烯 [poly(vinylidene fluoride),PVDF]膜、TBST清洗液(TBS-T buffer, TBST)、4′,6-二脒基-2苯(4′,6-diamidino-2-phenylindole, DAPI)、微管相关蛋白1A/1B-轻链3(microtubule-associated proteins 1A/1B light chain3,LC3),美国Sigma-Aldrich公司;螯合体1(sequestosome 1, P62),日本Medical&Biological Laboratories公司;GAPDH,美国Cell Signaling Technology公司;Eastep®Super总RNA提取试剂盒、GoScriptTMReverse Transcription System,上海普洛麦格生物产品有限公司。
1.2 仪器与设备
YXQ-50G立式灭菌锅,上海博迅生物仪器股份有限公司;Spectra Max®i D3多功能酶标仪,美国Molecular Devices公司;LEGEND Micro 21R微量台式离心机,美国赛默飞公司;Chenmi Scope 6200 Touch化学发光成像系统,上海勤翔科学仪器有限公司;THUNDER Imager 3显微成像系统,德国Leica公司;Applied Biosystems 7500型定量PCR仪,美国应用生物系统公司;DxFLEX流式细胞仪,美国贝克曼库尔特公司。
1.3 实验方法
1.3.1 细胞培养
LO2细胞采用高糖RPMI-1640培养基培养,并添加质量分数10%的胎牛血清,100 U/mL青霉素和100 μg/mL链霉素,培养条件为37 ℃、5% CO2。当细胞生长至85%融合度左右时,使用质量分数0.25%胰蛋白酶消化后传代。
1.3.2 细胞存活率试验
接种2.0×104/孔LO2细胞于96孔板中,培养24 h后,用不同酚类物质处理24 h后,进行细胞增殖试验检测细胞增殖能力,加入CCK-8溶液10 μL/孔,孵育2 h,酶标仪测定450 nm处吸光度值,计算各组细胞的存活率。
1.3.3 实时荧光定量分析
以1.6×105/孔的接种量接种LO2细胞于6孔板中,培养24 h后,分为营养(nutrition)和饥饿(starvation)处理组。营养处理组分别为:浓度为0、100 μmol/L橙皮苷(hesperidin, HDN)+完全培养基(RPMI-1640培养基),浓度为0、50 μmol/L表儿茶素没食子酸酯[(-)-epicatechin gallate, ECG]+完全培养基,分别处理LO2细胞24 h,橙皮苷用N0、N100-HDN表示,表儿茶素没食子酸酯用N0、N50-ECG表示;饥饿处理组为:浓度为0、100 μmol/L橙皮苷+完全培养基,浓度为0、50 μmol/L表儿茶素没食子酸酯+完全培养基处理LO2细胞22 h后,浓度为0、100 μmol/L橙皮苷+饥饿培养基(EBSS),浓度为0、50 μmol/L表儿茶素没食子酸酯+饥饿培养基,分别处理LO2细胞2 h,橙皮苷用S0、S100-HDN表示,表儿茶素没食子酸酯用S0、S50-ECG表示(实验分组同免疫荧光、流式细胞分析)。用Eastep®Super总RNA提取试剂盒提取LO2细胞总RNA。使用GoScriptTMReverse Transcription System将样品中总RNA转换为互补DNA(cDNA)。用特定的引物扩增目的基因,引物合成由上海生工生物工程股份有限公司完成(表1)。定量分析采用AceQ®qPCR SYBR Green Master Mix和7500实时聚合酶链式反应系统进行实时定量聚合酶链式反应。以人GAPDH作为内参基因,通过(2-ΔΔCt)法计算各组样品中目的基因的mRNA的相对表达量。

表1 实时荧光定量分析中使用的引物序列Table 1 Primer sequence used in real-time fluorescence quantitative analysis
1.3.4 蛋白印迹分析
以1.6×105/孔接种LO2细胞于6孔板中,不同酚类物质处理22 h,饥饿处理2 h后,预冷PBS清洗3次,用含有蛋白酶抑制剂的裂解缓冲液裂解LO2细胞,4 ℃,12 000×g离心15 min,取上清液,使用BCA蛋白质测定试剂盒测定蛋白质浓度。加入5×样品缓冲液混匀。98 ℃加热10 min后,进行SDS-PAGE。电泳结束后将蛋白质转移到PVDF上,使用封闭缓冲液中室温封闭1 h后,4 ℃下分别与抗兔LC3一抗孵育过夜。TBS清洗液(TBS-T buffer, TBST)清洗3次,每次10 min,再用辣根过氧化物酶标记的山羊抗兔二抗孵育40 min后,TBST清洗3次,每次10 min,最后,进行显色和拍照,并用Image J软件进行定量分析和比较。
1.3.5 免疫荧光分析
以1.6×105/孔接种LO2及稳定表达GFP-LC3-RFP-LC3的LO2细胞于6孔板中,表儿茶素没食子酸酯、橙皮苷处理22 h,饥饿处理2 h后,PBS洗2次,4%多聚甲醛室温固定15 min,PBS洗3次,含有0.5% Triton X-100的PBS室温透膜20 min,含有1% BSA的PBS室温封闭1 h,PBS洗3次,用含有DAPI的抗荧光淬灭剂封片,荧光显微镜下观察LC3的表达强度及定位。
1.3.6 流式细胞分析
以1.6×105/孔接种稳定表达GFP-LC3-RFP-LC3的LO2细胞于6孔板中,培养24 h后,表儿茶素没食子酸酯、橙皮苷处理24 h后饥饿处理2 h,PBS清洗3次,200 μL胰酶/well消化3 min,加入1 mL带有血清的1640培养基中和,冰PBS清洗2次,加入200 μL冰PBS轻轻重悬细胞,每组计数5 000个细胞,进行测样。
1.4 数据统计与分析
用SPSS 20分析处理数据,所有实验数据均为3次平行试验的平均值,用平均值±标准误表示,进行单因素方差分析(ANOVA),P<0.05时差异显著,具有统计学意义;图表由Origin 2021 Pro、Kaluza Analysis 2.1绘制。
2 结果与分析
2.1 不同酚类化合物对LO2细胞存活率的影响
为探究不同酚类物质对LO2细胞的影响作用,分别将不同浓度的表儿茶素没食子酸酯0、25、50、100 μmol/L、橙皮苷0、50、100、200 μmol/L、芥子酸0、25、50、100 μmol/L、水杨酸0、25、50、100 μmol/L作用于LO2细胞,24 h后测定细胞增殖活性,结果如图1所示。与对照组相比,表儿茶素没食子酸酯作用LO2细胞后,随着浓度的升高,细胞存活率显著降低(P<0.01);橙皮苷作用LO2细胞后,在50、100 μmol/L,细胞存活率显著升高(P<0.05),在200 μmol/L时,细胞存活率显著降低(P<0.01);芥子酸作用LO2细胞后,细胞存活率呈增长趋势,在25、50 μmol/L时,差异具有显著性(P>0.05);水杨酸作用LO2细胞后,细胞存活率呈增长趋势,在50 μmol/L,细胞存活率显著升高(P>0.05)。综上所述,根据上述酚类物质对LO2细胞存活率的影响,橙皮苷、芥子酸、水杨酸选取50、100 μmol/L,表儿茶素没食子酸酯选取25、50 μmol/L,进行后续实验。

a-表儿茶素没食子酸酯;b-橙皮苷;c-芥子酸;d-水杨酸图1 不同浓度酚类物质对细胞活力的影响
2.2 不同酚类化合物对LC3蛋白表达的影响
LC3蛋白是目前广泛使用的观察和评价细胞自噬活性的标志性蛋白[21]。在自噬小体双层膜的形成过程中,细胞质中的LC3-I通过2个连续的泛素化反应与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)结合,转变为LC3-Ⅱ。在自噬小体与溶酶体融合的过程中,自噬小体内的LC3-Ⅱ也被溶酶体蛋白酶降解。因此细胞内LC3-Ⅱ的动态水平变化与自噬活性密切相关[22]。免疫印迹是监测LC3变化的基础方法[23]。
本研究用酚类物质分别处理LO2细胞24 h后,通过免疫印迹法检测LO2细胞中LC3蛋白表达情况。结果如图2所示。在营养与饥饿条件下,与对照组相比,表儿茶素没食子酸酯作用细胞后LC3蛋白水平显著升高(P<0.05),分别升高了10.2%~32%、263%~294%;橙皮苷作用细胞后LC3蛋白水平显著升高(P<0.05),分别升高了5.8%~105%、80.5%;芥子酸处理细胞后,细胞中LC3蛋白水平显著升高(P<0.05),分别升高了19%~30%、93.5%~102%,但在营养和饥饿条件,细胞中LC3蛋白水平有随着芥子酸浓度升高而降低的趋势;水杨酸处理细胞后,细胞中LC3蛋白水平LC3蛋白水平显著升高(P<0.05),分别升高了27.9%~51%、15.9%~21.6%,但在营养和饥饿条件,细胞中LC3蛋白水平有随着水杨酸浓度升高而降低的趋势。综上所述,表儿茶素没食子酸酯和橙皮苷作用细胞后,LC3蛋白水平差异较为明显,对细胞自噬的影响较为显著,提示表儿茶素没食子酸酯和橙皮苷对细胞自噬可能具有一定的促进作用,因此,选取表儿茶素没食子酸酯、橙皮苷进行后续的试验。

a-表儿茶素没食子酸酯;b-表儿茶素没食子酸酯LC3/GAPDH;c-橙皮苷;d-橙皮苷LC3/GAPDH;e-芥子酸;f-芥子酸LC3/GAPDH;g-水杨酸;h-水杨酸LC3/GAPDH图2 不同浓度酚类物质对LC3蛋白表达的影响
2.3 不同酚类物质对LC3、P62蛋白mRNA水平的影响
目前免疫印迹对于LC3蛋白的检测并不总能检测到LC3-I蛋白,因此LC3蛋白基因的表达结合蛋白质含量分析是非常必要的[24-25]。除了自噬标志蛋白LC3,P62蛋白(SQSTM1/Sekeestome 1)也常被用来观察细胞自噬的活性,当细胞自噬被激活时,P62蛋白表达水平显著降低,提示自噬通量的增加[26]。
本研究为了进一步探索表儿茶素没食子酸酯、橙皮苷对细胞自噬的影响,检测了表儿茶素没食子酸酯、橙皮苷对自噬相关蛋白LC3和P62蛋白mRNA相对表达水平的影响。结果如图3所示,经表儿茶素没食子酸酯、橙皮苷处理后,营养条件和饥饿条件下的LC3蛋白mRNA表达水平都随着表儿茶素没食子酸酯、橙皮苷浓度的增加而显著升高(P<0.05),同时,P62蛋白表达水平都随着表儿茶素没食子酸酯、橙皮苷浓度的增加而显著降低(P<0.05)。与免疫印迹结果较为一致。说明表儿茶素没食子酸酯、橙皮苷一定程度上能促进肝细胞自噬。
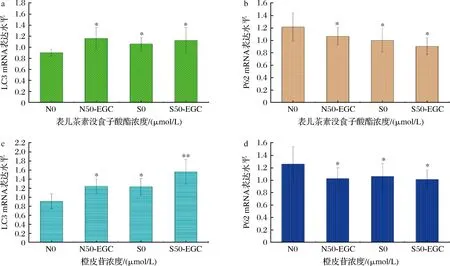
a-表儿茶素没食子酸酯LC3 mRNA表达水平;b-表儿茶素没食子酸酯P62 mRNA表达水平;c-橙皮苷LC3 mRNA表达水平;d-橙皮苷P62 mRNA表达水平图3 表儿茶素没食子酸酯、橙皮苷对LC3、P62蛋白mRNA水平的影响
2.4 不同酚类物质对绿色荧光蛋白(green fluorescent protein, GFP)-LC3、红色荧光蛋白(red fluorescent protein, RFP)-LC3表达的影响
LC3是一种自噬体膜蛋白,在自噬发生时部分LC3被转运到自噬溶酶体内,随着自噬的进行,自噬溶酶体内的LC3蛋白会被降解,提示自噬过程的完成[27]。因此,本研究制备了GFP和RFP共同标记的LC3,GFP蛋白对溶酶体酸性环境敏感,易随着LC3被迅速降解掉;而RFP蛋白则难以被溶酶体降解。因此观察GFP与RFP荧光比值变化,能够精确评估自噬通量的强弱。当自噬被激活时,可以观察到的GFP-LC3和RFP-LC3荧光强度增强,GFP/RFP荧光强度比值降低[20,28]。
为进一步验证表儿茶素没食子酸酯、橙皮苷对细胞自噬的调控作用,使用表儿茶素没食子酸酯、橙皮苷处理稳定表达GFP-LC3-RFP-LC3的LO2细胞24 h后,固定细胞,利用激光共聚焦显微镜观察GFP-LC3、RFP-LC3细胞亚定位,并利用流式细胞仪检测红绿荧光强度。结果如图4-a、图4-b所示,与对照组比较,表儿茶素没食子酸酯、橙皮苷处理细胞后,GFP-LC3和RFP-LC3荧光强度增强,LC3蛋白被招募至自噬体表面,细胞内形成大量自噬体。流式细胞术检测各组细胞中GFP和RFP的荧光强度,结果如图5所示,表儿茶素没食子酸酯、橙皮苷处理LO2细胞24 h后,GFP/RFP比值减小,提示GFP与其标记的LC3被自噬溶酶体降解,而RFP未被显著降解。综上所述,表儿茶素没食子酸酯、橙皮苷具有调控肝细胞自噬活性,诱导细胞自噬发生、发展并成熟的生物活性。
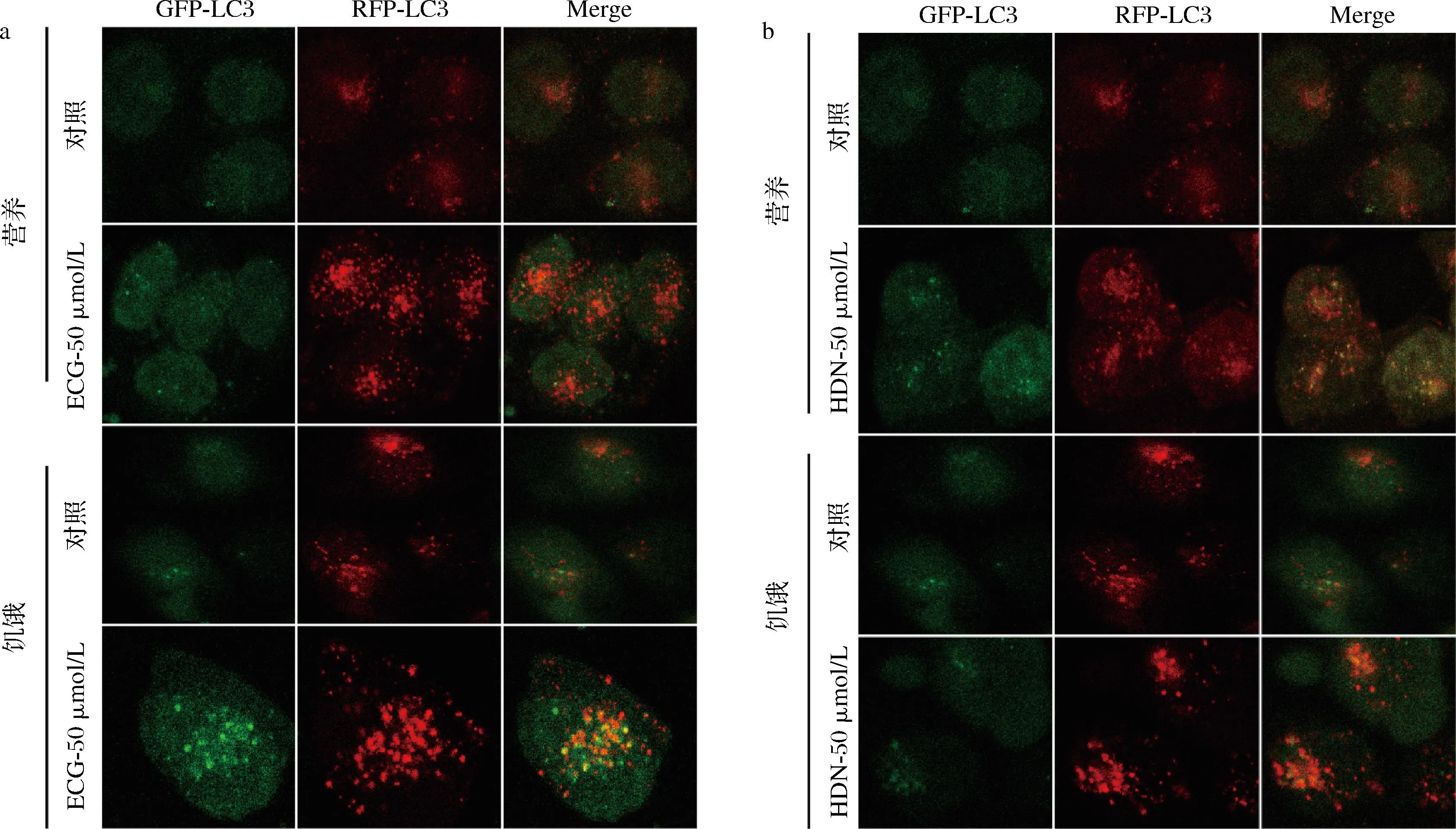
a-表儿茶素没食子酸酯LC3荧光强度;b-橙皮苷LC3荧光强度图4 免疫荧光分析表儿茶素没食子酸酯、橙皮苷对LC3蛋白表达水平的影响
3 讨论
肝脏是体内代谢和解毒内源、外源物质的重要功能的器官[29]。肝脏对血浆和饮食成分变化非常敏感,具有强大的自噬活性,能在各种应激条件下被激活[30,17],自噬被认为是各种压力条件下利于生存的一种机制[31]。动物实验表明橙皮苷能通过增加LC3-Ⅱ蛋白表达水平,降低P62蛋白表达水平,提高自噬活性,以此缓解缺氧状态下造成的大鼠肝脏损伤[32]。本研究进一步利用人源的正常肝细胞,在细胞水平观察橙皮苷是否可调控人源肝细胞的自噬活性。结果发现,橙皮苷也可上调人源肝细胞的自噬活性。因细胞自噬的激活还受到自噬相关蛋白1抗体(unc-51-like kinase 1, ULK1)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTORC1)、AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)等上游信号通路的调节[33]。因此,橙皮苷的具体作用机制还需要进一步深入研究。除橙皮苷外,表儿茶素没食子酸酯的LC3、P62蛋白也有相似的变化,因此,推测表儿茶素没食子酸酯或具有保肝活性,或可开发为一种辅助缓解肝脏损伤的药物,但防治肝损伤的机制涉及多个方面[34],目前关于表儿茶素没食子酸酯对肝脏和自噬的影响还没有较多的报道,后期可继续开展动物和细胞实验。本研究的免疫印迹结果显示,在营养和饥饿条件下,与对照组相比,当芥子酸和水杨酸的浓度为50 μmol/L时,LO2细胞中LC3蛋白水平显著升高;与50 μmol/L相比,当芥子酸和水杨酸的浓度达到100 μmol/L时,细胞中LC3蛋白水平有降低的趋势,因此推测,高浓度的芥子酸和水杨酸一定程度降低细胞自噬活性,具体机理还需进一步研究。
4 结论
本研究利用不同浓度的酚类物质处理细胞,通过免疫印迹初步分析了新疆葡萄酒中酚类物质对细胞自噬的影响,结果显示橙皮苷、表儿茶素没食子酸酯作用细胞后LC3蛋白水平显著升高。实时荧光定量分析橙皮苷、表儿茶素没食子酸酯对细胞自噬的影响作用结果显示,橙皮苷、表儿茶素没食子酸酯上调了LO2细胞LC3蛋白mRNA的表达水平,下调了P62蛋白mRNA表达水平;细胞免疫荧光结果显示GFP-LC3和RFP-LC3荧光强度增加,提示细胞内形成大量自噬体;流式细胞术结果显示GFP-LC3/RFP-LC3荧光强度比值降低,表明有成熟自噬体生成。综上所述,表儿茶素没食子酸酯、橙皮苷可一定程度上调LO2细胞自噬活性,可为其相关产品开发提供一定的理论依据,为葡萄酒品质的提高提供新思路。

