超声波联合水杨酸处理对冬枣采后黑斑病的防控研究
郭宇逍,雷兴梦,刘摇,邓丽莉,2,曾凯芳,2,3*
1(西南大学 食品科学学院,重庆,400715)2(川渝共建特色食品重庆市重点实验室,重庆,400715) 3(西南大学食品贮藏与物流研究中心,重庆,400715)
冬枣(ZizyphusjujubaMill.cv.‘Dong zao’)风味独特,皮薄多汁,维生素、矿物质和酚类物质含量丰富[1],深受国内外消费者的青睐,但在采后运输贮藏期间易受病原菌侵染,导致果实腐烂变质,造成极大的经济损失。冬枣采后的主要病害是由链格孢菌(Alternariaalternata)引起的黑斑病。目前,控制鲜枣采后病害的方法主要有低温贮藏[2]、气调贮藏[3]、化学杀菌剂处理等,其中化学杀菌剂处理的效果最好[4],但使用传统化学杀菌剂后存在生态环境污染、病原菌产生耐药性等弊端[5]。此外,随着现代生活水平不断提高,消费者对果蔬的安全性及营养价值越来越关注,对鲜果贮藏保鲜技术提出了更高的要求。
超声波(ultrasound,US)是一种新兴的技术,已被广泛用于食品加工研究[6],在食品保鲜领域也有良好的应用前景。主要原因是US在液体介质中传播时会产生空化效应,使果蔬表面或细胞壁与细胞液间产生局部高温、高压、微射流和剪切力,从而灭活微生物、改变酶活性和促进表面微生物脱落等;US处理也可以作为一种辅助手段,与其他处理方式结合产生协同增效作用[7-9]。水杨酸(salicylic acid, SA)是一种天然酚类化合物,参与调控植物生理生化过程,可对环境胁迫的响应,且大量研究证明,在采后使用适当浓度SA处理能够诱导果实产生抗病性,有效降低果实腐烂率[10-11]。然而,关于US联合SA处理在采后冬枣应用方面鲜有报道。因此,本文探讨了US联合SA处理对采后冬枣果实黑斑病的控制效果及其机理,以期为冬枣采后黑斑病综合防控提供理论依据和应用参考。
1 材料与方法
1.1 材料与试剂
实验材料为冬枣,采摘自山西省临汾市(东经111.24°,北纬35.72°)采摘后立即运送至实验室,于4 ℃冷库预冷24 h散发田间热,挑选出大小均匀、成熟度一致、无机械伤的果实备用。
链格孢菌(A.alternata)由课题组分离于自然发病枣果实,经分子生物学鉴定后保藏于甘油管中,-80 ℃贮藏。使用前,在马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)上活化后,25 ℃培养6 d,收集病原菌孢子,血球计数板计数,并用无菌蒸馏水稀释至1×105spores/mL,4 ℃保存备用。分析纯SA,上海阿达玛斯试剂有限公司;乙腈、表儿茶素、阿魏酸、芦丁、香草酸、儿茶酸、绿原酸(均为色谱纯),成都普瑞法科技有限公司。
1.2 仪器与设备
SW-CJ-1F超净工作台,苏净集团安泰有限公司;PB-10赛多利斯酸度计,德国赛多丽斯股份有限公司;GL-20G-Ⅱ,上海安亭科学仪器厂;JSM-6510LV扫描电镜,日本JEOL公司;HZQ-F100全温振荡培养箱,太仓市实验设备厂;SYNERGYH1MG全自动酶标仪,美国Bio Tek公司;DDS-307A电导率仪,中国上海INESA公司;LGj-10冷冻干燥机,北京松源华兴科技发展有限公司;LC-20AT高效液相色谱仪,日本岛津公司。
1.3 实验方法
1.3.1 US联合SA处理对冬枣损伤接种A.alternata后发病率、病斑直径的影响
参照LEI等[12]的方法。用2%(体积分数)的次氯酸钠溶液浸泡冬枣果实2 min,清水冲洗,于室温条件下自然晾干后,在果实赤道对称部位打2个孔(直径3 mm,深度3 mm),每孔接入10 μL 1×105spores/mLA.alternata孢子悬浮液,待菌悬液充分吸收。果实随机分组,前期通过预实验对超声波不同功率、时间和水杨酸不同浓度等处理条件进行了初筛,根据预实验结果,本实验按以下条件进行处理:a)对照(Control):无菌水浸泡冬枣10 min;b)US处理:将冬枣置于US水浴槽中,用420 W超声波处理10 min;c)SA处理:0.1 mmol/L水杨酸溶液浸泡冬枣10 min;d)US联合SA处理:将冬枣浸泡在0.1 mmol/L SA溶液中后,置于US水浴槽,再用420 W超声波处理10 min。处理完后捞出果实,待果实自然晾干后于25 ℃贮藏,每天观察记录发病率和病斑直径,果实出现淡红或淡黄色水渍状小病斑,或组织凹陷,果肉颜色由乳红色转至黑褐色则视为发病[5]。每组10个果实,重复3次。
1.3.2 US联合SA浸泡处理对冬枣贮藏期自然腐烂率的影响
果实不进行打孔与接种病原菌处理,其他处理方法同1.3.1节,处理后的枣果实于4 ℃贮藏,每隔7 d观察记录一次腐烂率,果实出现发病症状则视为腐烂,每组50个果实,重复3次。
1.3.3 US联合SA处理对A.alternata菌落直径的影响
参照CHEN等[13]的方法并稍作修改。取900 μL,1×105spores/mL的A.alternata孢子悬浮液于1.5 mL无菌离心管中,分别进行以下处理:a)对照(Control):向离心管中加入100 μL无菌水,摇匀静置10 min;b)SA处理:向离心管中加入100 μL 1 mmol/L的水杨酸溶液,充分混匀后静置10 min;c)US处理:向离心管中加入100 μL无菌水,混匀,420 W超声波处理10 min;d)US联合SA处理:向离心管中加入100 μL,1 mmol/L的水杨酸溶液,充分混匀,420 W超声波处理10 min。取10 μL处理完毕后的孢子悬浮液接种于PDA培养基中心,25 ℃培养,第6天时测量菌落直径,重复5次。
1.3.4 US处理对A.alternata在果实伤口处附着情况的影响
参考LEI等[12]的方法并稍作修改。在枣果实赤道部位等距离打4个孔(3 mm×3 mm),接种10 μL 1×105spores/mL的A.alternata孢子悬浮液,待菌悬液完全吸收后,置于盛有150 mL无菌水的塑封袋中,420 W超声波处理10 min,用无菌打孔器(直径5 mm)取接种处枣果实组织于无菌研钵中,加入10 mL无菌水,研磨至匀浆。将匀浆进行梯度稀释,涂布,28 ℃静置培养48 h统计活菌数,记录果实伤口处的剩余活菌数;同时吸取100 μL塑封袋中的无菌水在PDA上均匀涂布,25 ℃培养,48 h后统计活菌数,记录被清洗下来的活菌数,以没有进行超声波处理的为对照(Control)。实验重复5次。
1.3.5 扫描电镜(scanning electron microscope,SEM)观察US对果实表面蜡质层的影响
冬枣处理:果实处理同1.3.2节,只包含对照组(Control)和US单独处理组。
SEM样品处理:参照MENG等[14]的方法并稍作修改。取处理后的枣果实样品,用无菌美工刀修整样品(5 mm×3 mm×3 mm),2.5%(体积分数)的戊二醛固定12~24 h,固定结束后,梯度(30%、50%、70%、90%和100%,体积分数)乙醇溶液脱水处理,脱水完成后,用梯度浓度的叔丁醇(50%、70%、90%和95%,体积分数)依次置换,100%的叔丁醇置换2次,每次10 min,置换完成后于真空干燥箱中干燥2 h(65 ℃,0.8 kPa)。干燥完成后的样品进行喷金镀膜后于扫描电镜下观察。重复3次。
1.3.6 冬枣果皮SA含量的测定
果实前处理同1.3.2节。果实随机分组,按以下方法处理:a)SA处理:0.1 mmol/L SA溶液浸泡冬枣10 min;b)US联合SA处理:将冬枣浸泡在0.1 mmol/L SA溶液中后,置于US水浴槽,再用420 W超声波处理10 min。处理完后立即取整个果实的果皮样品(厚度1 mm)。SA的提取和测定参照林文芳等[15]的方法并稍作修改。液相色谱条件:选用荧光检测器,激发波长305 nm,发射波长407 nm;色谱柱:安捷伦ZORBAX Eclipse XDB C18柱;流动相:V(甲醇)∶V[乙酸钠缓冲液(50 mmol/L pH 5.4)]=1∶9;流速:0.8 mL/min;进样体积:10 μL;柱温:40 ℃。
1.3.7 US联合SA处理对冬枣抗病性的影响
果实处理方法同1.3.2节。将处理完的果实4 ℃贮藏,在处理后每7 d取厚度3~5 mm的果皮果肉组织,将其切碎后放入液氮中迅速冷冻后置于-80 ℃冰箱保存备用。
1.3.7.1 发病率与病斑直径
将上述处理完的果实室温静置24 h后,在果实赤道对称部位打2个孔(直径3 mm,深度3 mm),每孔接入10 μL 1×105spores/mL的A.alternata孢子悬浮液,待菌悬液充分吸收后,25 ℃贮藏,接种后每天测量果实的发病率和病斑直径。每组10个果实,重复3次。
1.3.7.2 酶活性测定
过氧化物酶(peroxidase,POD)、苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)、多酚氧化酶(polyphenol oxidase,PPO)活性测定参考曹建康等[16]的方法。PAL活性:以每小时吸光度值变化1为一个酶活力单位(U);POD活性:以每分钟吸光度值变化1为一个酶活力单位(U);PPO活性:以每分钟吸光度值变化0.01为一个酶活力单位(U),结果均以U/g表示。
4-香豆酸辅酶A(4-coumaric acid coenzyme A,4CL)活性测定参考梁伟等[17]的方法并稍作修改:称取少量冬枣样品,置于研钵中用液氮研磨至粉末,准确称取5.0 g样品于离心管中,加入1.5 mL上海源叶生物科技有限公司的提取液,然后于4 ℃,10 000 r/min条件下离心30 min,分离的上清液即为酶提取液。反应体系:0.90 mL 7.5 μmol/L硫酸镁,0.30 mL 50 nmol/mLp-香豆酸,0.30 mL 2.5 μmol/mL ATP,0.30 mL 38 nmol/mL CoA以及1.0 mL酶液。25 ℃下混匀静置10 min,在333 nm处测定吸光度值,以吸光度值每分钟变化0.01为1个酶活力单位(U),结果以U/g表示。
1.3.7.3 游离酚类、结合酚的提取和测定
参考李苇舟[18]的方法。HPLC条件:检测器:日本岛津LC-20A二极管阵列检测器(diode array detector,DAD);色谱柱:Thermo BDS C18(250 mm×4.6 mm,5 μm);流动相A:0.2%(体积分数)甲酸水溶液;流动相B:100%乙腈,洗脱梯度:0~5 min 10% B;5~50 min,10%~40% B;50~55 min 40%~90% B;55~62 min 90% B;62~65 min 90%~10% B;65~75 min 10% B,柱温30 ℃,流速:0.7 mL/min,进样量:20 μL。
1.3.7.4 总酚和总黄酮含量的测定
总酚和总黄酮的测定使用1.3.7.3节的提取液测定。总酚含量测定参考李苇舟[18]的方法。
总黄酮含量测定参考陈力维等[19]的方法,采用硝酸铝-亚硝酸钠比色法测定总黄酮含量,以芦丁为标准品,于510 nm处测定吸光度值,结果以每克样品中所含的芦丁当量表示。
1.4 数据处理
运用Excel 2016统计分析所有得到的数据,应用GraphPad Prism 8软件制图;运用SPSS 21.0软件对数据进行方差分析,利用Duncan′s多重比较进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 US联合SA处理对冬枣损伤接种A.alternata后发病率、病斑直径的影响
如图1所示,US和SA单独或联合处理均能够显著降低冬枣贮藏期间黑斑病的发病率(图1-A)和病斑直径(图1-B),其中US和SA联合处理效果最显著;在贮藏第11天时联合处理组的发病率和病斑直径分别比对照减小39.33%和51.25%,研究结果表明,US处理能够显著增强SA对冬枣果实采后黑斑病的防控效力。

A-发病率;B-病斑直径图1 US联合SA处理对冬枣采后黑斑病的控制效果
2.2 US联合SA浸泡处理对冬枣贮藏期腐烂率的影响
由图2可知,各个处理组冬枣果实的腐烂率在整个贮藏期间(35 d)的均显著低于对照组(P<0.05),联合处理组枣果实的腐烂率最低,在贮藏第14、21和28天时,US联合SA处理组的,腐烂率分别比对照下降了17.78%、28.89%和37.78%。说明US、SA单独处理以及联合处理均能够有效控制冬枣果实采后病害,其中联合处理的防治效果最佳。

图2 US和SA联合处理对冬枣低温贮藏期腐烂率的影响
2.3 US联合SA处理对A.alternata菌丝生长的影响
由图3可知,经US和SA单独处理后的A.alternata菌落直径与对照组相比显著差异,但US和SA联合处理显著抑制菌丝生长(P<0.05),联合处理组的菌落直径比对照小2.75 mm(图3-A)。说明US和SA处理对A.alternata菌丝具有协同抑制作用。
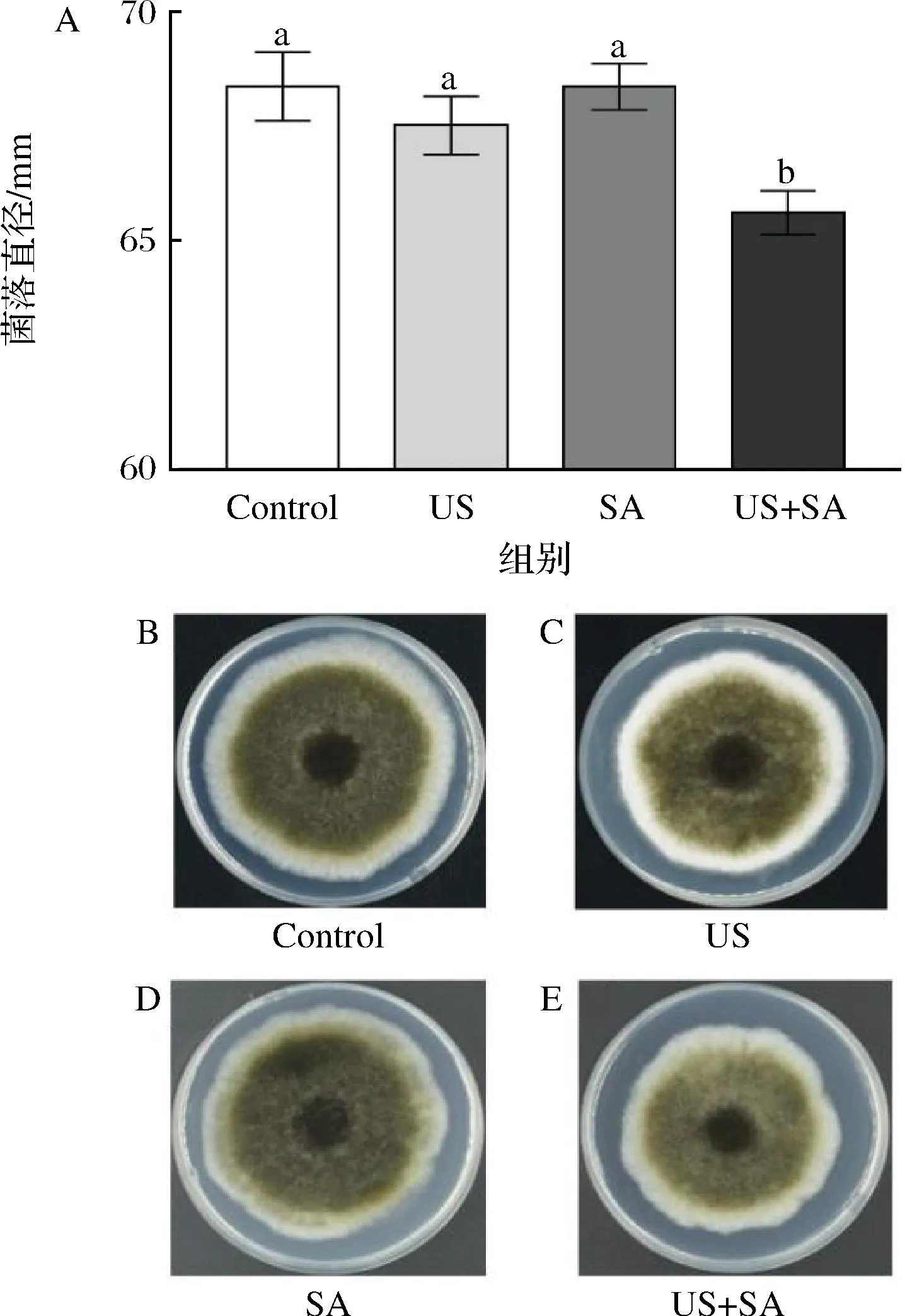
A-菌落直径;B-Control;C-US;D-SA;E-US+SA图3 US和SA联合处理对A.alternata菌落直径的影响
2.4 US处理对果实伤口处A.alternata孢子附着的影响
利用活菌数评估US处理对果实伤口处A.alternata孢子附着的影响(图4)。研究结果表明,US处理组果实伤口处剩余活菌数显著低于对照组(图4-A),且清洗水中US处理组的活菌数显著多于对照组(图4-B),说明US降低A.alternata在枣果实伤口处的附着量。以上结果说明US对A.alternata的清洗作用是其有效控制枣果实采后病害的机制之一。
2.5 US联合SA处理对果皮中SA含量的影响US联合SA处理对SA渗透的影响
图5所示,通过扫描电镜观察发现,对照组果实(图5-A)表面光滑、连续性好,经US处理(图5-B)后的果实表面变得粗糙,形成微裂纹,US处理可能使枣果皮表面蜡质层形成微小缝隙促进SA向果实渗透;进一步通过高效液相色谱测定枣果实表皮中SA的含量,结果表明US联合SA处理后枣果皮中SA含量显著高于SA单独处理组(图5-C)。说明US处理能够促进SA向枣果实表皮渗透,进而更好地发挥作用控制枣果实采后病害。

A-对照的枣表面SEM图;B-US处理后的枣表面SEM图;C-SA单独、US联合SA处理后的枣果皮SA含量图5 US处理对枣果实表面的蜡质层和SA含量的影响
2.6 US联合SA处理对冬枣抗病性的诱导作用
2.6.1 US联合SA处理对冬枣黑斑病发病率和病斑直径的影响
为探究US联合SA处理对冬枣抗病性的诱导作用,研究采用先处理后接种病原菌的方式,实验结果如图6所示。与对照相比,US和SA单独或联合处理均能显著降低果实发病率(图6-A)和病斑直径(图6-B),US和SA联合处理控制病害效果显著优于US和SA单独处理,在贮藏第9天时US和SA联合处理发病率和病斑直径分别比对照小41.15%和55.80%。说明US和SA处理能够通过诱导冬枣果实产生抗病性,从而防治枣果实采后黑斑病,而US联合SA处理的控制效果最佳。
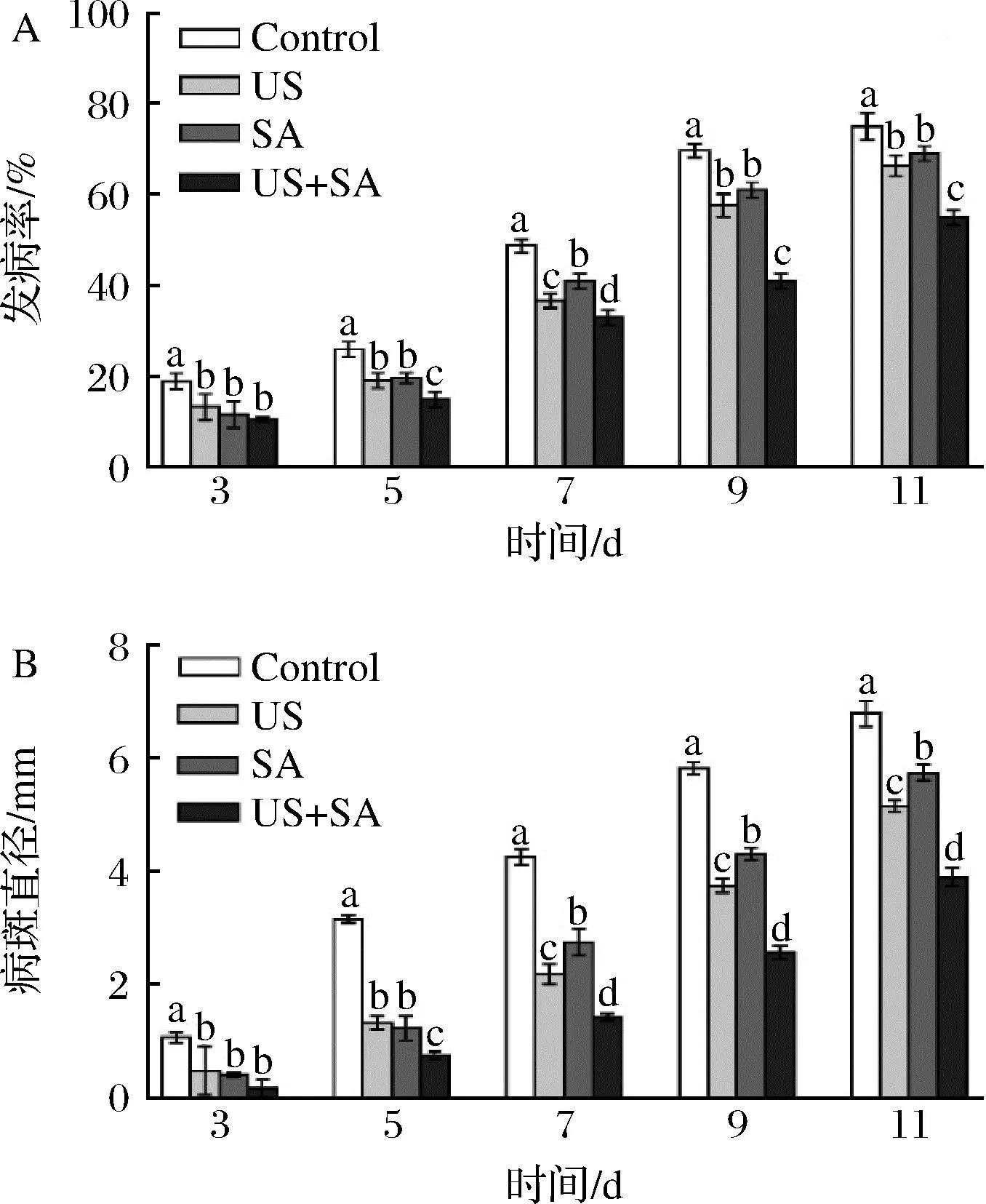
A-发病率;B-病斑直径图6 US联合SA处理对诱导冬枣抗病性的影响
2.6.2 US联合SA处理对冬枣防御相关酶活性的影响
如图7显示,随贮藏时间延长,枣果实中POD、PAL、4CL 3种酶活性均呈现先上升后下降的趋势;在贮藏前期和中期(0~21 d),PPO活性随着贮藏时间的延长缓慢降低,且处理组和对照组PPO活性无显著性差异,在贮藏后期(28~35 d),PPO活性迅速提高,且US联合SA处理组的活性显著高于对照组(图7-D),在冬枣贮藏第35天时,US联合SA处理组的POD、PAL、4CL、POD酶活性分别是对照组的1.63、1.35、1.45、4.06倍。说明US联合SA能诱导抗性相关酶活升高,提高果实抗病性。
2.6.3 US联合SA处理对总酚和总黄酮含量的影响
由图8可知,随贮藏时间延长,对照组以及US联合SA处理组的总酚含量(图8-A)先升高后降低,处理组的含量均显著高于对照组,在第7天时,处理组比对照组高68.11%;对照组和处理组总黄酮含量(图8-B)呈现先上升后下降的趋势,处理组总黄酮的含量均显著高于对照组,且第7天达到最大值,此时的处理组比对照组高48.09%。说明US联合SA能提高果实贮藏期间的总酚和总黄酮含量,促进果实中总酚和总黄酮的积累。

A-总酚含量;B-总黄酮含量图8 US联合SA处理对总酚和总黄酮含量的影响
2.6.4 US联合SA处理对游离酚与结合酚含量的影响
由图9、图10可知,US联合SA处理组的表儿茶素、阿魏酸、香草酸3种游离酚含量和阿魏酸、儿茶素2种结合酚含量都显著高于对照组,但游离绿原酸、芦丁含量无显著差异。游离表儿茶素(图9-A)含量先升高后降低,对照组和处理组分别在14 d和21 d达到最大,并且整个贮藏期间处理组显著高于对照组;贮藏前期游离阿魏酸含量(图9-B)与对照无显著差异,在后期显著高于对照;在贮藏第14天时,处理组游离芦丁含量(图9-C)显著高于对照组;游离香草酸含量(图9-D)一直处于上升趋势,且处理组显著高于对照;游离绿原酸含量(图9-E)与对照无显著差异;结合阿魏酸(图10-A)呈逐渐下降趋势,对照组在第28天后降为0,贮藏后期处理组显著高于对照组;从贮藏0 d到7 d,结合儿茶素含量(图10-B)迅速上升,在第21天和35天时,处理组显著高于对照组。
3 讨论
冬枣果实在采后极易发生真菌潜伏侵染性病害而造成重大损失,其中由A.alternata引起的黑斑病是其采后最主要的病害之一,有效控制枣果实采后病害是枣产业可持续发展的重要组成部分。US和水杨酸作为绿色的防控方式,以其高效、便捷、无残留等优势受到广泛关注,本文探究了US联合水杨酸SA处理对冬枣采后黑斑病的防控效果及其机理,研究发现US联合SA处理能显著控制冬枣采后黑斑病、降低冬枣贮藏期的腐烂率,并优于单独处理;进一步对其控病机理进行探究,发现US联合SA处理可以通过直接抑制A.alternata生长、减少伤口处A.alternata孢子的附着、促进SA向果实渗透、通过提高抗性相关酶活性、促进活性物质积累提高枣果实的抗病性,控制枣果实采后黑斑病,延长果实保质期。
US联合水杨酸SA处理对冬枣采后黑斑病的防控具有协同作用,与单独处理相比,US联合SA处理能更显著地抑制枣黑斑病的发病率、病斑直径和低温贮藏期的腐烂率,这与BAL等[20]的研究结果一致,SA联合US处理能够更有效地控制樱桃采后病害。虽然US单独处理在贮藏前期也能显著降低腐烂率,但到后期腐烂率增大,与对照无差异,这可能是US处理后出现的应激反应[21]。超声波作为新型绿色物理防控方式,在果蔬采后病害的防治中广泛研究,人们更多将其与其他防治方式联合使用,TAKUNDWA等[22]研究发现,US联合771.2 IU/g乳酸链球菌素和0.185%(体积分数)牛至处理生菜14.65 min,大肠杆菌和单核增生李斯特菌的数量均显著减少;超声联合热处理能抑制多种腐败细菌、霉菌和酵母的生长繁殖[23]。清洗和杀菌作用是超声波防控机制之一,本实验中发现,US能减少病原菌在枣果实伤口处的数量,并且US与SA联用时还能显著抑制菌丝生长,这可能是由于US处理产生的高温高压,有利于化学试剂透过细胞膜[24],同时使微生物分散,更容易受到化学试剂的作用,从而促进微生物死亡和分解[25]。除此之外,US的空化效应对果实产生了物理效果,本实验通过观察US处理后果实表面蜡质层的形态并测定果皮SA含量,证明US处理有利于SA与果实接触,促进SA渗透,也可能是由于US空化效应能改变果实组织的显微结构,形成许多微观通道,对果实组织的传质有积极作用[26]。ZHANG等[27]在研究中也有类似发现,US和乳酸钙单独或联合处理番茄时,联合处理组果实中钙含量显著增加,说明US能够促进外源钙在水果组织中的渗透。
近年来,研究发现大多数处理可以通过诱导宿主对病原微生物的广谱抑菌和长效防御来达到防治果蔬采后病害的目的,果蔬的所有复杂的生化反应都受酶的调节,PPO、POD、PAL、4CL等抗性相关酶活性的高低和果实抗逆能力的强弱密切相关[28]。本文发现经US联合SA处理后,低温贮藏期间冬枣果实中的PPO、POD、PAL、4CL活性均显著升高,可能是由于一定强度及频率条件下US产生的空穴作用、机械振荡作用等,能改变酶分子构象,暴露更多的酶活性位点,同时加速传质,增加酶和底物的碰撞频率,使酶与底物相互作用的机会大大提升[29-30]。董生忠等[31]的研究中也发现,相比于对照组,50 kHz,200 W的US和0.9 μL/L 1-MCP单独或联合处理苹果5 min,在整个贮藏期间,US单独或联合处理均能不同程度的提高POD、PPO两种酶活性,且联合处理效果最显著。类似的,YANG等[32]发现,40 kHz,350 W的US联合0.05 mmol/L SA处理桃果实10 min,在贮藏期第2天,PAL活性由低到高依次为:对照、US单独处理组、SA单独处理组、US联合SA处理组。除了提高酶活性,作为具有较强抗氧化活性的总酚、黄酮,以及酚酸组分阿魏酸、表儿茶素、没食子酸等物质,在本文的联合处理组中均显著高于对照组,这些次生代谢产物不仅能保护细胞抵御活性氧毒害,还能抑制真菌孢子萌发和菌丝体生长、抑制病原微生物浸染等,可以有效提高果实抗病性[28,33]。综上,US联合SA处理可通过抑制A.alternata生长、减少伤口处A.alternata的附着、促进SA向果皮渗透、提高枣果实低温贮藏期间抗性相关酶活性、促进抗氧化活性物质和抑菌物质的积累,从而增强果实抗病性,降低腐烂率。
4 结论
本研究基于绿色物理防控技术的角度,以新鲜冬枣为实验材料探究了US联合SA处理对冬枣采后黑斑病的防控效果及其机理。研究结果表明420 W US和0.1 mmol/L SA对冬枣进行单独或联合处理均能够有效控制枣果实采后黑斑病,其中US和SA联合处理的控制效果最佳。进一步从病原菌及枣果实两方面对其作用机制进行探究。一方面,研究发现US和SA联合处理能够直接抑制A.alternata菌丝生长;US处理能减少A.alternata在果实伤口处的附着,促进SA渗透向枣果实表面渗透。另一方面,US和SA联合处理能够通过提高枣果实抗氧化相关酶(PPO、POD、PAL、4CL)的活性以及促进抗病相关物质(总酚、总黄酮以及游离表儿茶素、阿魏酸、香草酸和结合阿魏酸、儿茶素)的积累,诱导枣果实抗病性,从而提高枣果实对病害的防御能力,从而降低果实腐烂率。综上,US联合SA处理对冬枣采后黑斑病具有良好的控制效果,能够应用于冬枣果实采后病害的绿色防治。

