mRNA 治疗用纳米载体研究新进展
石立旺,张楠,祝纶宇,王颖,郭敏,杜超
基因药物治疗是以 mRNA 作为桥梁,将 DNA 的遗传密码传输到核糖体中进行蛋白质表达,恢复人体内缺失的蛋白质或创造新的蛋白质来达到治疗疾病的目的。理论上,mRNA 拥有能够合成“任意一种蛋白质”的潜力,将mRNA 制成疫苗或者药物,相当于送出一张可以在人体内生成药物工厂的“施工图纸”,根据这张“图纸”,mRNA 可以在细胞内翻译表达而无需进入细胞核,因此相比于 DNA药物或传统的功能性生物分子,mRNA 疗法具有独特的优势。首先,mRNA 不会整合到宿主的基因组中,避免基因突变的风险。其次,mRNA 免疫源性低,不易触发机体免疫反应,半衰期短、代谢产物纯天然,没有持续累积毒性的风险。再次,负载 mRNA 的疫苗可以诱导 T 细胞和自然杀伤细胞攻击癌细胞,还能够激活 toll 样受体和视黄酸诱导基因 I,在体内产生免疫肿瘤的微环境[1-2]。最后,mRNA很容易通过体外转录过程合成,这个过程相对廉价,并且可以快速应用于各种疗法。因此,从制药行业的角度来看,mRNA 是一种非常有潜力的候选药物,可以满足基因治疗、癌症治疗以及开发疫苗等需求。尽管 mRNA 在治疗疾病方面具有独特的优势,但由于其很容易被酶降解,不容易被靶细胞摄取,因此如何高效稳定地将其进行细胞内传递是临床应用中面临的主要问题。为了克服这一障碍,人们已经开发出病毒载体和非病毒载体用于递送 mRNA。病毒载体可能引起严重的不良反应甚至死亡,临床应用十分有限。而非病毒载体,包括脂质纳米颗粒、病毒样颗粒、聚合物纳米颗粒、无机纳米颗粒和外泌体,具有安全性高、靶向性强的优点,是临床研究的热点(图 1)。本文介绍了 mRNA 药物的发展历程、治疗过程、设计原则、递送体系及其生物医学应用中的研究热点,讨论了基于 mRNA 的治疗方法存在的种种挑战和应用前景。
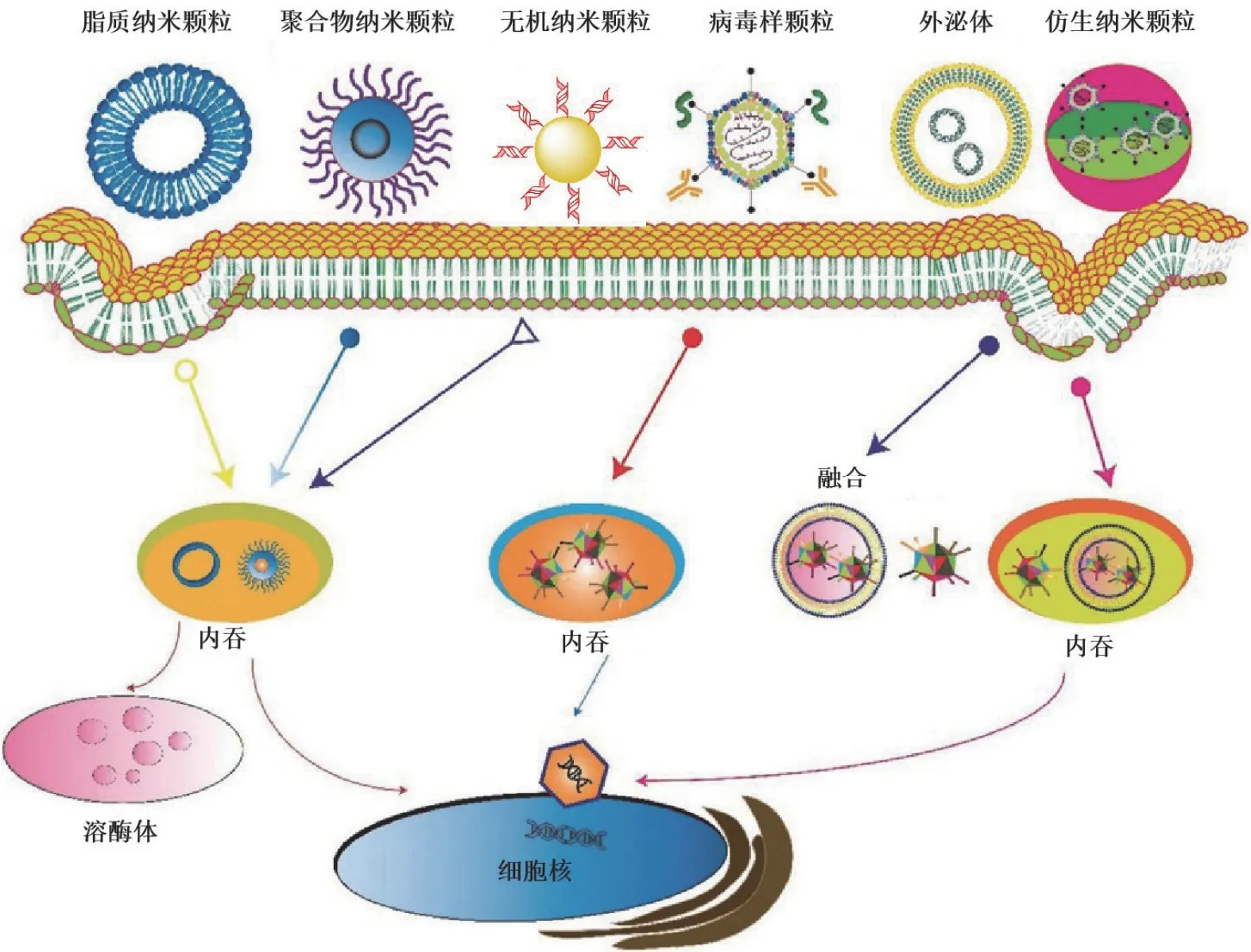
图1 目前基因治疗常用的非病毒载体(脂质纳米颗粒、聚合物纳米颗粒和无机纳米颗粒先进入核内体,然后进入溶酶体和细胞。病毒样颗粒先进入核内体,再进入细胞。外泌体和仿生纳米颗粒通过膜融合和各种内吞途径进入细胞[3])
1 mRNA 疗法的发展历程
从 1961 年首次发现 mRNA 到 mRNA 药物或疫苗首次在临床应用历经了半个世纪。1978 年,Dimitriadis 成功地用脂质体将外源性 mRNA 转染到小鼠淋巴细胞中[4]。同年,Ostro 等[5]将 mRNA 转染到人细胞。1984 年,Krieg和 Melton[6]成功合成具有生物活性的 mRNA 并将其注射到青蛙卵中,证实了人造 mRNA 的功能与内源性 mRNA相似。Malone 等[7]于 1989 年首次提出 mRNA 疫苗的概念。与此同时,以阳离子脂质体为载体的 mRNA 递送系统“lipofectin”被商业化。1995 年,科研人员首次将 mRNA编码的癌症抗原注射到体内,以进行癌症免疫治疗研究,但是基于当时的技术条件,mRNA 的安全性、稳定性以及药物递送等方面需进一步验证,临床试验并没有取得太大的进展[8]。到了 21 世纪,随着医学研究技术的进步,mRNA 的合成、修饰和递送技术有了新的进展,mRNA 疗法得到研究人员和一些生物制药公司的关注。2011 年,转录激活因子样效应物核酸酶技术被开发用于基因编辑[9],为 mRNA工程提供了强有力的工具。此外,SARS-COV-2 的爆发加速了 mRNA 疫苗的开发。2020 年 12 月 11 日,辉瑞公司的疫苗 BNT162b2 获得了 FDA 的紧急授权,成为首个用于人类的 mRNA 药物。
2 mRNA 疗法的治疗过程
mRNA 药物在体内发挥作用大体可分成六个步骤:第一步,注射的 mRNA 药物被抗原呈递细胞内吞;第二步,mRNA 进入胞质后,由核糖体翻译成蛋白质,翻译的抗原蛋白通过多种途径激活免疫系统;第三步,细胞内抗原被蛋白酶体复合物分解成较小的片段,片段通过主要组织相容性复合体(MHC)I 类分子递送给细胞毒性 T 细胞;第四步,活化的细胞毒性 T 细胞通过分泌穿孔素、颗粒酶等细胞因子杀死感染细胞;此外,分泌的抗原可被细胞摄取,在核内体降解,并通过 MHC II 类分子递送给辅助 T 细胞;最后,辅助 T 细胞刺激 B 细胞产生抗体,并通过炎性细胞因子激活吞噬细胞,清除病原体(图 2)。
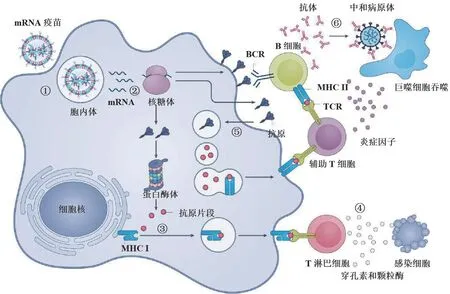
图2 mRNA 疗法的治疗过程[10]
3 mRNA 的设计原则
mRNA 疫苗或药物是用合成的 mRNA 分子生产抗原,从而引发机体免疫反应。mRNA 分子的序列设计主要模仿了内源性 mRNA 的五个结构部分,分别是:5' 帽子、5' 非翻译区(5'UTR)、开放阅读框(ORF)、3' 非翻译区(3'UTR)和多尾 A(图 3)。如果是自我扩增的 mRNA,还会含有 RNA 聚合酶的基因,这种 RNA 聚合酶在细胞内扩增 mRNA,从而生产较多的抗原。

图3 体外转录 mRNA 的关键结构:5' 帽子、5'UTR、ORF、3'UTR 和多尾 A[11]
科研人员根据 5' 末端第一个或第二个核苷酸的羟基上是否有甲基化的核糖,把 5' 帽子分为 O 型、I 型和 II型。5' 帽子不仅可以阻止细胞质传感器的识别,从而防止错误的免疫反应,而且能够在空间上保护 mRNA 不被核酸外切酶降解。另外,5' 帽子可以和多尾 A、多尾 A 结合蛋白以及翻译起始因子协同工作,从而环化 mRNA 并募集核糖体进行转录。
5'UTR 的主要功能是帮助 mRNA 与核糖体结合。早期研究表明,鸟嘌呤和胞嘧啶含量高的 5'UTR 可以抑制mRNA 翻译。因此,在设计 5'UTR 时应减少鸟嘌呤和胞嘧啶的数量。此外,由于 AUG 会破坏 ORF 的翻译,在设计 5'UTR 时应避免使用 AUG 作为起始密码子[12]。
ORF 作为抗原-蛋白编码区,其翻译效率至关重要。富含鸟嘌呤和胞嘧啶的 ORF 具有更高的翻译效率。有研究表明,在不改变编码蛋白氨基酸序列的情况下,将宿主体内罕见的密码子改变为常见的密码子,可以提高蛋白的表达水平[13]。此外,科研人员有时会通过 ORF 区的内部修饰(N6-腺苷酸甲基化、胞嘧啶羟基化、尿苷酸甲基化或假尿苷)来加强翻译。这是因为所有原生 mRNA 都包含修饰核苷,所以免疫系统会识别无修饰的单链 RNA,然后产生干扰素,阻止 mRNA 翻译。使用修饰核苷可以防止被识别,从而保证翻译足够的蛋白质。
3'UTR 和多尾 A 是 mRNA 必需的序列,长度与翻译效率成正比。3'UTR 具有调节 mRNA 翻译、半衰期和亚细胞定位的功能。多尾 A 的长度大于 100 bp 是治疗性mRNA 的最佳选择;长度在 100 ~ 150 bp 能够与多尾 A 结合蛋白形成起始转录的复合体,保护 5' 帽子不被酶降解。
4 非病毒载体递送系统
mRNA 必须进入宿主细胞并表达才能发挥功能,带负电荷的 mRNA 很难穿过细胞膜上的阴离子磷脂双分子层,且容易被免疫系统中的细胞吞噬和核糖核酸酶降解。因此,mRNA 递送系统不仅要提高宿主细胞的摄取,还要保护mRNA 不被降解。目前,能够达成这个目标并且临床效果较好的是非病毒载体。下面将介绍非病毒载体递送系统的开发和应用。
4.1 脂质纳米颗粒递送系统
脂质纳米颗粒(LNPs)通常由四种成分组成:可电离脂质、胆固醇、聚乙二醇化磷脂和辅助脂质,它们共同包裹mRNA,保护其不被降解。可电离脂质能够促进 mRNA 的封装和释放。胆固醇嵌入磷脂分子之间,调节磷脂膜的流动性,降低膜的渗透性,减少 mRNA 渗漏。此外,它可以保持脂质膜的柔韧性,调节磷脂的相变,防止氧化,增强 LNPs抵抗外部条件变化的能力。聚乙二醇化磷脂可以使 LNPs表面覆盖亲水性保护膜,防止其被免疫系统中的细胞清除。辅助磷脂可以提高 LNPs 整体的相变温度和稳定性。饱和辅助脂质(例如二硬酯酰磷脂酰胆碱)最适合递送短链RNA(例如 siRNA),不饱和辅助脂质(例如二油酰磷脂酰乙醇胺)最适合递送 mRNA。
LNPs 作为 mRNA 的载体有非常广泛的应用。例如,根特大学的研究人员制备了在生理条件下可降解的 1,2,4-三唑啉-3,5-二酮缀合物并成功包裹 mRNA,用于提高多种细胞的 mRNA 转染效率[14]。COVID-19 mRNA LNPs 疫苗在不同人群中显出优异的保护效果[15]。尽管 LNPs 作为递送 mRNA 的平台表现出优异的预防和治疗疾病效果,但LNPs 有潜在的毒理学作用,会诱导免疫反应,促进中性粒细胞浸润,从而导致炎症。此外,已有报道 LNPs 能够引起疼痛、红肿和发烧等副作用[16]。因此,LNPs 给药系统的细胞毒性和免疫原性尚有待进一步探索。
4.2 病毒样颗粒递送系统
病毒样颗粒(VLP)是由一种或多种病毒结构蛋白通过自组装而形成的纳米级颗粒,直径 20 ~ 200 nm,形态上类似于天然病毒,但通常不包含亲代病原体遗传物质。通过病毒工程技术将 mRNA 与 VLP 衣壳蛋白特异性识别,可以形成 VLP-mRNA,再利用 VLP 的粒径优势和衣壳蛋白,使 mRNA 很容易地进入相关免疫细胞中,瞬时感染细胞,有效降低脱靶效应(图 4)[17]。上海交通大学的研究人员使用携带 mRNA 的慢病毒颗粒直接靶向 I 型单纯疱疹病毒(HSV-1)基因组,该颗粒有效地阻止了 HSV-1 复制和疱疹性基质性角膜炎的发生[18]。霍华德·休斯医学研究所设计了一种人鼠逆转录病毒样蛋白,并将其制作成 VLP 用来递送特定的 mRNA,极大地拓展了核酸治疗的应用范围[19]。作为一种天然可生物降解纳米材料,VLP 避免了由逆转录病毒引起的基因组缺失。随着基因技术的进一步发展,VLPs 作为安全有效的疫苗和基因编辑传递工具逐渐得到研究开发。
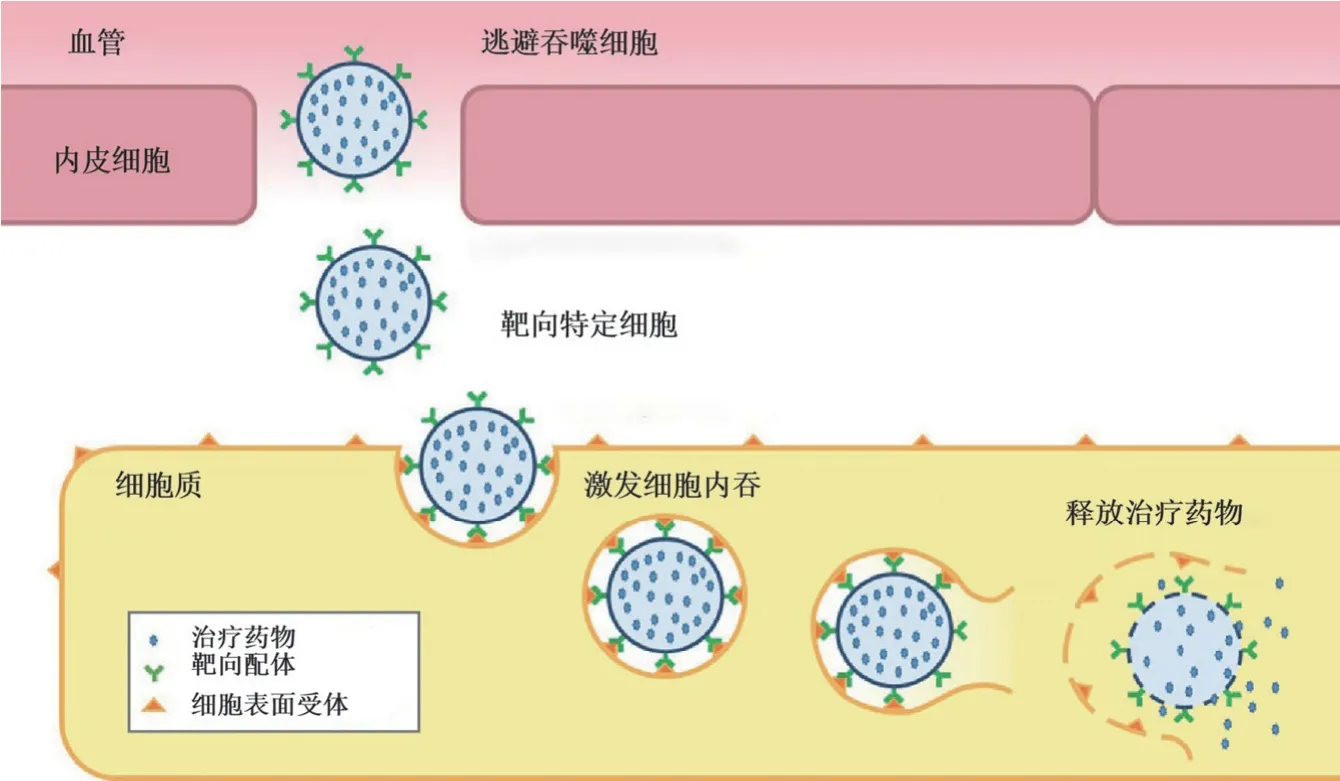
图4 病毒样颗粒递送系统(病毒样颗粒从血管进入体内,在躲避巨噬细胞吞噬的同时触发靶细胞内吞,然后释放 mRNA 药物[17])
4.3 仿生纳米颗粒递送系统
仿生纳米颗粒(CM-NPs)主要由功能性纳米颗粒和具有生物活性的细胞膜涂层组成,其中功能性纳米颗粒携带化疗药物、基因药物等,发挥治疗作用。细胞膜涂层包括红细胞、白细胞、巨噬细胞、肿瘤细胞、细菌以及各类工程化细胞,发挥包封、递送、保护、靶向和长循环作用(图 5)。鉴于肿瘤细胞和细菌表面的特定蛋白质能够激活免疫系统和提高黏附性,CM-NPs 在 mRNA 药物的功能传递上比传统纳米载体更加多样化。例如,甲型流感病毒表面的血凝素(HA)蛋白在体内 pH 值下将病毒包膜与周围膜融合,轻松地将其遗传物质传递到宿主细胞的细胞质基质中。受此启发,加州大学圣地亚哥分校的研究人员使用细胞膜涂层制造能够体内逃逸的仿生纳米颗粒,并使其表达 HA。在体内和体外评估中,这些纳米颗粒能够将 mRNA 有效传递到靶细胞的细胞质基质中,并显著提高蛋白质的表达水平[21]。此外,利用细胞膜上的特异性识别蛋白可以实现靶向给药,从而大大改善治疗效果。同济医院的研究人员设计了一种肿瘤靶向肽(cRGD)修饰的癌细胞膜包被的碳酸钙纳米颗粒,用于递送 IL-12 mRNA。cRGD 修饰的 CM 作为外壳可以赋予纳米颗粒在脑肿瘤微环境中的靶向作用。载有 IL-12 mRNA 的碳酸钙纳米颗粒可以治疗由坏死性凋亡诱导的免疫反应[22]。尽管 CM-NPs 在递送 mRNA 方面具有明显的优势,但现有的制备技术仍然不完善。因此,在实现临床应用前仍有许多工作需要开展。
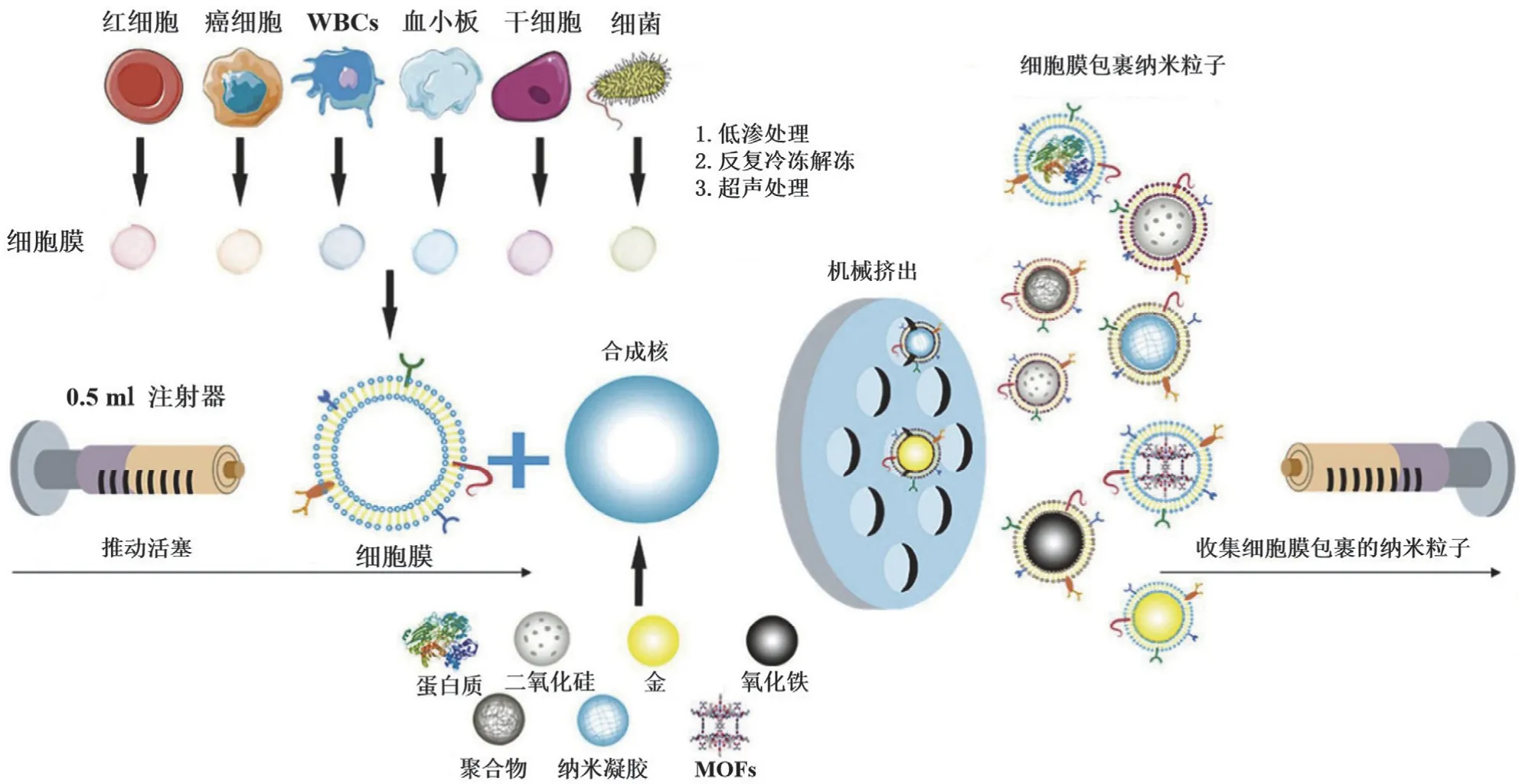
图5 通过共挤压法获得多种仿生纳米颗粒[20]
4.4 聚合物纳米颗粒递送系统
聚合物纳米颗粒递送体系由阳离子聚合物、树枝状聚合物或多糖聚合物组成。阳离子聚合物易于合成和改性,可以通过静电吸引和疏水相互作用与 mRNA 缔合,有助于形成更稳定的多聚体[23]。经化学改性的聚乙烯亚胺毒性低,传递效率高,是常用的阳离子聚合物。
树枝状聚合物是一种柔性大分子,直径在 2 ~ 20 nm,由中心分子和树突状的侧链部分组成,侧链中的官能团可以被修饰以改善聚合物的溶解度、组织结合和药代动力学等性质。德克萨斯州立大学的研究人员开发了基于树枝状聚合物的纳米递送系统。该系统可以成功将多种 mRNA 运送到肿瘤组织,并通过近红外成像标志肿瘤区域,同时发挥诊断、检测和治疗作用[24]。
多糖包括壳聚糖、海藻酸盐、右旋糖苷和透明质酸,主要来源于高等植物、动物、微生物、地衣和海藻中,具有毒性低,生物相容性高的特性,经化学改性后可作为载体材料。天津大学的研究人员开发了一种壳聚糖纳米机器,它具有程序化捕获、无需冷冻条件长期储存以及在细胞中有效递送mRNA 的功能[25]。勃兰登堡再生治疗中心的研究人员用胶原蛋白-透明质酸水凝胶封装血管内皮生长因子(VEGF)的mRNA 来调节 VEGF 和促血管生成素的分泌[26]。
这三种聚合物可以结合使用以获得更高的递送效率和安全性。此外,有些聚合物不属于上述三种类型。例如,伊朗大不里士医科大学的科研人员开发了聚乳酸-羟基乙酸共聚物/聚乙烯亚胺纳米颗粒递送编码绿色荧光蛋白的mRNA[27]。东京大学的科研人员设计了由 PEG 和 mRNA组成的递送体系。该递送系统显示出强大的 RNA 酶抗性和优秀的蛋白表达效率[28]。
4.5 无机纳米颗粒递送系统
无机纳米颗粒具有良好的存储稳定性、优异的生物相容性和易于制备等特点。目前,常用的无机纳米颗粒包括量子点、二氧化硅纳米颗粒、磁性氧化铁纳米颗粒和金纳米颗粒。首尔大学的研究人员合成了 N 掺杂石墨烯量子点,用于转染多种 mRNA 和质粒脱氧核糖核酸[29]。中科院纳米所的研究人员开发了介孔二氧化硅纳米颗粒,能够在小鼠体内传递荧光素酶 mRNA 的同时实现高效的细胞摄取[30]。氧化铁纳米颗粒是一种以铁基氧化物为主要成分的纳米级磁性材料,具有超顺磁性,已被广泛应用于生物医学研究。华盛顿大学的研究人员将 mRNA 和超顺磁性氧化铁纳米颗粒复配在一起,开发了一种用于预防新冠病毒(SARS-CoV-2)的mRNA 疫苗。该疫苗在 4 ~ 25 ℃ 能稳定存在长达 3 个月,临床试验结果良好,有望成为 SARS-CoV-2 病毒疫苗[31]。尽管这些无机纳米材料具有优异的载体特性,但是其在体内无法降解或清除,因此需要开展详细的毒理学研究,以评估体内积累而导致的毒性问题。
4.6 外泌体纳米颗粒递送系统
外泌体是由细胞产生的一种进行细胞间通讯的胞外小泡,直径为 30 ~ 150 nm,能够携带核酸、蛋白质、脂类和酶,并在细胞间进行传递(图 6)。天然外泌体递送 mRNA具有两个明显优势。第一,由于外泌体体积小,可减少免疫系统的清除作用,从而将更多的药物运输到病变部位。北卡罗莱纳州立大学的研究人员开发了可吸入外泌体,将 mRNA递送至啮齿动物和非人灵长类动物的肺部[32]。第二,外泌体可以轻易穿过血脑屏障,将药物输送到大脑。俄亥俄州立大学的研究人员制备了大量含有治疗性 mRNA 的外泌体,用于脑胶质瘤治疗。将靶向肽修饰到外泌体膜蛋白 CD47的 N 端,可以增强胶质瘤细胞对外泌体的摄取,减少对其他组织的副作用[33]。此外,外泌体的表面功能化可以实现靶向传递。例如,通过在外泌体表面蛋白 Lamp2b 的 N 端融合软骨细胞亲和肽构建靶向软骨细胞的外泌体,用于封装CRISPR/Cas9 质粒并递送至嵌入关节软骨中的软骨细胞,减轻软骨损伤[34]。由于外泌体表面的抗原能够增强患者的细胞免疫反应,因此,外泌体可以作为肿瘤和新冠病毒疫苗的载体。在疫苗的研发中,外泌体疫苗能够装载和递送更多的 mRNA,显著诱导人体长期免疫应答并且没有任何毒副作用[35]。
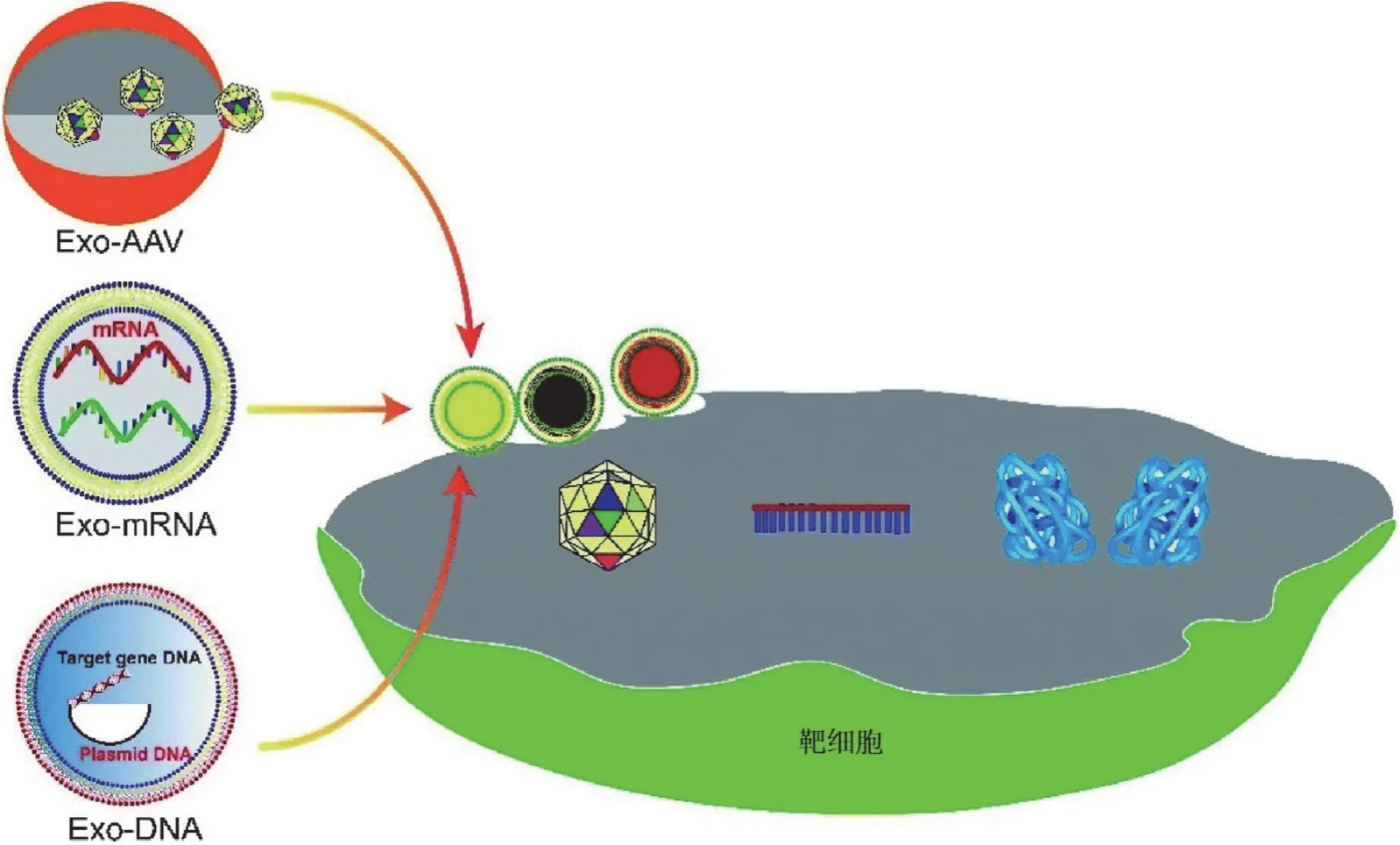
图6 外泌体将基因药物递送至靶细胞,通过翻译蛋白质、RNA 干扰和基因组编程治疗疾病[3]
5 研究热点
mRNA 分子量大,带负电荷,在到达细胞内目标位点前必须跨越多个组织和细胞屏障。因此,需要用载体将mRNA 保护起来,使其更易进入目标位点。目前常用的载体有 LNPs、VLP、CM-NPs、聚合物纳米颗粒、无机纳米颗粒和外泌体。这些载体在临床应用及科学研究中往往存在以下问题:①LNPs、聚合物纳米颗粒和无机纳米颗粒在注射入体内后主要积聚在肝脏中,不能精确地将足够的mRNA 递送到靶细胞;②生产外泌体的主要方法是细胞培养和生物反应器,但其生产规模较小,经济成本较高,不适合临床应用。以下将探讨目前所面临的主要问题及可能的解决方案。
5.1 靶向纳米颗粒
靶向纳米颗粒能够将 mRNA 选择性地运送到目标位点,减少运送过程中损耗,提升传递效率,加强免疫反应的持续时间,因而广泛受到研究人员的青睐。目前,制备靶向颗粒的主要方法有:优化纳米颗粒配方、添加选择性器官靶向(SORT)分子、修饰能够与细胞膜受体特异性结合的蛋白质。例如,在脂质结构中,季铵比伯胺表现出更强的质子海绵效应,长链烷基的不饱和双键使膜具有更高的流动性,这有助于改善 mRNA 体内逃逸,增加 mRNA 的翻译。基于上述原理,麻省理工大学的研究人员用含有季铵和炔烃的二油酰磷脂酰胆碱与脂质、胆固醇、DMG-PEG 共同制备了靶向肝脏的 LNPs[36]。德克萨斯大学西南医学中心的研究人员通过添加选择性 SORT 分子,系统设计了选择性靶向肺、脾脏和肝脏的无机纳米颗粒,以选择性编辑和治疗多种细胞[37]。塔尔图大学的研究人员将细胞穿透肽修饰到聚合物纳米颗粒表面,从而将 mRNA 选择性递送到脾脏中[38]。
5.2 外泌体的工业化生产
外泌体具有较高的生物相容性、生物利用率和跨生物屏障能力,因此被认定为极具作为 mRNA 药物递送载体的潜力。随着未来对外泌体载体的研究更加全面透彻,其需求量也会逐渐增加。俄亥俄州立大学的科研人员报道了一种细胞纳米穿孔方法,用于生产大量含有治疗性 mRNA 和靶向肽的外泌体。他们用质粒 DNA 转染各种细胞,并施加局部和瞬时电刺激,促进其释放携带 mRNA 和靶向肽的外泌体。与其他外泌体生产策略相比,细胞纳米穿孔法可产生高达 50 倍以上数量的外泌体[39]。此外,来自于红细胞的外泌体不含有细胞核和线粒体,不会传递基因,但仍能够参与大部分病理过程,而来自于植物的外泌体不会引起细胞毒性,能够调节肠道微生物群,刺激肠道组织更新。因此,红细胞外泌体和植物外泌体特别适合作为低成本的商品化外泌体来满足市场需求[40-41]。
6 结论与展望
虽然 mRNA 药物或疫苗在预防和治疗肿瘤、自身免疫疾病和呼吸系统疾病方面取得了重大进展,但研究仍然处于早期阶段,多重困难阻碍了 mRNA 疗法的发展。例如,LNPs 易氧化、降解,难以实现大规模工业化生产,LNP 递送系统中的脂质成分会导致小鼠产生炎症和过敏反应[16]。病毒样颗粒、仿生纳米颗粒、聚合物纳米颗粒和无机纳米颗粒也由于各种原因,没有被 FDA 批准用于临床。理想的递送系统应该具有高转染效率、足够的安全性、保护 mRNA,避免快速降解和靶向递送,这些功能还远远没有实现。
mRNA 疗法被列为 2022 年全球十大最具影响力的科学突破。引起了众多科学家和投资者的高度关注,这表明mRNA 药物具有十分广阔的应用前景。特别是各种新兴的仿生纳米载体体系开发有望成为 mRNA 递送的重要手段,将对 mRNA 治疗产生更深远的影响。外泌体作为天然细胞分泌的纳米颗粒,具有生物相容性好、免疫原性低、不易被吞噬、介导免疫逃逸、存留时间长、能穿透深层组织,装载各类基因治疗物质等众多优点。相信未来,基于外泌体的mRNA 纳米工程技术将实现对疾病的精准治疗,对药物开发模式产生颠覆性影响。

