一例耳聋患者及其家庭成员的基因突变分析
闫兰竹,林 静,孙晓彤,李东坤,侯兵兵,乔顺义
耳聋是人类最常见的先天缺陷之一,在新生儿中发生率约为1‰,其中50%~70%是由遗传因素引起的[1,2],可导致非综合征型耳聋(约70%,仅听力损失)与综合征型耳聋(约30%,听力损失伴其他组织器官病变)[3]。在我国最常见的非综合征型耳聋遗传基因主要有GJB2、SLC26A4(PDS)、GJB3与mtDNA[4]。GJB2基因主要引起先天性重度、极重度感音神经性耳聋;SLC26A4基因主要引起大前庭导水管综合征(EVAS);GJB3是中国首个克隆的遗传疾病基因,主要引起后天高频感音神经性耳聋[2,5];mtDNA为母系遗传基因[6],其中线粒体12SrRNA与tRNA基因已被证明是与听力损失相关的突变热点[7,8],12SrRNA表现为使用氨基糖苷类药物不当时发生听力损失,称为“药物致聋”,tRNA表现为迟发性耳聋[5]。我院通过耳聋易感基因检测发现一例mtDNA 7445A>G基因位点突变引起的听力障碍病例,并对其家庭成员进行检测,均证实为母系遗传。
1 病例报告
1.1 研究对象 先证者(成员1),男,32岁,因听力障碍于2023年5月来我院进行耳聋易感基因检测,其家庭成员包括先证者父亲(成员2)、母亲(成员3)、弟弟(成员4)。所有受检人员均签署了知情同意书。
1.2 方法
1.2.1 血液基因组DNA(gDNA)的提取 采集待检测人员外周静脉全血2 ml,放置于乙二胺四乙酸(EDTA)抗凝管内,按照离心柱型血液gDNA提取试剂盒(潮州凯普生物化学有限公司)说明书操作流程提取全血gDNA。
1.2.2 耳聋基因检测 采用聚合酶链式反应(PCR)对目的DNA进行扩增,完成后将扩增产物进行加热解链使其成为单链DNA,然后严格按照DNA杂交试剂盒(潮州凯普生物化学有限公司)说明书,利用低密度基因芯片+导流杂交技术在医用核酸分子杂交仪上,对4个遗传性耳聋相关基因的13个突变位点(GJB2基因235delC、299-300delAT、176-191del16、35delG、155delTCTG,mtDNA基因1494C>T、1555A>G、7445A>G、12201T>C,GJB3基因538C>T和SLC26A4基因IVS7-2A>G、2168A>G、1229C>T)进行检测。经过孵育、杂交、化学显色反应后,通过斑点颜色改变可以得到清晰可见的检测结果。
1.2.3 Sanger测序验证 将所有待检测样本寄送至广州凯普医学检验所对可疑突变位点进行Sanger双脱氧链终止法测序验证。
1.3 结果
1.3.1 基因检测结果 该家庭成员中,先证者父亲未检测到检验范围内的耳聋基因突变,先证者为mtDNA 7445A>G均质突变,先证者母亲及弟弟均为mtDNA 7445A>G异质突变(图1)。
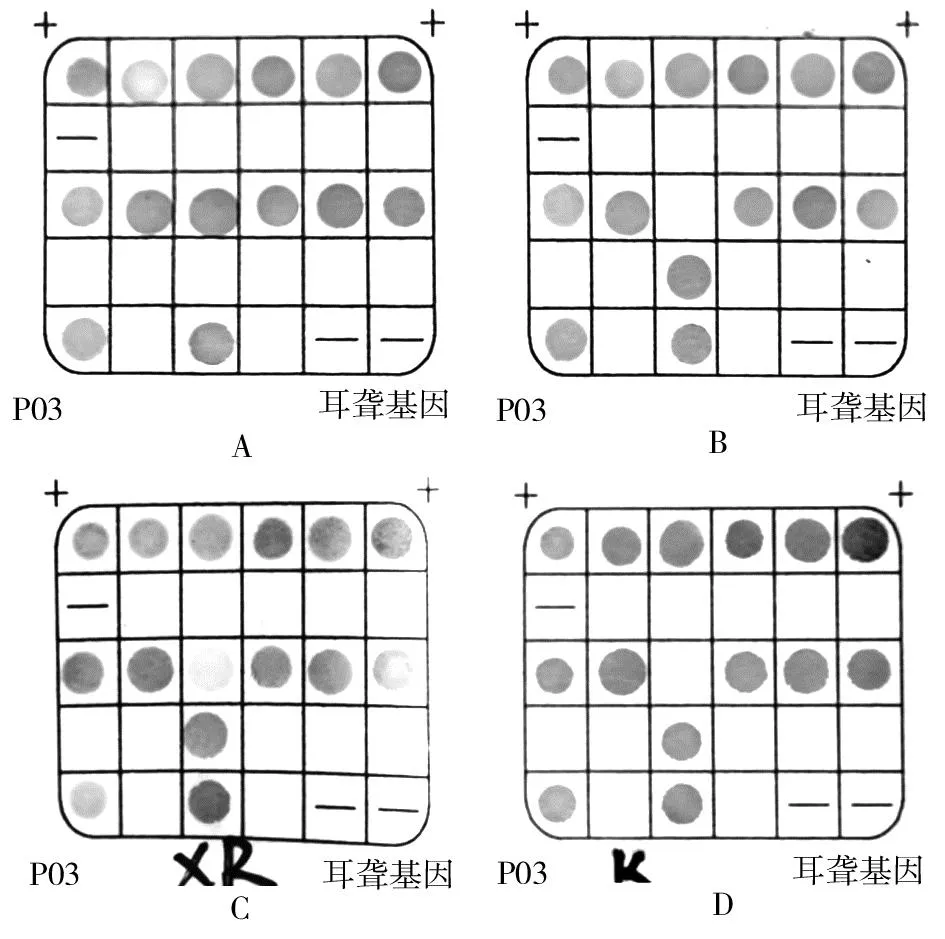
图1 mtDNA 7445A>G基因位点突变患者及其家人基因检测结果A.先证者父亲mtDNA 7445A>G未见突变;B.先证者mtDNA 7445A>G均质突变;C.先证者母亲mtDNA 7445A>G异质突变;D.先证者弟弟mtDNA 7445A>G异质突变。
1.3.2 基因测序结果 对候选基因突变位点进行测序验证,显示与基因检测结果一致(图2)。
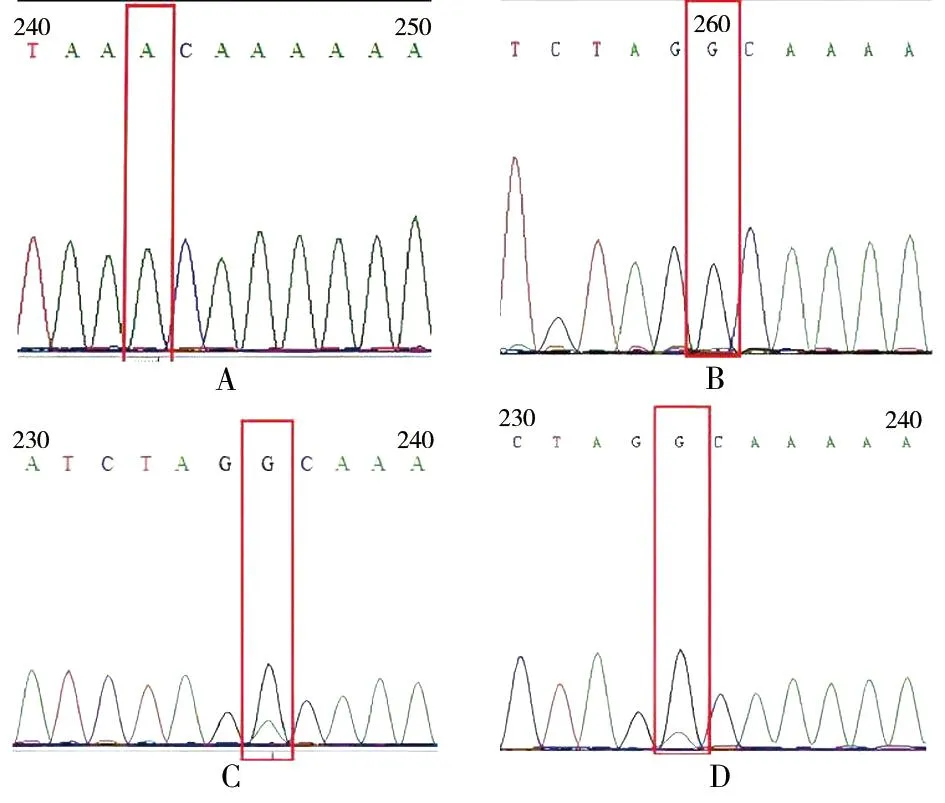
图2 mtDNA 7445A>G基因位点突变患者及其家人测序结果(突变位置使用红框标注)A.先证者父亲mtDNA 7445A>G未见突变;B.先证者mtDNA 7445A>G均质突变;C.先证者母亲mtDNA 7445A>G异质突变;D.先证者弟弟mtDNA 7445A>G异质突变。
2 讨 论
听力丧失是一种常见的交流障碍,全球每1000个活产新生儿中就有1~3个受到影响[7]。世界卫生组织调查数据显示,在3.6亿听力丧失的患者中,有3200万是儿童[7]。目前,新生儿听力筛查技术在我国已广泛开展,由于可能会对迟发性听力损失患儿漏诊,且不能对耳聋进行病因学诊断,因而具有一定的局限性[9]。本文中采用的耳聋易感基因变异筛查技术,不但能够发现先天性遗传性耳聋患者,更重要的是能及早发现常规物理听力筛查漏检的药物敏感性和迟发性耳聋基因携带者,同时对耳聋进行遗传学诊断,为患者家庭提供遗传咨询、治疗决策和预后判断。
耳聋易感基因检测结果显示该患者为线粒体DNA 7445A>G位点突变。线粒体DNA为母系遗传基因,我们对该患者家庭成员进行检测证实并进一步研究。据文献[10]报道,线粒体DNA容易受到氧自由基的攻击,并且由于缺少组蛋白保护与有效的自我修复机制,因而突变率高。完整的线粒体DNA测序可以检测致病性突变,目前报道的线粒体DNA常见突变基因有12SrRNA与tRNA[7,8]。本研究家庭的突变位点7445A>G为线粒体tRNA突变,位于tRNASer(UCN)转录前体3’末端[11,12],目前发现该位点的突变方式除7445A>G外,还有7445A>C和7445A>T 两种[11]。7445A>G突变可降低tRNASer(UCN)稳定性,导致线粒体tRNA代谢功能衰竭,影响线粒体内多肽合成以及ATP产生,改变线粒体呼吸作用和功能[7,8],逐渐引起毛细胞萎缩甚至凋亡,从而造成非综合征型耳聋[13];同时7445A>G突变可导致读取相邻细胞色素氧化酶基因CO1的终止密码子AGA,从而向多肽的C-末端添加3个氨基酸(Lys-Gln-Lys)[7,8,14],轻链RNA前体在加工过程中产生缺陷[8],使细胞色素C氧化酶肽链延长,改变细胞色素C氧化酶空间结构与生理功能,最终导致耳聋[12]。7445A>C、7445A>T 突变的致病机制可能与7445A>G相似[11,14]。
线粒体DNA突变型与野生型共存的现象称为线粒体DNA异质性[10,15]。研究发现,异质性可以促进肿瘤的生长,并与衰老密切相关[16]。本病例仅存在线粒体DNA突变型,且为均质突变;患者母亲及弟弟线粒体DNA突变型与野生型共存,为异质突变。在异质性细胞中,致病性线粒体DNA突变的表型由突变型和野生型基因组的比例决定,如果比例达到阈值,则导致疾病的发生[10,17],这可能为该患者出现临床症状的原因之一。而该患者与其母亲、弟弟的基因型不同,可能有多方面原因。据研究,线粒体DNA与核DNA不同,是伴随细胞质分裂偶然地随机不等地分配到子细胞中的[18],如果母细胞中存在异质性变异,即使是突变水平低至0.15%的异质性变异,在人类中也是具有遗传性的。通过随机遗传漂变,子细胞获得的突变基因比例是不同的,因而可呈现出不同的异质性水平,这种随机分配导致的线粒体DNA异质性变化的过程称为复制分离[19]。随后,子细胞作为新的母细胞进行分裂,从而扩大这种异质性水平范围[20]。异质性水平可以在同一家族不同个体、同一个体不同器官甚至同一器官或组织不同细胞之间有所不同,也就是说具有相同核DNA的细胞或者个体,如一卵双生,其细胞质基因型可以不同,从而表型也有所差异[21]。在人类中,线粒体DNA通常仅通过母系传递给后代,具有低水平有害异质性线粒体DNA突变的临床无症状女性可能将其致病突变传递给所有后代,导致线粒体DNA功能障碍和疾病[15,22]。受影响后代临床症状的严重程度通常与线粒体DNA异质性水平(即有害突变的百分比)有关[15]。
目前认为,来自同一个母本的不同后代之间基因异质性水平的差异发生在初级卵母细胞形成之前,在卵母细胞发育早期,每个细胞的线粒体DNA拷贝数下降到相对较低的值,成为线粒体DNA遗传的瓶颈,这种对线粒体基因拷贝数量的限制导致了快速遗传漂变,使得等位基因的频率发生剧烈变化,从而造成母体与子代之间异质性水平不同[23]。对已知致病性线粒体DNA突变家族的研究表明,突变水平在母亲和后代之间可能有很大的变化[16,21]。遗传漂变理论预测,随着母体突变水平的降低,后代突变水平可能会下降,这种非常低水平异质突变变异的减少可能使它们在几代间更稳定[16]。遗传瓶颈应该作为限制具有非常低突变水平的线粒体DNA突变遗传的障碍,因为这些低水平突变通过瓶颈到达后代的概率应该很低。线粒体DNA突变是否在母亲和孩子之间的线粒体瓶颈中存活下来,这是理解线粒体DNA变异,包括致病变异,如何在家族中建立的重要关键。原则上,线粒体DNA从母体遗传到后代的瓶颈可以有效地过滤掉低水平突变[16],也就是说对于一个有害的异质体,严重的遗传瓶颈可能会在子代突然转化为良性(低频率)的致病水平[18]。但是除遗传漂变外,有些低水平的线粒体DNA突变能够通过“主动选择”传递给子代,这种机制不仅能使突变的线粒体DNA有效通过遗传瓶颈,还能使致病的线粒体DNA突变逃避自身修复机制[20]。即使是低水平线粒体DNA的异质性也是至关重要的,因为每一个从头开始的线粒体DNA突变都必须从非常低的水平开始。由于从母亲传递到后代的线粒体DNA分子数量较少,遗传非常低水平的线粒体DNA突变的能力似乎确实相当有限。有证据表明,非常低水平的线粒体DNA突变的母体遗传,下降到0.15%的突变水平,确实发生在普通人群中。有可能有很多低水平的线粒体DNA突变,以至于即使有很深的瓶颈,一些变异仍然由后代遗传[16]。另外,有研究表明,母亲受孕年龄和自身异质性水平会对子代线粒体DNA异质性水平有一定影响,导致突变频率在母亲和孩子之间发生显著变化并致病[18]。
突变本身不足以产生临床表型,包括核背景、环境因素和线粒体单倍型在内的其他修饰因素对突变的表型表现也是必要的[1,7],因而线粒体DNA突变导致的疾病在个体家系和不同家系中会有所不同[1]。本研究家系家庭成员少导致样本量小,故存在一定的局限性,我们将扩大样本量,对耳聋基因线粒体DNA的遗传与致病机制进一步研究。

