以反晕征为主要CT表现的肺栓塞临床及影像特点分析
黄盛晶,周昌盛,张霖,卢璐,张小宇
温州医科大学附属苍南医院,浙江 温州 325800,1.呼吸与危重症医学科;2.放射科
肺栓塞(pulmonary embolism, PE)是各种栓子(包括血栓、脂肪、羊水、空气等)阻塞肺动脉及其分支,导致患者肺循环障碍的临床病理生理综合征,若不能及时确诊和治疗易造成患者死亡。早期诊断和治疗对降低PE患者的病死率至关重要,但PE的临床症状常不典型,实验室检查的敏感性和特异性较差,尤其D-二聚体不高时,容易出现漏误诊。影像学检查在PE的诊断中发挥了非常重要的作用。PE常可继发肺梗死(pulmonary infarclion, PI),其典型影像表现为胸膜下尖端指向肺门的楔形实变影,该征象对指导PE的早期诊断具有重要意义,但也有部分PE患者可表现为反晕征(reversed halo sign, RHS),甚至作为唯一征象存在,这类患者容易被误诊为肺炎、肺癌[1-2]。因此提高对PE患者RHS特点的认识,有助于指导PE的早期诊断,而目前国内相关病例报道较少。本文现对我院确诊的15例CT主要表现为RHS的PE病例进行了回顾性分析,总结其临床和影像特点,并结合相关文献复习,以加深对这一影像特征的认识,提高PE的早期诊断水平。
1 对象和方法
1.1 对象
收集2016 年1 月至2023 年4 月在温州医科大学附属苍南医院经CT肺动脉造影(computed tomographic pulmonary angiography, CTPA)检查确诊且以RHS为主要CT表现的PE住院患者的临床及影像学资料。纳入标准:①PE的诊断符合《肺血栓栓塞症诊治与预防指南》中的诊断标准[3];②经CTPA检查证实存在肺动脉栓塞;③胸部CT影像上可见RHS表现且排除以RHS为影像表现的其他肺部基础疾病,如机化性肺炎、肺真菌感染、肺结核等。排除标准:①缺乏CTPA检查结果;②临床资料不完善、图像不清晰影响分析者。
1.2 方法
收集患者的一般情况、临床表现、既往史、实验室指标、辅助检查、初步诊断、治疗方案、疗效等资料。实验室指标主要包括:白细胞计数(white blood cell, WBC)、C-反应蛋白(C-reactive protein, CRP)、 降钙素原(procalcitonin,PCT)、D-二聚体、肌钙蛋白、B型脑钠肽(B-type natriuretic peptide, BNP)/N端B型脑钠肽原(Nterminal pro-B-type natriuretic peptide, NTproBNP)等。辅助检查包括:胸部CT、CTPA、心电图、下肢静脉B超、心脏彩超等。
1.3 CT检查
所有患者均接受C T 平扫,采用美国G E Lightspeed 64 排螺旋CT机,扫描参数:管电压 120 kVp,自动管电流调制,扫面层厚1 mm,层间距1 mm。肺窗窗宽1 600 Hu,窗位-500 Hu;纵隔窗窗宽350 Hu,窗位50 Hu。CTPA扫描采用高压注射器经肘静脉注射对比剂碘帕醇(370 mgI/mL,上海博莱科信谊药业有限责任公司),剂量为1.5 mL/kg,流率4.5 mL/s。所有图像经PACS系统传输至工作站供医师阅片。
1.4 影像分析
由1名呼吸科副主任医师和1名放射科副主任医师分别独立对存在RHS的病例进行CT影像分析,观察记录RHS的数量、分布位置、形态、病灶内部、边缘及有无胸腔积液等情况。意见不一致时协商达成统一。
2 结果
2.1 临床资料
2016年1月至2023年4月在我院经CTPA检查确诊的PE住院患者共214 例,其中出现PI表现者46例。本次研究共纳入CT检查可见RHS表现的患者15例,其中男9例,女6例,年龄15~86(58.9±19.2)岁。从发病至就诊病程10 h~15 d不等。临床症状表现包括胸痛10例、呼吸困难11例、胸闷3例、痰中带血4例、咳嗽咳痰10例、发热8例(以中低热为主,体温37.4~38.1 ℃)、意识改变1例。既往史方面,无基础疾病5例,早期妊娠状态1例,≤1个月外科手术史者3 例,恶性肿瘤2 例(乙状结肠肿瘤、非霍奇金淋巴瘤),高血压4例,房颤2例,糖尿病2例,心功能不全2例,肝硬化1例。辅助检查中,WBC升高7例[(9.56~11.92)×109/L],CRP升高14例[(6.92~193.69)mg/L],PCT升高5例 [(0.092~0.18)ng/mL]。合并I型呼吸衰竭者4例,15例患者均有不同程度的D-二聚体升高[(0.96~25.77)μg/mL],合并下肢静脉血栓形成者8例。15例患者入院时初步诊断肺炎者11例,心功能不全者2例,仅2例因D-二聚体明显升高而首先怀疑PE。入院到确诊时间为5 h~7 d,平均(3.5±2.1)d。所有患者确诊后均给予治疗剂量的低分子肝素(据体质量给药)、华法林片(据INR调整用量)/利伐沙班片(前3周予负荷剂量15 mg,2次/d,后改为20 mg,1次/d)规范化抗凝治疗,疗程3~6个月,2例长期抗凝,门诊随访时间3~66个月,复查肺部RHS病灶均有吸收好转,部分残留少许纤维条索影。
2.2 影像表现
15例患者中共有16个RHS病灶,其中14例患者为单发RHS病灶,1例患者可见2个RHS病灶,见图1A。所有RHS病灶均位于胸膜下,右下肺10个,左下肺6个;RHS病灶形态多为椭圆形(12/16),还可见楔形(2/16)及驼峰样改变(2/16),病灶长轴平行于胸膜;RHS中心为低密度的磨玻璃阴影,周围绕以边界尚光整的实性环,同时11例患者合并少量胸腔积液。经规范化抗凝治疗3个月以上,肺部RHS病灶均有吸收好转,部分残留少许纤维条索影,胸腔积液减少消失。部分影像图片见图1。
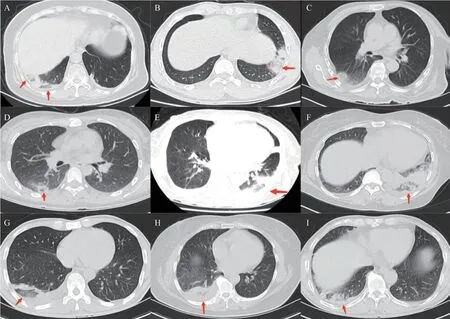
图1 部分胸部CT表现为反晕征的肺栓塞患者的影像学特点
3 讨论
RHS是一种特殊的胸部CT征象,影像表现为中心低密度的磨玻璃影,外周围绕高密度的环形实变影,区别于晕征(病灶中心为高密度,周围为新月形或环形磨玻璃密度影)。RHS首次报道于隐源性机化性肺炎(crypt-ogenicorganizing pneumonia,COP),并认为是其特征性表现,但此后陆续有研究发现该征象可见于多种疾病,包括感染性疾病、非感染性疾病以及肿瘤性疾病中,如侵袭性肺真菌感染、肺结核、结节病、肺癌、PE等,并无绝对特异 性[4]。近年来,RHS还被报道见于新冠[5-6]、鹦鹉热衣原体肺炎[7]、慢性嗜酸粒细胞肺炎等[8]。RHS虽可见于多种肺部疾病,特异性相对较低,但不同疾病所致RHS的影像特征各有差异[9],结合其他CT征象和临床数据,有助于缩小诊断范围,从而指导临床决策。
在非感染性疾病中,COP是RHS最常见的原因,COP患者的RSH可为单发,也可为多发,其最主要的影像特征为环壁厚度较薄(0.2~1.0 cm,平均 0.5 cm)、光滑而非结节状,这是其与肺真菌病、肺结核等疾病的鉴别要点[10-11]。此外,COP中RSH多分布于支气管血管束周围和胸膜下,病灶形态和大小具有反复性、游走性,与COP的病变特征相对 应[9]。COP常需要激素治疗,因此与感染的鉴别是临床关注的重点,感染性疾病中同样可以出现RHS,其中以肺结核和侵袭性肺真菌最常见。MARCHIORI等[11]比较了肺结核和COP患者的RHS特点,发现所有肺结核RHS的外周壁均由密集小结节围绕组成,同时绝大多数患者RHS中心可见密集微小结节,而COP患者的RHS均无此特征。国内学者的研究也发现外环和内晕均可见结节是结核中RHS最重要的特点,也是其与其他可见RHS的肺部疾病进行鉴别最可靠的征象之一[9]。强军等[12]还分析了肺结核RHS的CT演变特征,发现肺结核RHS外环以“树芽征”为主,以簇状微结节表现突出,中央以细网格影为主。在有效抗结核治疗后RHS整体密度减低、病灶缩小,最终多以细网格影长期存在。值得注意的是,结节病也可出现上述外周壁结节和内部小结节的RHS病灶,这是因为它们的病理基础类似,均为肉芽肿性结节,但结节病常伴有外周淋巴结、肺门及纵隔淋巴结肿大,此有助于与肺结核进行鉴别[4]。侵袭性肺真菌感染中,毛霉菌、曲霉菌、隐球菌、组织胞浆菌以及肺孢子菌等均可出现RHS。其中毛霉菌和曲霉菌为最主要的病原体,毛霉菌比曲霉菌感染更常见[13-14]。MARCHIORI等[10]研究发现伴RHS的真菌感染者其外周实变环通常较厚(>1 cm),且93%患者环中心可见网格状结构,常合并胸腔积液,而COP不会。故RHS伴较厚的实变环及中央网格状影多提示真菌感染可能,尤其是毛霉菌[15]。RHS征象在免疫缺陷患者中出现十分有意义,这些患者出现RHS时要考虑毛霉菌等侵袭性真菌感染可能。在肺癌中,RHS主要见于腺癌,且以单发多见,病灶一般为类圆形且边界较清晰,其病理机制可能是由于腺癌细胞沿细胞壁生长,导致各区域肿瘤生长速度不均一所 致[9,16]。任华等[17]研究发现,病灶最大径>9 mm及环的最大厚度>4 mm提示肿瘤的侵袭性。此外,肺癌中RHS还可见于放射治疗或射频消融后,其中心磨玻璃影考虑与肿瘤的凝固坏死有关[18]。
PE可继发PI,其典型影像表现为胸膜下尖端指向肺门的楔形实变影[19],但也有部分患者可表现为RHS,且多出现在PE的早期[20]。查阅PE所致RHS的相关文献,大多为个案或者几例、十几例的病例报告,可见其在PE中并非一种常见的影像学表现,可能不为临床医师所熟悉,易被误诊为肺炎等,尤其当D-二聚体无明显升高时。本研究中15例以RHS为主要CT表现的PE患者,临床症状主要表现为胸痛和呼吸困难,但仍有半数以上患者合并发热、咳嗽咳痰等症状,且相当一部分患者出现白细胞、CRP升 高,使得11例患者入院时初步诊断为肺炎并给予抗感染治疗,仅2例患者因D-二聚体明显升高而首先怀疑PE。如本组一例15岁的男性患者,既往体健,否认基础疾病史,因“左下胸痛伴低热3 d”入院,入院时查胸部CT示:左肺下叶炎症性病变,左侧胸腔少量积液,见图1B。实验室检查示WBC 10.58× 109/L、CRP 37.31 mg/L,D-二聚体1.79 μg/mL,初步误诊为社区获得性肺炎并给予抗感染治疗,上级医师查房后认为该患者有胸痛症状,且胸部CT表现为胸膜下RHS伴少许胸腔积液,需高度警惕PE可能,后经CTPA检查证实为左下肺动脉栓塞,求因检查提示该患者蛋白S<16.0%(参考值75.0%~130.0%),相关基因测序检出PROS1/NM_000313.4基因发生c.1680T>A(p.Tyr560*)杂合无义变异。此次误诊笔者意识到PE的诊断需要临床医生养成正确的习惯,应对患者的临床表现、实验室指标及影像学检查结果等进行综合分析,从而减少PE的误诊漏诊。也促使笔者加强了对RHS的认识和学习。
MANCANO等[21]报道约38.4%的PI病灶表现为RHS,国内张海平等[22]报道这一比率约45.6%。本研究共筛查出214例经CTPA确诊的PE住院患者,其中46例发生PI,15例具有RHS影像特征,RHS在明确PI的患者中发生率为32.6%,但在PE患者中发生率仅7.0%,属较少见征象,可能并不为临床医师所熟悉,故识别其影像特点对PE的早期诊断具有一定的临床意义。MANCANO等[21]分析了29例具有RHS特征的PI患者,结果显示25例(86.2%)为单个病灶,4例(13.8%)为两个病灶。所有RHS病灶均位于胸膜下,81.8%的病灶位于下叶,其中右下叶17个(51.5%),左下叶10个(30.3%),左舌叶5个,右上叶1个(3.0%)。在这33个病灶中,24个(72.7%)RHS呈卵圆形,9个(27.3%)呈圆形,且有72.4%(21/29)的患者出现胸腔积液。CASULLO等[23]以及张海平等[1]进行的相关研究亦得出了类似的结论,RHS病灶经治疗后逐渐缩小,演变为胸膜下纤维条索影。病灶数量上,本研究中15例具有RHS病灶的PI患者中有14例为单发病灶,仅1例患者可见2个RHS病灶,这与 CASULLO[23]及MANCANO等[21]的研究结果一致,他们研究亦显示PI患者的RHS病灶绝大多数为单发,偶可见2 个。但张海平等[1]报道30 例PI患者中有13例可见多发RHS病灶,不过其文中并未指明具体的数目。病灶分布及形态上,本研究中所有RHS病灶亦均位于双下肺胸膜下,其中以右下肺多见,形态多呈椭圆形,病灶长轴平行于胸膜,RHS中心为低密度的磨玻璃阴影,周围绕以边界尚光整的实性环,同时常合并少量胸腔积液,经治疗后RHS病灶均吸收好转,胸腔积液减少消失,这些特征与既往报道相仿[1,21,23]。PI患者的RHS病灶以双肺下叶多见,这与PI好发于双下肺动脉相关[24]。病灶常位于胸膜下,这是由于肺组织虽然有双重血供,但是支气管动脉在肺内中带的灌注好,在肺外周灌注相对较差,致使肺外周胸膜下位置更容易出现梗死灶[25]。病灶周围常合并少量胸腔积液,这是由于肺梗死导致胸膜刺激,从而出现少量胸腔积液[21]。MARCHIORI等[26]通过对比研究发现,PI患者的RHS病灶多为单发,3个以上的RHS病灶仅见于其他疾病所致,且有64.06%的患者出现胸腔积液,明显高于其他疾病的6.17%。结果提示患者若出现单个RHS病灶伴胸腔积液时需高度警惕PI可能。除了常合并胸腔积液外,PE患者中还可见到RHS病灶与盘状肺不张(Fleischner氏线)同时存在的罕见征象[27]。
综上所述,RHS在不同疾病中具有一定的影像学特点,了解不同疾病RHS的特点有助于疾病的早期诊断并减少误诊。PE患者的RHS病灶多位于胸膜下,下肺多见,单发为主,病灶形态多为椭圆形而非楔形,长轴平行于胸膜,同时常合并有少量胸腔积液。以RHS为主要CT表现的PE患者易被误诊为肺炎,对于具有上述影像特征的患者需警惕PE的可能。充分认识其影像特点并结合患者的临床表现、实验室指标等综合分析,有助于减少PE的误诊漏诊。虽然本研究病例数较少,总结出PE患者的RHS特征不一定全面,但仍有助于我们了解其临床和影像特点,从而提高PE的早期诊断率。

