维生素E合成路线研究进展
王子强, 邓家诚, 尹 实
(杭州下沙生物科技有限公司,浙江 杭州 310000)
维生素E是一类脂溶性化合物,因其与生育有关,故又名生育酚,在自然界中以8种结构的形式存在。根据其化学结构分为生育酚和生育三烯酚(图1)[1],根据来源不同分为天然维生素E和合成维生素E。
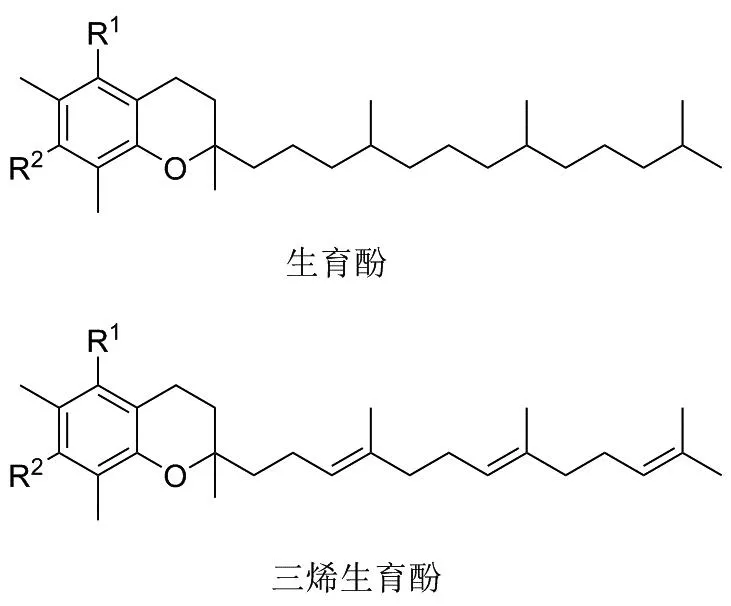
图1 维生素E的结构Figure 1 Structure of Vitamin E
自从二十世纪20年代从植物油中分离出维生素E后,人们对其药理性质以及合成方法进行了深入研究。1936年,化学家EVANS[2]成功分离出了维生素E结晶,并鉴定出其结构;1938年,KARRER等[3]首次化学合成维生素E,从此合成维生素E进入了大众的视野。天然的维生素E主要是从各种植物油、豆谷类和带叶蔬菜类提取,占市场比重的15%。维生素E的提取方法可以归结为4类:溶剂萃取、超临界流体萃取、分子蒸馏和离子吸附交换[4];工业合成上主要是合成α-维生素E,合成方法大同小异,均以侧链(异植物醇)和主环(三甲基氢醌)一步法合成(图2),侧链和主环的制备方法是得到高收率和高纯度维生素E的关键。

图2 维生素E的合成路线1Figure 2 Synthesis route 1 of Vitamin E
1 侧链合成
侧链异植物醇是一种烯醇类化合物,具有20个碳的长直链结构。纯的异植物醇是无色油状液体,有花草香味,不溶于水,是一种脂溶性溶剂,它是合成维生素E的必要途径之一。
1.1 假紫罗兰酮工艺
假紫罗兰酮是通过柠檬醛和丙酮在碱性条件下偶联合成的一种脂溶性化合物[5],再和乙炔发生2次炔基化,之后进行3次加氢还原反应,最后经2次缩合反应得到异植物醇(1a),如图3所示。该反应是一个碱催化的有机合成反应,其中一种合成方法是用镁铝水滑石催化,通过水化方法提高其活性[6],可使反应收率增加。该路线优点是所使用的原料比较低廉,反应路线常规,适合大规模化生产。不足之处在于反应所需要的设备要求较高,一些试剂如丙酮、乙炔和氢气的储存条件要求相对苛刻。
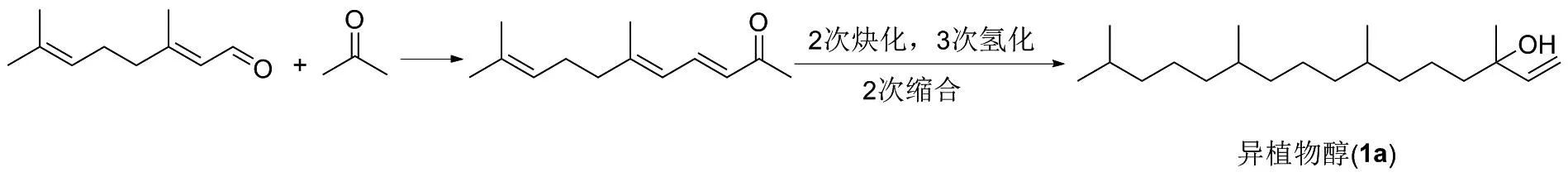
图3 异植物醇(1a)的合成路线1Figure 3 Synthesis route 1 of isophytol(1a)
原料天然柠檬醛一般是从山苍子鲜果内的山苍籽油中通过蒸馏方法提取,总体收率偏低。以异植物醇产量计算,总收率只有20%。并且天然提取的柠檬醛总量小,对于全球维生素E的需求量,其远远不能满足市场需求。因此,探究开发柠檬醛的合成路线十分必要。目前该化合物的合成路线大致分为异丁烯合成法[7](图4)和脱氢芳樟醇法[8](图5)。异丁烯法以异丁烯和甲醛加成形成烯醇,再通过异构化和氧化分别得到相应的目标化合物,随后二者经过缩合重排得到柠檬醛(2a)。脱氢芳樟醇法是利用丙酮和乙炔经过多步反应得到脱氢芳樟醇,之后经过重排得到柠檬醛。两种合成方法各有优缺点,优点在于二者所用到的原料都是常见试剂,并且成本低廉,原料来源不受限;缺点在于异丁烯合成法需要用到甲醛,该物质是一系列疾病的诱因,不利于人体健康;而脱氢芳樟醇法所用原料-丙酮的用量往往是上百倍,回收所需能耗大,成本相对较高。
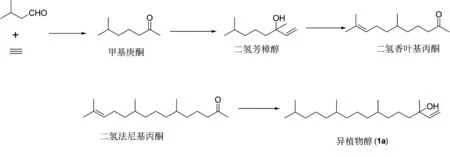

图4 异丁烯法合成柠檬醛(2a)Figure 4 Synthesis of citral(2a) by isobutylene method

图5 脱氢芳樟醇法合成柠檬醛(2a)Figure 5 Synthesis of citral(2a) by dehydrolinalool method
1.2 芳樟醇工艺
芳樟醇分子式为C10H18O,是一种无色液体,具有铃兰花香气,是最常用的也是用量最大的香料,常年在香精香料消耗量中排首位。工业上合成芳樟醇基本可以分为:罗氏法(Roche)、巴斯夫法(BASF)、异戊二烯法和异戊醛法。前3种合成方法均是经甲基庚烯酮合成芳樟醇,在经过加碳、还原得到异植物醇[5,7,9-10];第4种方法是由中国北沙制药优化后首次实现工业化,以异戊醛为原料和乙炔反应合成甲基庚酮,在经过中间体二氢芳樟醇、二氢香叶基丙酮和二氢法尼基丙酮等各个中间体后,最终得到异植物醇[11](图6)。
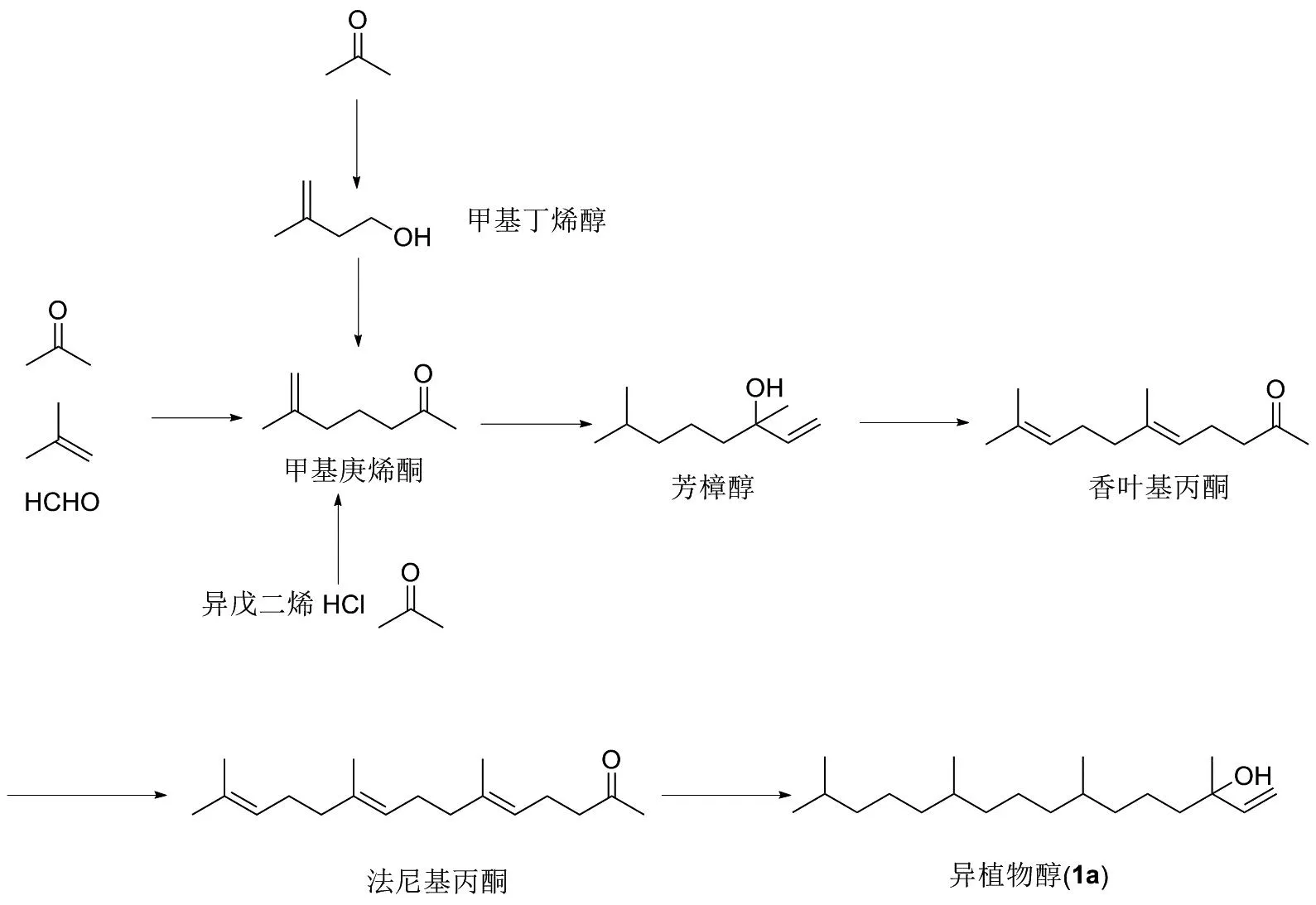
图6 异植物醇(1a)的合成路线2Figure 6 Synthesis route 2 of Isophytol(1a)
以上4种合成异植物醇的反应各自均有相应的缺点。异戊醛法在制备过程中所用乙炔易燃,易爆,危险系数大。其它3种路线采用了丙酮为起始原料,由于丙酮的沸点低,会导致丙酮的回收难度大,能耗高,并且反应过程中所用到的设备要求高,目前只有少数几家化工企业可以生产。
1.3 法尼烯工艺
法尼烯是一种微生物发酵物,通过改良的酵母将植物来源的糖分转变为各种烃分子,该方法是Amyris公司独有(独家专利),而RENNIGER等[12-14]在此基础上以法尼烯为原料,经过5步反应,加长碳链成异植物醇(图7)。通过选择合适的菌种[15-16],提取出菌种发酵液,再纯化分离得到目标产物法尼烯,该化合物再通过氢化,羟基化的方法得到异植物醇。

图7 异植物醇(1a)的合成路线3Figure 7 Synthesis route 3 of Isophytol(1a)
该路线绿色环保,成本低,对原有的假紫罗兰酮工艺和芳樟醇工艺造成很大的冲击,使整个维生素E行业进入了快速发展阶段,能特科技依靠此路线,短短3年跻身全球维生素前列,生产的维生素E市场占有率高达25%[17]。该路线的缺点在于筛选酵母菌种以及菌种改造提高转化率的技术壁垒高。法尼烯生成异植物醇的反应过程中所选用的试剂要定制合成。此外,生物法合成异植物醇所产生的废水量大,三废处理成本高。
1.4 偶联法
1979年,HANS等[18]通过发酵的方法得到甲基-γ-丁内酯,该化合物就被应用在合成维生素E侧链的研究上。先开环溴代,然后再经过格氏试剂偶联[19]得到维生素E侧链3a(图8),或者通过Wittig反应[20]得到侧链,再与母环反应制备维生素E(图9)。 2006年,黄贤贵等[21]通过以皂苷元的降解废弃物为原料,经过开环,历经2次碳碳偶联,最终合成维生素E侧链4a(图10)。
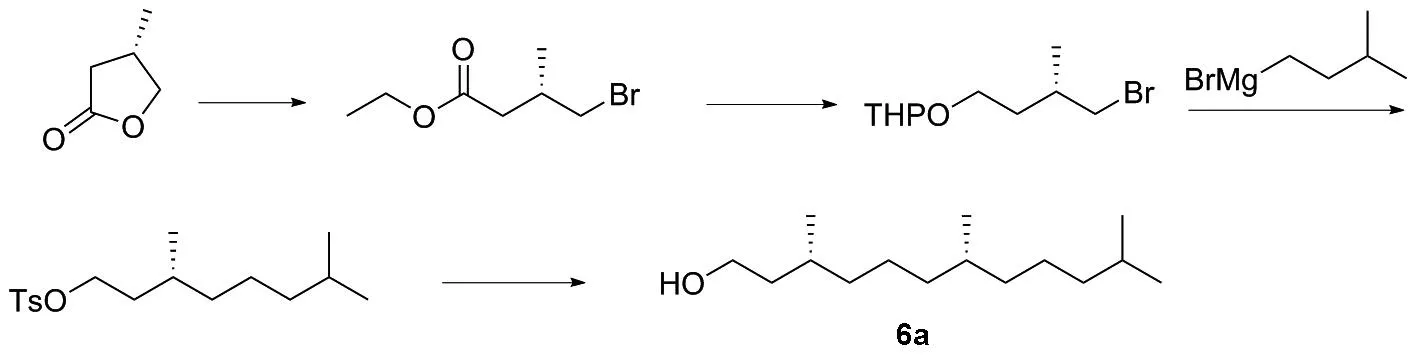
图8 化合物3a的合成路线Figure 8 Synthesis route of compound 3a

图9 维生素E的合成路线2Figure 9 Synthesis route 2 of Vitamin E
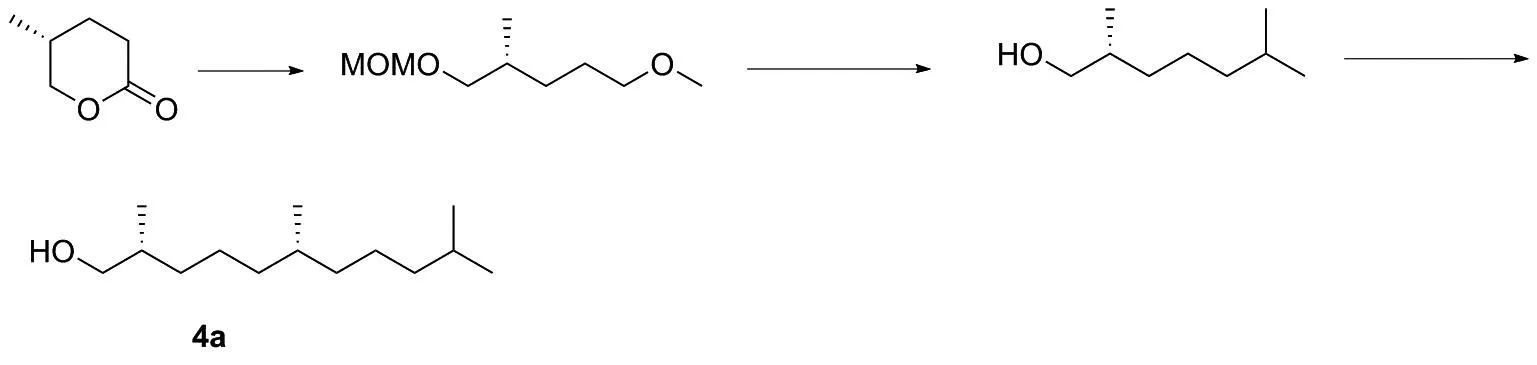
图10 化合物4a的合成路线Figure 10 Synthesis route of compound 4a
该方法合成路线短,收率高,操作过程简单,反应条件较为温和;反应路线的不足之处在于反应原料不易得,反应过程中需要用到格氏试剂,且制备过程中对溶剂的水含量和反应环境中的氧气含量要求高。此外还有着不引发或者积累引发的情况,会有冲料的风险。该路线和上述路线选用的原料相同,反应条件温和,路线较短,但是该路线在反应过程中不易控制,例如会过度还原。反应后产生的三苯基氧磷会引起水源的富营养化,后处理比较繁琐。该路线所用的原料来源于降解物,物料的价格便宜,但是其总量太少,不适用于大规模生产。保护羟基所需要的MOM总量大,是原料当量的5倍以上。
1.5 生物法
TAKABE等[22]用Porcine pancreatic lipase(PPL)选择性催化水解双酯化合物,从而得到侧链前体,经过还原,消除得到维生素E侧链;另一种方法是通过乙酰化酶Lipase PS转化二醇变为单醇,再和格氏试剂偶联[22]增加碳链,再经还原合成维生素E侧链(图11)。两条路线,操作简单,所选用的试剂,大部分为常用试剂,但是在化合物4a合成过程中用到的MsCl是管制品,剧毒;化合物5a合成的过程中所用到的格氏试剂制备较为繁琐。此外,两条合成路线都要选择酶去催化水解反应原料,酶的培养耗费时间较长。

图11 化合物4a和5a的合成路线Figure 11 Synthesis routes of compound 4a and 5a
2 主环合成
三甲基氢醌是一种白色针状结晶,易溶于醇酮有机溶剂,属于苯类化合物。其工业合成路线大致可分为:对二甲苯法、巴豆醛法、对叔丁基苯酚法、间甲苯酚法和异佛尔酮法。
2.1 对二甲苯法
乔建成等[24]以对二甲苯为原料,经过浓硫酸磺化、氢氧化钠中和、二氧化硫酸化得2,5-二甲基苯酚,然后在邻位定位甲基化得到产品三甲基苯酚,最终经过反应得到三甲基氢醌(6a)(图12)。该反应原料易得,反应原理简单,但是用到的强酸性溶剂对设备腐蚀性大。磺化反应属于18类危险工艺,对操作人员专业要求高,并且选择性甲基化对反应条件的要求严格,大工业生产壁垒高。
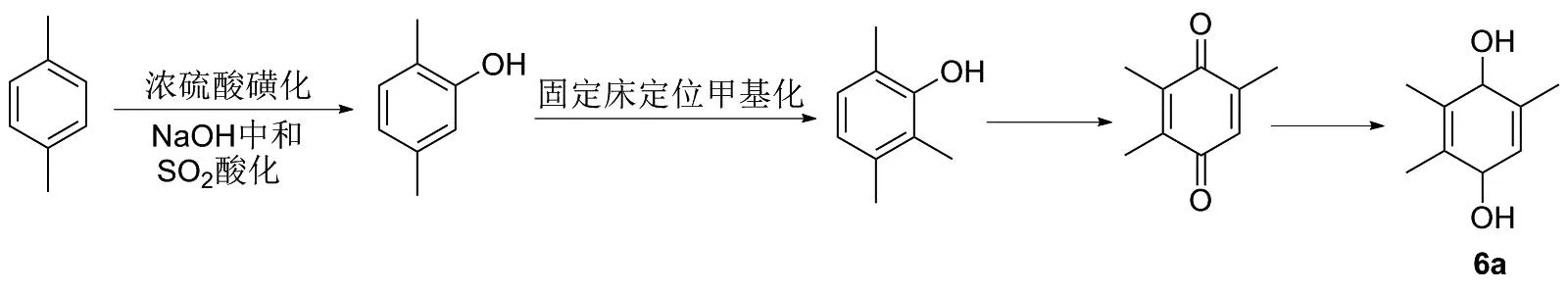
图12 化合物6a的合成路线1Figure 12 Synthesis route 1 of compound 6a
2.2 巴豆醛法
巴豆醛法是巴斯夫首先采用,并进行工业化生产,故又称为BASF法[22-24]。它以巴豆醛和戊酮为原料缩合生成三甲基环己烯酮,经过脱氢消除反应得到三甲基苯酚,之后氧化得到三甲基苯醌,最后经过还原反应得到三甲基氢醌(图13)。该合成路线原料用量大,合成收率低且耗能较多,目前大规模生产只有巴斯夫在使用。
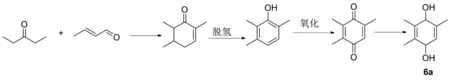
图13 化合物6a的合成路线2Figure 13 Synthesis route 2 of compound 6a
2.3 对叔丁基苯酚法
2012年,乔建成等[24-25]开发新工艺路线,该路线以对叔丁基苯酚为原料,经过与甲醇偶联合成三甲基叔丁基苯酚,然后经质量分数为1%的浓硫酸消除脱掉叔丁基得到三甲基苯酚,之后经过空气氧化得到三甲基苯醌,最后与H2加成还原得到三甲基氢醌[25-26](图14)。该路线反应过程简单,易操作,所需原料易得,但过程中有一步氧化温度较高(170~220 ℃),属于18类危险工艺之一,并且还原过程用到了H2,属于易燃易爆气体,对操作过程的把控要求高。

图14 化合物6a的合成路线3Figure 14 Synthesis route 3 of compound 6a
2.4 间甲苯酚法
路线4是最早合成维生素E母环的路线。首先是通过间甲基苯酚和甲醇偶联反应合成三甲基苯酚,再经过空气氧化得到三甲基苯醌,之后经过H2还原得到三甲基氢醌(图15)。该条路线工艺流程短,产品收率高,成本低[27],但原料大部分依赖于进口,国内生产能力不足。此外在还原过程中用到了氢气,该物质易燃易爆,对储存位置和设备要求高。
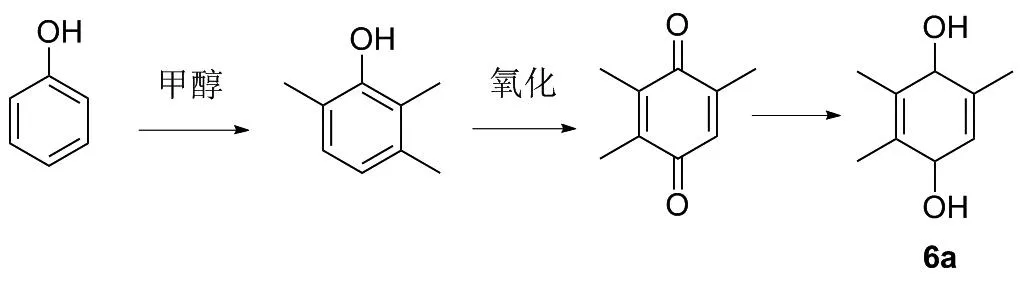
图15 化合物6a的合成路线4Figure 15 Synthesis route 4 of compound 6a
2.5 异佛尔酮法
异佛尔酮是一种广泛使用的化工品,通常用在油脂、聚乙烯树脂中,同时也可以作为三甲基氢醌的原料。21世纪初,新和成(NHU)为满足维生素E产能扩大的需要,并形成自己的维生素E产业链。通过与曾庆宇等[28]合作,开发出以丙酮为原料制备α-异佛尔酮的工艺,路线选择率高达93%。该工艺采用重金属催化方式使α-异佛尔酮重排为β-异佛尔酮,随后氧化得到茶香酮,最后经过重排酰化得到三甲基氢醌(图16)。

图16 化合物6a的合成路线5Figure 16 Synthesis route 5 of compound 6a
该路线的关键点是α-异佛尔酮重排为β-异佛尔酮需要加催化剂以及特定的助活剂[29-30],因为反应条件的不同,转化率以及产品的纯度有着很大的不同;另一个关键点是茶香酮转变为三甲基氢醌,需要用某些特定的酸,酸腐蚀性较强,会影响设备的使用寿命,故研发新型的催化剂是该路线未来探究的方向之一。此外,该路线所用的原料便宜、绿色且环保。
2.6 苯酚法
乔建成等[25]开发苯酚制备三甲基氢醌,首先是以苯酚为原料,再经过甲基化得到三甲基苯酚,最后经氧化、还原2步反应得到三甲基氢醌(图17)。该路线步骤短,收率高,所用到的试剂是常见试剂,且价格相对便宜。不足之处在于所需要的原料苯酚来源受限,基本依靠进口。此外,在重排反应阶段,所需要的操作条件相对严格,需要专业的技术人员操作。

图17 化合物6a的合成路线6Figure 17 Synthesis route 6 of compound 6a
2.7 偏三甲苯法
以偏三甲苯为原料,经过浓硫酸磺化,浓硝酸硝化,H2还原、水解、还原得到三甲基苯酚。再经过氧化、还原得到三甲基氢醌(图18)。该路线虽然有着物料来源易得,成本较低等优点,但是合成步骤繁琐,收率低,对设备要求高,存在环境污染严重等因素,目前工业生产上基本淘汰[31]。

图18 化合物6a的合成路线7Figure 18 Synthesis route 7 of compound 6a
2.8 5-异丙基偏三甲苯法
以5-异丙基偏三甲苯为原料,经过磺化、碱溶、消除异丙基得到三甲基苯酚,再经过氧化、还原得到三甲基氢醌(图19)。该反应路线短,所选用的试剂成本低廉,但是物料纯度低,原料中含有6-异丙基偏三甲苯,反应收率低,反应过程中会有大量副产物生成,现在基本不能用于工业生产中。
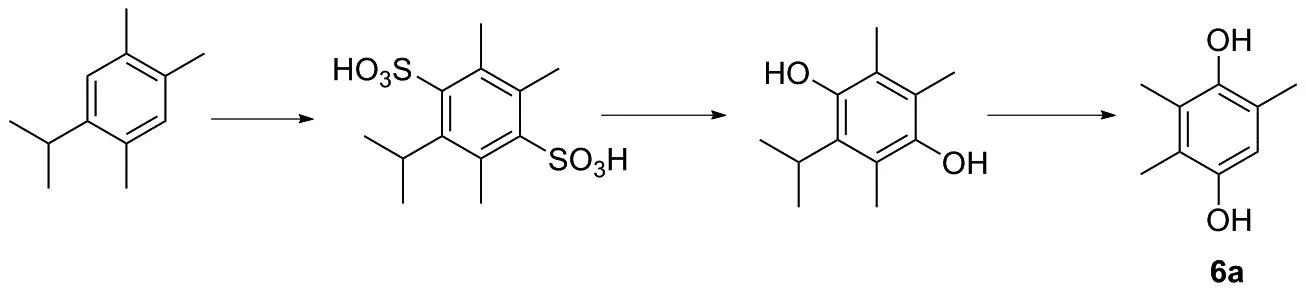
图19 化合物6a的合成路线8Figure 19 Synthesis route 8 of compound 6a
2.9 拆分法
1981年,COHEN等[32]报道了用S-α-甲基苄胺拆分某一化合物,再将拆分出来的S构型历经酯化、开环、磺化、还原和成环等反应过程,合成相应的R构型甲酯类化合物。2000年,ODINOKOV[33]也报道了类似的合成路线(图20)。此外,外消旋体还可以通过相应的酶催化法进行拆分,1993年,MIZUGUCHI等[34]通过酶催化酚羟基化合物进行选择性乙酰酯化,拆分得到R构型和S构型维生素E母环(图21)。 2000年,AKTIA等[35]报道了用酶拆分维生素E的母体骨架(图22)。
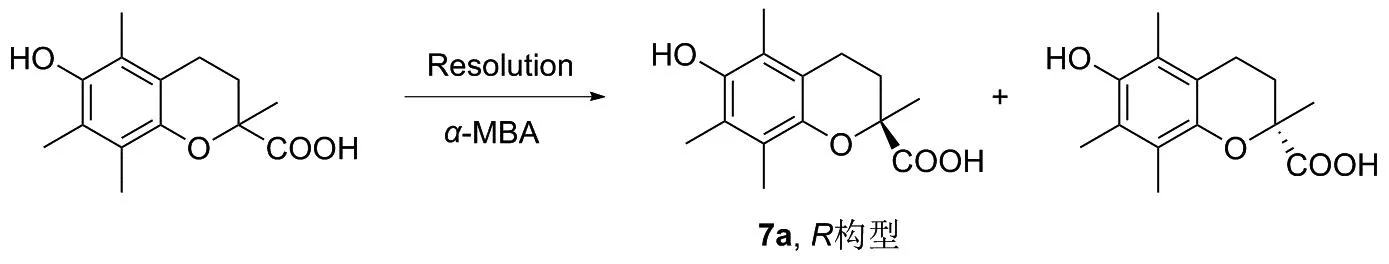
图20 化合物7a的拆分Figure 20 Split of compound 7a

图21 化合物9a的拆分Figure 21 Split of compound 9a

图22 化合物8a的拆分Figure 22 Split of compound 8a
上述3条路线拆分出来R构型的维生素E母环,而S构型的维生素E是废弃物。这2种拆分得到的产物收率最多为50%,原子利用率低。S构型的废弃物没有通过其它的方法转变为R构型目标物。此外,原料价格昂贵。这3种拆分的方法不适用于大规模化生产。
2.10 不对称合成
由于20世纪80年代不对称合成蓬勃发展,维生素E母核的合成也有了其它的方法,例如Shapless双羟化法、Shapless环氧化和不对称烷基化等。
SAKITO等[36]以季碳醛为原料,经过硼氢化钠还原、羟基保护等一系列反应合成维生素E母环;TAKANO等[37]等从植物醇出发,通过双键环氧化、开环、端基炔氢化、与苯环偶联、环合等过程最终得到维生素E(图23)。这两条路线较为简单,所使用的辅料常见,反应条件温和,但是最后合成化合物10a的成环反应中需要选用特定的催化剂,反应收率只有40%。此外反应原料价格较为昂贵,规模化生产困难。

图23 化合物10a和11a的合成路线Figure 23 Synthesis route of compounds 10a and 11a
SHAPLESS等[38]通过以季碳酮为原料,经过HWE反应,双键环氧化、保护、Shapless环氧化、开环、脱保护成环得到维生素E母环(图24)。该路线为典型反应,但是反应条件相对较高。例如乙酰基保护转变为MOM保护,该步骤不仅要一步法转变保护基,还要保证伯碳的羟基不变,反应条件要求严格,并且由于合成路线长,最终收率低于其它合成方法。

图24 化合物10a的合成路线1Figure 24 Synthesis route 1 of compound 10a
TIETZE等[39]通过Shapless双羟化的方法得到了产品,首先以对苯甲醚类似物为原料,经过碘代、偶联、脱水、双羟化、还原和环合等步骤,合成维生素E母环(图25)。该路线步骤长,操作繁琐,构建羟基手性中间体的反应收率低,且原料昂贵。
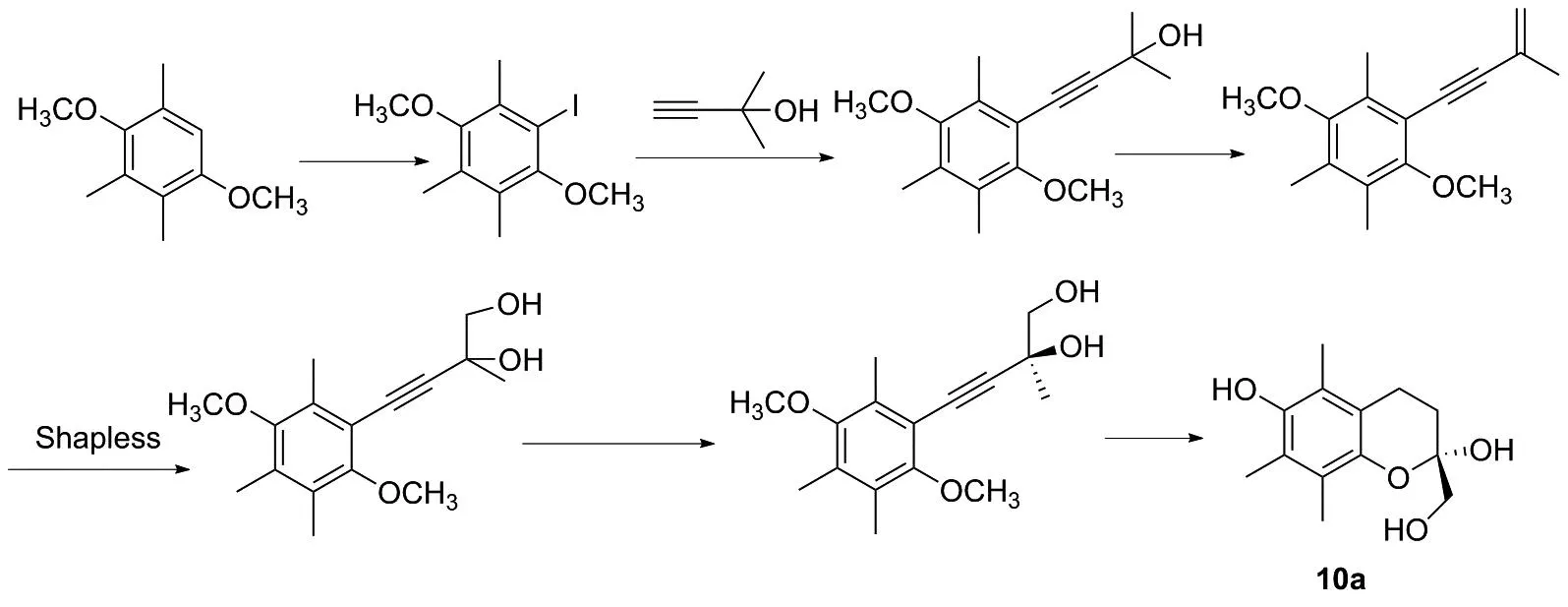
图25 化合物10a的合成路线2Figure 25 Synthesis route 2 of compound 10a
TIETZE等[40]还通过改造炔烃不对称烷基化,进而与苯醚类化合物反应构建维生素E母环(图26)。该路线反应路线长,收率较低,不符合绿色化学的观念。此外,反应过程中用到的试剂总体价格较高,并且构建手性中间体的过程中,容易产生消旋体,导致后续分离难度加大。

图26 化合物10a的合成路线3Figure 26 Synthesis route 3 of compound 10a
维生素E自从分离出结晶并确定了化学结构式及其药理活性之后,需求量逐年增大,目前合成维生素E已经在市场占有率中达到80%以上,工业上合成维生素E的途径有很多种方法,但各有利弊。工业上合成异植物醇的方法包括假罗兰酮工艺、芳樟醇工艺和法尼烯工艺。这3种工艺都要经历催化加氢、质子酸催化,对设备腐蚀性很大,要求较高。然而一些小分子合成法原料价格昂贵,不适合大规模生产。因此开发出更加简单、环保的合成工艺是市场定位导向。此外,一些生物合成法在制备异植物醇方面有了突破,但是属于Amyris公司独有专利,目前还没有其它企业在该方面有所建树;故此对于侧链的合成,法尼烯工艺是最适合国内企业的生产,一方面由于原料来源不受限,另一方面是因为合成生物学是未来发展的方向。
目前主环合成,如对甲苯酚法、对二甲苯法和叔丁基苯酚法等路线基本上受到物料来源方面的限制。其次异弗尔酮合成法、巴豆醛法合成主环的方法对设备要求严格,技术壁垒高。拆分法合成维生素E主环,一方面是由于原料价格昂贵,另一方面是因为拆分的收率达不到预期要求,原子利用率低,不能应用于生产中。不对称合成维生素E主环的方法,都有着原料价格昂贵,构建手性中心比较困难等问题,所以也不能应用于工业化生产中。以上几种合成主环方法中,不受来源限制的工艺为异弗尔酮合成法,为目前最优先考虑合成主环的方法。该路线用的是廉价的丙酮作为起始原料,但该路线也有不甚如意的方面。因此,开发新路线合成三甲基氢醌是促进维生素E产能扩大的发展方向之一。
综上所述,维生素E路线的革新之路还很长,主环的研究刚刚起步,因此寻找一种绿色、环保且成本低廉的合成方法是未来研究的方向。

