南方红豆杉转录组SSR 位点分析及其分子标记开发
蒋路园 ,吴文丽,张恺恺,张林凤,邵芬娟,陈段芬,邱德有,杨艳芳*
1. 中国林业科学研究院林业研究所 林木遗传育种全国重点实验室,国家林业局林木培育重点实验室,北京 100091
2. 河北农业大学园艺学院,河北 保定 071001
红豆杉属Taxusspp.植物,俗称紫杉,不仅具有较高的观赏价值,更是抗癌药物紫杉醇的重要原材料,具有极高的药用价值。红豆杉属植物主要分布在北半球,全球有11 个种[1]。南方红豆杉TaxuschinensisSmith var.mairei, Lemee et Lévl S.Y. Hu et Liu 又称美丽红豆杉,是中国红豆杉T.chinensis(Pilg.) Rehd.的变种,在我国分布范围最广。自1985 年美国国立癌症研究院发现红豆杉属植物含有多种抗肿瘤活性成分后,人类为谋取暴利随意采伐,导致南方红豆杉自然资源日益减少[2]。红豆杉资源保护及可持续开发利用是影响红豆杉产业发展的关键问题。
简单重复序列标记(simple sequence repeats,SSR),又称短串联重复序列或微卫星标记,是一类由几个核苷酸(1~6 个)为重复单位组成的长达几十个核苷酸的重复序列,长度较短,且广泛分布于真核生物基因组中[3]。由于重复单位的核苷酸不同以及重复次数不完全相同,造成SSR 长度的高度变异性。SSR 遵循孟德尔遗传方式,呈共显性遗传,具有数量丰富、高度多态性、可靠性好、检测快速等特征,已成为群体遗传学分析中的一个有用的标记系统,被广泛应用于遗传图谱的构建、种质资源遗传多样性研究、遗传关系与分化及群体结构分析等领域。此外,近年来,有研究发现SSR 还可能对植物的逆境胁迫响应有重要作用[4]。
目前,已有研究者在红豆杉中开发出了多个具有多态性的SSR 分子标记[5-11],并利用SSR 分子标记技术在红豆杉中开展相关研究,如国外研究者利用SSR 分子标记技术研究了生境断裂对欧洲红豆杉T.baccataL.的遗传结构的影响[12],国内研究者也通过SSR 技术发现生境断裂是导致云南红豆杉T.yunnanensisCheng et L. K. Fu 显著遗传瓶颈、近亲繁殖和种群分化主要原因[13]。开发南方红豆杉SSR分子标记,了解南方红豆杉的遗传多样性,对南方红豆杉资源保护、育种和遗传改良非常重要。
赤霉素(gibberellin A3,GA3)和紫杉醇同为二萜类化合物,在生物合成途径中存在底物竞争关系。前人研究表明,GA3处理可以提高红豆杉中紫杉醇产量[14],紫杉醇合成关键酶基因的启动子序列含有GA3应答成分[15]。因此,基于GA3处理南方红豆杉转录组数据开发SSR 标记,有可能获得紫杉醇合成相关的SSR 位点。
随着科技发展,下一代测序技术(nextgeneration sequencing,NGS)的出现使得SSR 标记快速经济开发成为现实。目前,人们已经基于组学数据对包含红豆杉在内的多种植物开发获得了一些具有多态性的标记[5,8-10],然而,目前可检索到的南方红豆杉SSR 标记数量仅有少量具有多态性,远远不能满足南方红豆杉遗传多样性等研究。本课题组前期利用RNA-seq 技术对GA3处理下的南方红豆杉的叶片进行了转录组测序,本研究基于此转录组数据对SSR 分子标记进行了鉴定和分析,并开发出了13 对具有多态性的SSR 标记,丰富南方红豆杉SSR 标记数量,为红豆杉品种鉴定、分子辅助标记育种和遗传多样性分析提供理论基础。
1 材料、仪器及试剂
南方红豆杉T.chinensisSmith var.mairei,Lemee et Lévl S. Y. Hu et Liu、东北红豆杉T.cuspidataSiebold & Zucc.和曼地亚红豆杉T. ×mediaRehder 材料经中国林业科学研究院林业研究所杨艳芳研究员鉴定后,分别种植于中国林业科学研究院科研温室和廊坊种植基地,样品信息见表1。

表1 样本信息Table 1 Sample information
3730XL 型基因测序仪(Applied Biosystems)、veritiTM96 型PCR 仪(Thermo Fisher Scientific)、5430R 型离心机(Eppendrof)、NanoDrop 分光光度计(Gene Company Limited)等。本实验所用主要试剂包括:CTAB(北京酷来搏科技有限公司)、TaqDNA 聚合酶(康为世纪生物科技股份有限公司)、琼脂糖(南京森贝伽生物科技有限公司)、TAE buffer(北京酷来搏科技有限公司)、ddH2O(北京酷来搏科技有限公司)等。
2 方法
2.1 样品的处理
5 年生南方红豆杉种植于中国林业科学研究院科研温室,利用200 µmol/L GA3分别在上午9:00 和下午15:00 喷施于红豆杉叶片,处理2 d 后,于第3天上午9:00 收集叶片,液氮速冻后保存在-80 ℃冰箱,用于后续转录组测序。纯水处理作为对照。样品经过RNA 提取、cDNA 文库构建质检合格后,采用Illumina 测序平台进行转录组测序,过滤原始数据后,采用Trinity 软件进行组装。
2.2 红豆杉基因组DNA 提取
温室中的红豆杉叶片采集后立刻置于液氮中,放置-80 ℃冰箱。廊坊基地红豆杉叶片于采集时装入含有硅胶的自封袋中进行干燥。样品通过液氮研磨后用于基因组DNA 提取。提取方法采用mCTAB法(modified CTAB method)[16],在1%的琼脂糖凝胶电泳检测完整度,并根据Nanodrop 测定将DNA原液稀释至50 ng/μL 保存于-20 ℃条件下用于后续实验。
2.3 红豆杉转录组SSR 位点的筛选及引物设计
使用MISA 软件对南方红豆杉转录组数据进行SSR 分析,搜索SSR 位点。可搜索单核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸和六核苷酸,最小重复数分别设置为10、6、5、5、5、5 次。采用Primer 3(2.3.5 版,默认参数)进行SSR 引物设计。
基于转录组数据开发的一批SSR 引物中,选择重复单元碱基数2~3 bp,重复单元7~10 次的96对SSR 引物进行筛选实验。所选择的引物长度在20~25 bp,理论退火温度52~56 ℃,PCR 产物长度处于150~350 bp。
2.4 SSR 引物的PCR 扩增
PCR 扩增为2 轮扩增。第1 轮(获取相应片段)PCR 扩增反应体系:双蒸水(ddH2O)5.9 μL,10×Taq Buffer 1 μL,2 mmol/L dNTP 1 μL,5 μmol/L 正向SSR 引物0.5 μL,5 μmol/L 反向SSR 引物0.5 μL,TaqDNA 聚合酶0.1 μL,50 ng/µL 的DNA 模板 1 μL。反应程序:94 ℃预变性4 min;20 个循环的3 步PCR(94 ℃变性0.5 min,退火时间0.5 min,退火温度为52 ℃,72 ℃延伸1 min);72 ℃延伸10 min,10 ℃保存。第2 轮(添加荧光标记)PCR 扩增反应体系:ddH2O 5.9 μL,10×Taq Buffer 1 μL,2 mmol/L dNTP 1 μL,5 μmol/L 带荧光的M13 正向接头引物0.5 μL,5 μmol/L 反向SSR 引物0.5 μL,TaqDNA 聚合酶0.1 μL,50 ng/µL的第1 轮模板1 μL。反应程序:94 ℃预变性4 min;30 个循环的3 步PCR(94 ℃变性0.5 min,退火时间0.5 min,退火温度为50 ℃,72 ℃延伸1 min);72 ℃延伸10 min,10 ℃保存。
2.5 毛细管电泳检测
将PCR 产物根据不同荧光标记进行混板,在生工生物工程(上海)股份有限公司通过3730XL 测序仪检测对PCR 产物进行毛细管荧光电泳检测。通过毛细管荧光电泳检测,最终选定多态性好,扩增成功率高的SSR 引物用于后续数据分析。
2.6 数据分析
将下机的原始数据“.fsa”文件导入到分析软件GeneMarker 4.0 中进行峰图判读,具有多态峰图的则表示该引物具有多态性,记录等位基因大小,得到等位基因矩阵。根据判读所得等位基因位点矩阵,通过GenALEx 来计算每个个体间的遗传距离和每对引物的等位基因数(number of alleles,Na)、有效等位基因数(effective number of allele,Ne)、期望杂合度(expected heterozygosity,He)、观测杂合度(observed heterozygosity,Ho)、Shannon’s 指数(Shannon’s information index,I)等遗传多样性数据。利用PIC-CALC 0.6 软件计算SSR 位点的多态性信息数据(polymorphism information content,PIC)。基于GenALEx 计算所得的个体遗传距离矩阵,通过MEGA 进行UPGMA 聚类分析,构建聚类树。
3 结果与分析
3.1 转录组SSR 位点数量与分布
利用Trinity 拼接从GA3处理下的南方红豆杉转录组中共获得202 361 条Unigene,通过鉴定,共获得了12 008 个SSR 位点,出现频率(SSR 数与总Unigene 数之比)为5.93%,这些SSR 分布在10 894 条Unigene 中,发生频率(含SSR 的Unigene 数与总Unigene 数之比)为5.38%,SSR平均分布距离为1/7.64 kb。含有1 个以上SSR 位点的Unigene 有975 条,包含复合形SSR 的Unigene 有489 条。
南方红豆杉SSR 类型丰富,单核苷酸至六核苷酸重复类型均存在。12 008 个SSR 位点包括6 213个单核苷酸(51.74%)、2 507 个二核苷酸(20.88%)、2 992 个三核苷酸(24.92%)、226 个四核苷酸(1.88%)、27 个五核苷酸(0.22%)、43 个六核苷酸(0.36%)。其中单核苷酸最丰富,其次是三核苷酸和二核苷酸类型,五核苷酸类型最少。所有SSR 中以10 次重复的SSR 最多,占24.48%,5 次重复占16.73%,6 次重复占15.30%。南方红豆杉转录组SSR,基序的重复次数在5~72,以5~10 次重复的SSR 最多,共8 413 个,占总SSR 的70.06%;其次是10~14 次重复,共2 566 个,占总SSR 的21.37%;14 次以上的重复较少,共1 029 个,占总SSR 的8.57%(表2)。
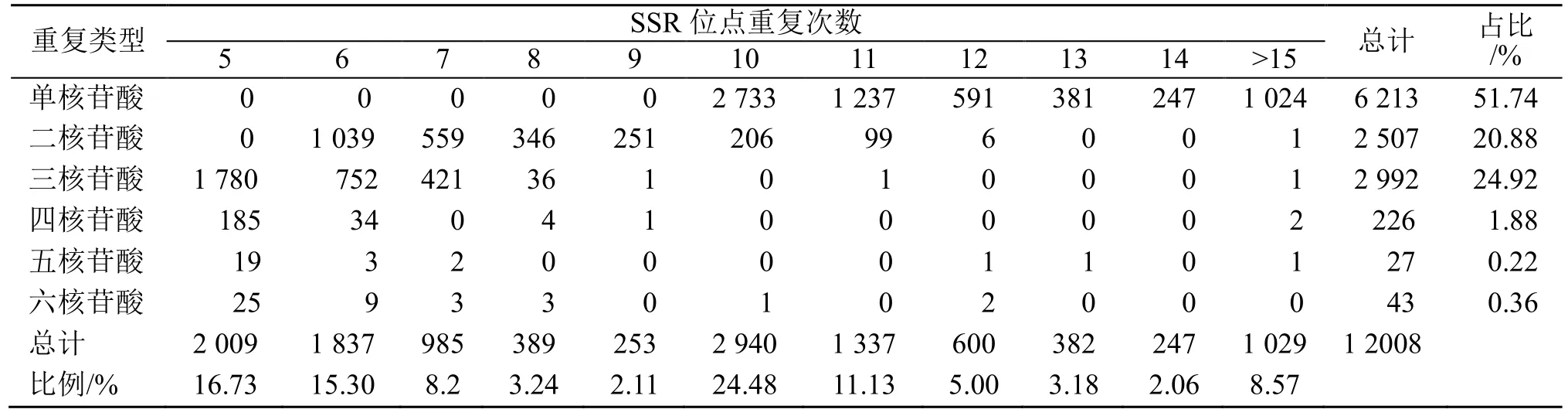
表2 南方红豆杉SSR 不同基序长度和重复次数的分布Table 2 Distribution of SSR with different motif types and repeat numbers in T. chinensis var. mairei
3.2 转录组SSR 基序重复类型和频率特征
研究发现,在12 008 个SSR 位点中包含114种重复基元,其中单、二、三、四、五、六核苷酸重复分别有2、4、10、29、26、43 种。从出现频率来看(表3),频率较高的重复基元分别为A/T,占总位点数的49.60%。单核苷酸重复类型中,A/T出现频率明显高于C/G,分别占总位点数的49.60%和2.14%;二核苷酸重复类型中,AG/CT 最多,约占总位点数的10.93%,其次是AT/AT 和AC/GT,分别占总位点数的5.14%、4.65%,CG/CG 最少,约占总位点数的0.17%;三核苷酸重复类型中,AAG/CTT 最多,约占总位点数的5.49%,ACT/AGT最少,约占总位点数的0.44%;四核苷酸重复类型中,AAAG/CTTT 最多,约占总位点数的0.23%,AACG/CGTT 、 AACT/AGTT 、 ACCT/AGGT 、ATCG/ATCG 最少,占总位点数不足0.001%;五、六核苷酸约占总位点数0.58%。
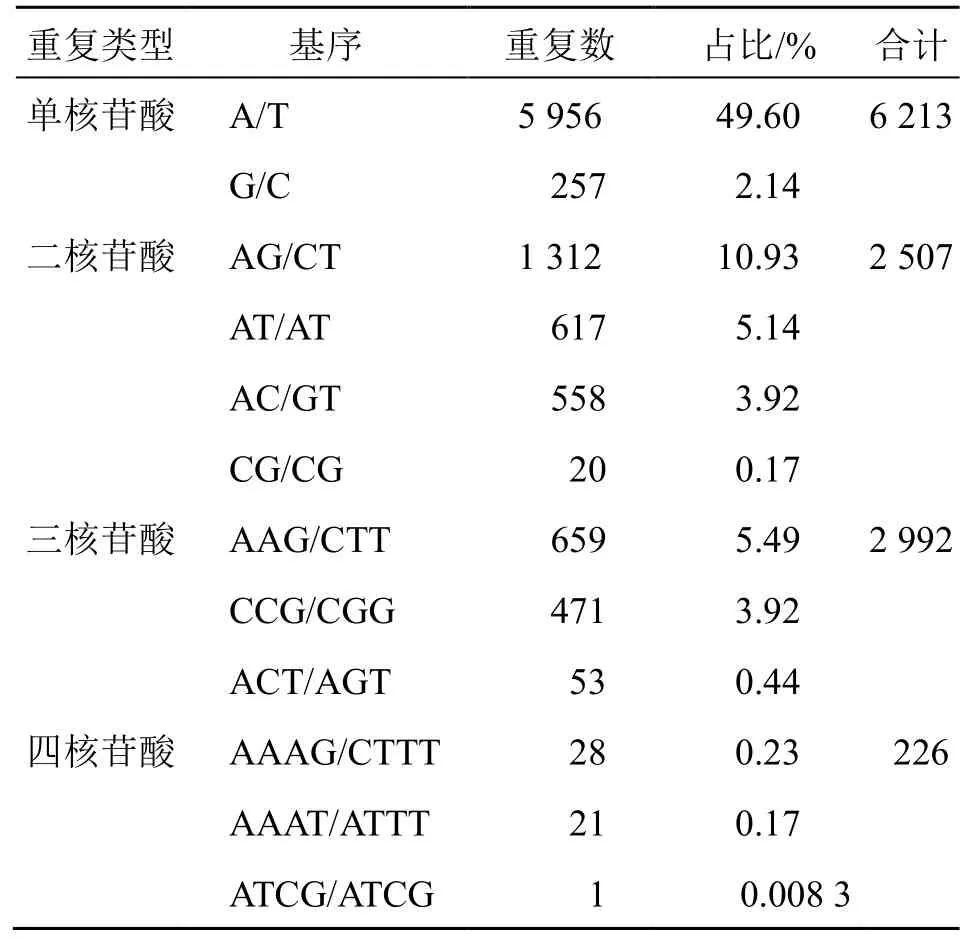
表3 南方红豆杉SSR 类型分布Table 3 Distribution of SSR repeat types in T. chinensis var. mairei
3.3 SSR 引物有效性验证
选择重复单元碱基数2~3 bp,重复单元7~10 次的96 对SSR 引物进行筛选实验。结果显示,以我国多个地区的南方红豆杉DNA 为模板进行SSR-PCR,13 对(表4)引物具有多态性,多态性引物比率为13.54%。引物多态峰图举例见图1。
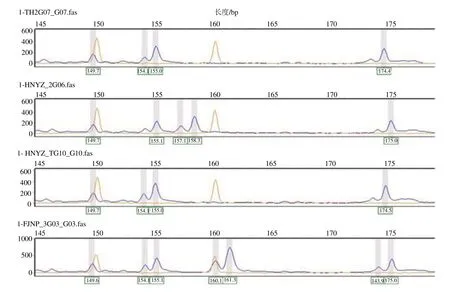
图1 HDS10 标记在太行山、湖南和福建地区红豆杉样本中的基因分型Fig.1 Genotyping by HDS10 maker for T. chinensis var. mairei from Taihang mountain, Hunan, and Fujian Provinces
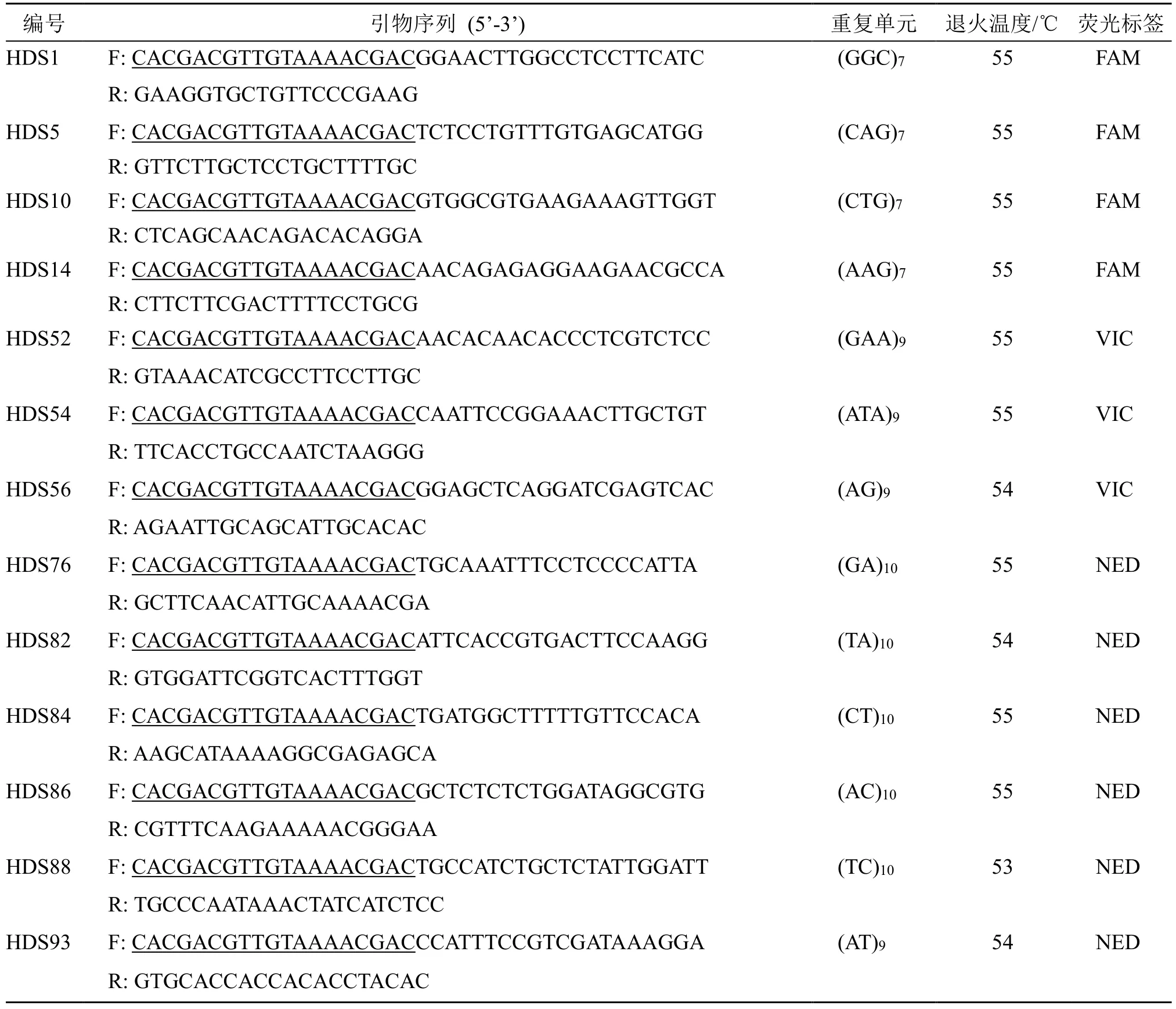
表4 SSR 引物信息Table 4 Information of primers
13 个SSR 位点的多态性信息见表5。12 个样本的Na为2~10,13 个SSR 位点上总的Na为55,平均值为4.23。Ne为1.53~5.43,平均值为2.76。I为0.53~1.85,平均值为1.10。Ho为0.14~0.82,平均值为0.39。He为0.35~0.82,平均值为0.58 个。PIC 为0.29~0.79,HDS5、HDS14、HDS52、HDS54和HDS93 为中多态性位点(0.25<PIC<0.5),HDS1、HDS10、HDS56、HDS76、HDS82、HDS84、HDS86 和HDS88 则为高多态性位点(PIC>0.5)。其中,HDS 84 的多态性最高,其PIC 值为0.79。
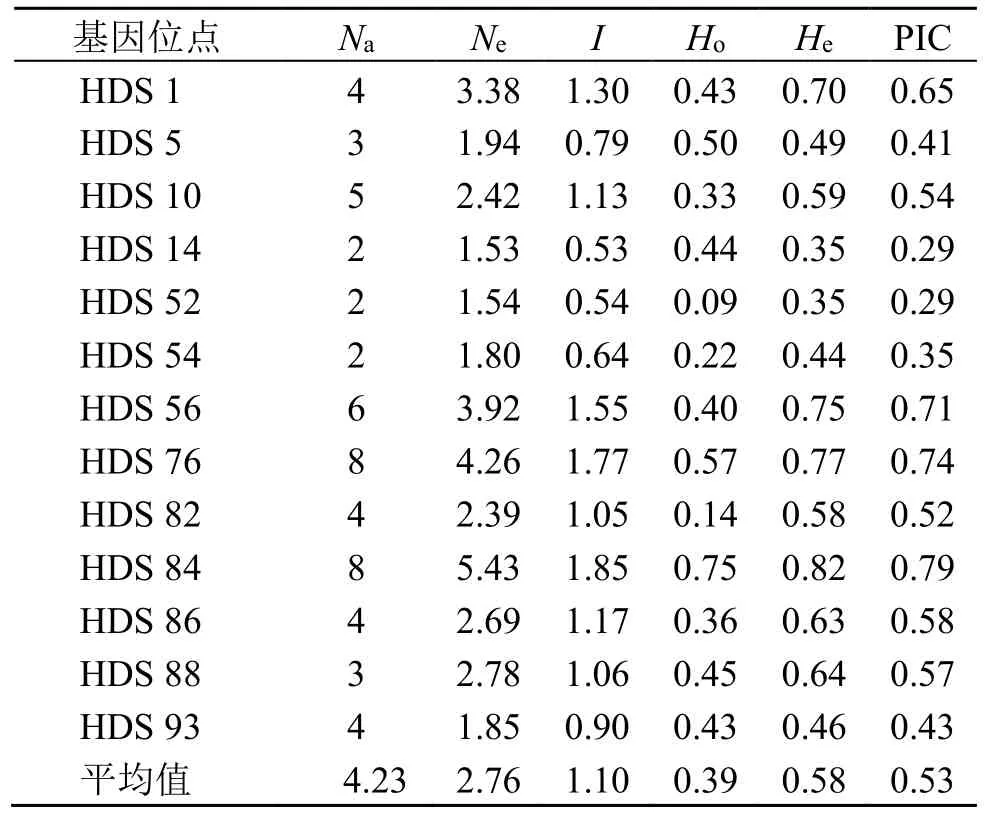
表5 SSR 引物位点多样性Table 5 SSR loci diversity of 13 SSR primers
3.4 SSR 位点种间扩增
将上述13 对具有多态性的SSR 引物在东北红豆杉和曼地亚红豆杉DNA 样品中进行扩增,结果发现有13 对引物在东北红豆杉DNA 样品中有扩增,而在曼地亚红豆杉DNA 样品中仅有3 对引物有扩增(表6)。两者相比较,13 对引物在东北红豆杉DNA 样品中的有效扩增率(100%),明显高于在曼地亚红豆杉DNA 样品中的有效扩增率(23.08%)。
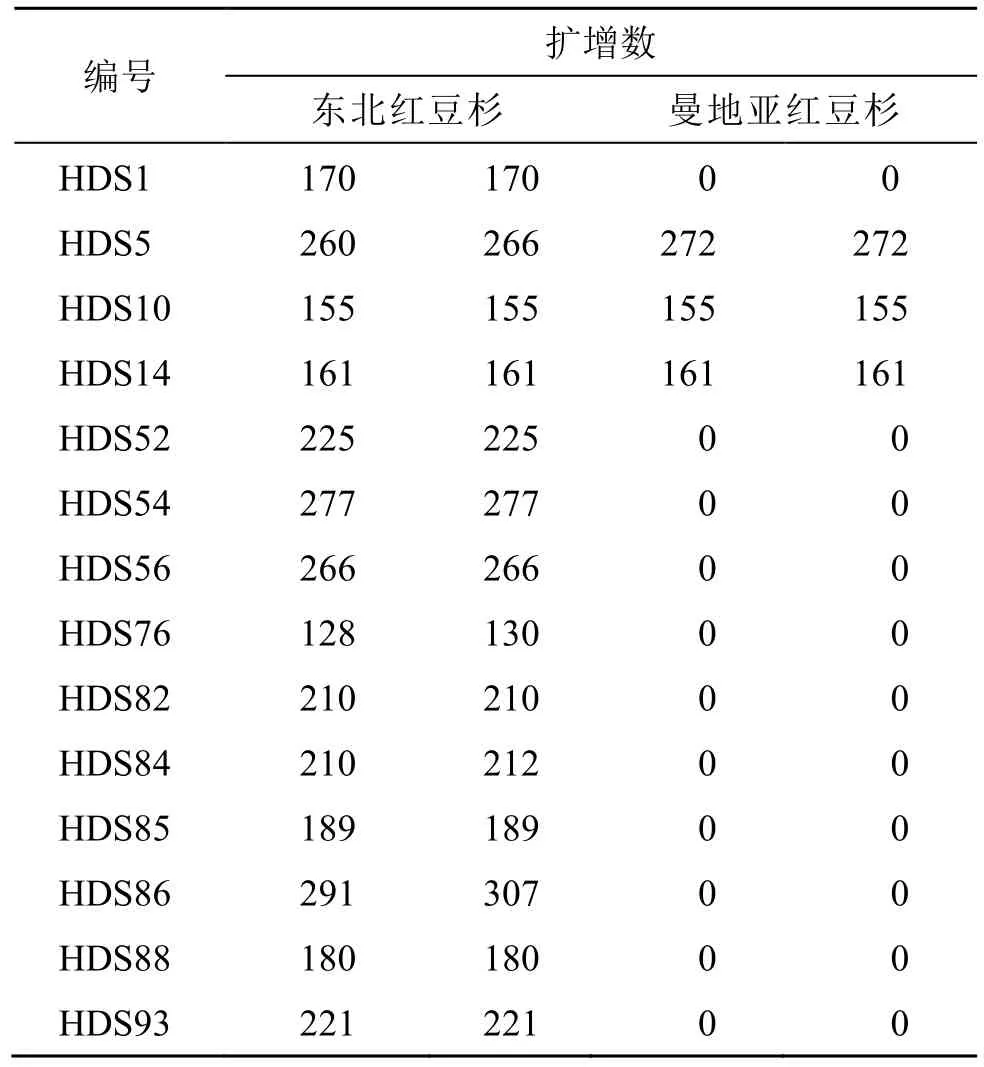
表6 种间扩增结果统计Table 6 Statistics of interspecific amplification results
3.5 聚类分析
UPGMA 聚类分析表明,来自浙江、福建和湖南纬度较低地区的南方红豆杉聚类在一起,而来自太行山地区的4 份样品聚为一类(图2)。可以看出,浙江、福建和湖南地区的南方红豆杉亲缘关系更近,而太行山地区的南方红豆杉与上述纬度更低南方来源的南方红豆杉亲缘关系较远。此外,在3 种纬度较低的南方地区的南方红豆杉中,也可以看出,浙江地区和湖南地区的距离相较福建地区更近。
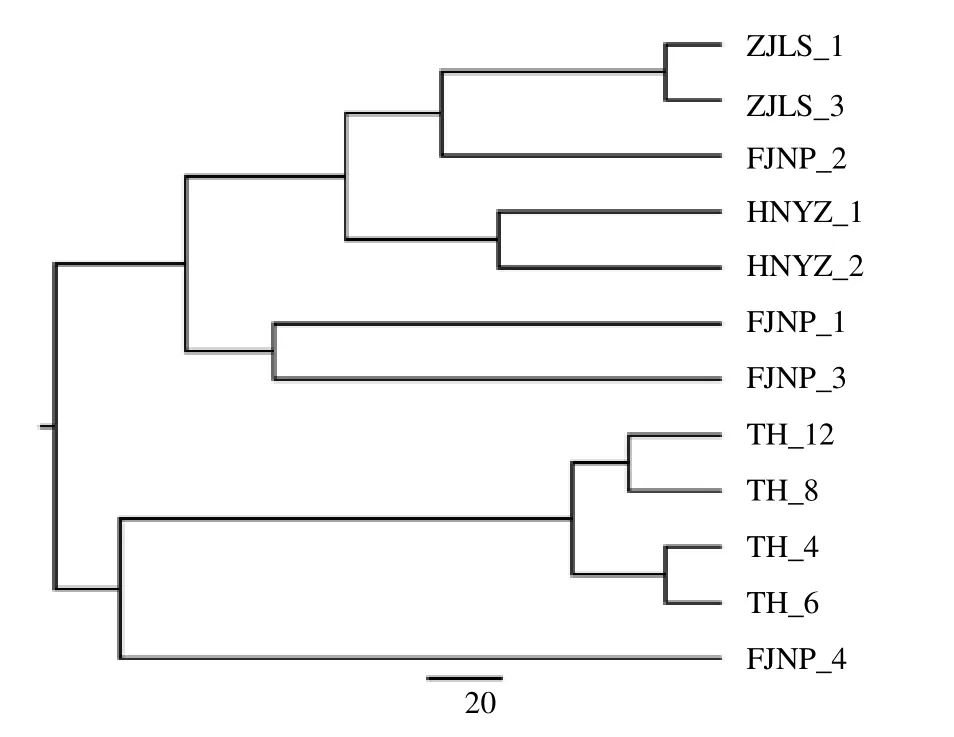
图2 12 份南方红豆杉聚类分析Fig.2 Cluster analysis of 12 samples of T. chinensis var.mairei
4 讨论
随着科技的飞速发展,高通量测序技术的出现以及更新迭代,使得利用基因组和转录组数据鉴定获取SSR 标记更加方便,数量更加丰富,更加有助于进行植物种质资源鉴定及遗传多样性评价等方面研究。目前,已经有多种植物基于基因组和转录组数据挖掘鉴定出SSR 标记[7,17-19]。相较于基因组SSR,转录组EST-SSR 标记能更准确地鉴别植物基因型,在种间通用性更好,能准确评估种间亲缘关系[20-23]。在南方红豆杉中,也有研究人员通过转录组数据开发鉴定出了多个SSR 标记,并用于连锁图谱构建等研究[4,7]。但是,已开发的SSR 标记还不能满足连锁图谱构建和遗传分析的需要,红豆杉SSR分子标记相关研究仍需要进一步加强。
本研究利用GA3处理的南方红豆杉叶片转录组数据搜索到二核苷酸至六核苷酸重复类型的SSR位点有6 213 个,高于李炎林等[10]利用公共数据库中南方红豆杉根、茎、叶转录组数据搜索到的SSR位点数(2 160 个)。差异可能是与转录组数据来源、MISA 软件检索设置参数等不同导致,也有可能与GA3处理有关。研究表明,二、三核苷酸重复类型为植物的SSR 位点的主要类型[24-26]。易官美等[9]研究报道在南方红豆杉中主要以二核苷酸重复类型为主,而李炎林等[10]报道则是以三核苷酸重复类型为主。此外,在武星彤[5]的研究中,南方红豆杉SSR重复基序是以六核苷酸重复为主,其次为三核苷酸。本研究南方红豆杉转录组数据分析结果显示,三核苷酸重复基序比二核苷酸重复基序更丰富,与李炎林等[10]结果更为相似。分析原因,可能与南方红豆杉的产地不同以及转录组数据和软件设置参数等有关。从优势重复基序来看,单核苷酸至五核苷酸分别为A/T、AG/CT、AAG/CTT、AAAG/CTTT、ATCCG/ATCGG。二、三核苷酸的优势重复基序与前人结果较为一致[5,9-10]。
遗传多样性能够体现生物遗传信息变异的程度,群体遗传多样性主要由等位基因数、杂合度和多态信息含量等3 个方面体现[27]。本研究中13 对SSR 引物共有55 个位点具有多态,在12 个样品中的Ho平均值低于He,与武星彤的结果相似,而PIC平均值为0.53,则高于武星彤[5]报道的7 个省份的南方红豆杉PIC 数值0.453,表明本研究所检测的4个南方红豆杉群体的遗传多样性要高于武星彤所采用的南方红豆杉群体。究其原因,推测是由于本研究中所检测的太行山南方红豆杉属于目前发现的最北端的南方红豆杉,其与福建、浙江、广西等南方地区的生长的南方红豆杉生长环境且表型特征都具有较大不同。此外,研究中所涉及的SSR 位点不同也有可能会造成结果的差异。尽管本研究和武星彤[5]研究中采用的群体以及样品数量不多,但是两者结果高度相似,也能充分表明当前人为因素对南方红豆杉的遗传多样性产生不可忽略的影响。
种间扩增法被认为能有效开发近源物种新SSR位点。武星彤开发的107 个SSR 位点在5 种红豆杉种间平均扩增率为96.07%[5]。本研究中获得的13 对引物在东北红豆杉DNA 样品中扩增率达100%,但在曼地亚红豆杉DNA 样品中扩增率仅达23.08%。标记通用性的高低一定程度上反映物种基因组差异的大小和亲缘关系的远近[28-29]。本研究的结果说明相较于曼地亚红豆杉,南方红豆杉与东北红豆杉亲缘关系更近,基因组差异更小。分析原因可能有2个:一是因为曼地亚红豆杉是欧洲红豆杉T.baccata和东北红豆杉的天然杂交种[30],遗传背景复杂;二是因为曼地亚红豆杉不是我国本土树种,是从外国引种而来,与南方红豆杉的亲缘关系、自然分布距离远。因此,本研究开发的SSR 引物可用于红豆杉种间亲缘关系鉴定、系统发育等研究。
研究中所获得13 对SSR 多态性引物,将12 个不同地区的南方红豆杉进行了很好的聚类,聚类结果与其实际来源地较为一致。来自太行山的4 个样品明显聚为一类,与其他南方地区的红豆杉可以得以显著区分。可见,本研究所开发的SSR 引物能够用于后续南方红豆杉遗传多样性分析及遗传结构分析等研究。
综上所述,本研究结果表明通过南方红豆杉转录组数据开发SSR 标记切实可行,鉴定筛选出的13对SSR 引物为南方红豆杉的遗传多样性分析提供了候选标记。随着红豆杉基因组的发表[31-32]以及更多转录组数据的公布,将会有更多的与功能基因相关的SSR 位点被开发,例如与紫杉醇生物合成相关的SSR 位点,希望今后研究人员可以基于此,在今后的研究中充分利用SSR 分子标记技术,并对红豆杉的群体遗传、遗传图谱构建和谱系地理等诸多方面进行更加深入的研究,这些都将为未来的红豆杉分子育种提供帮助。
利益冲突所有作者均声明不存在利益冲突

