不同干燥方式对姜黄中姜黄素和姜黄油的影响
吴双,袁茂廷,夏修新,刘国豪,倪穗
(宁波大学 海洋学院,浙江 宁波 315211)
姜黄(CurcumalongaL.)为姜科姜黄属多年生草本植物,原产于印度,在我国主要栽培于广西、云南、福建、四川等省份。姜黄属于药食同源植物,通常取其干燥根茎入药,具有多种药理作用,如抗炎、抗菌、抗肿瘤等[1]。研究证明,姜黄含有100多种活性化合物,主要生物有效成分为姜黄素类及挥发油类[2]。
姜黄素类化合物(curcuminoids)即总姜黄素,是一种二酮类化合物,主要包括姜黄素(CUR)、去甲氧基姜黄素(DMC)和双去甲氧基姜黄素(BDMC)。姜黄素类化合物在抗氧化、抗凝、降血脂、降血糖等方面作用显著,并对如心血管、肺、神经等慢性疾病具有活性,摄入姜黄素也会降低结肠癌、肺癌、乳腺癌等癌症的发病率,并对人类产生其他有益的生物学效应。姜黄挥发油主要成分为各种挥发性倍半萜类、单萜类和其他芳香化合物[3],具有抗风湿、抗增殖、抗糖尿病、抗肝毒性、抗血栓、抗酪蛋白酶等多种药理学特性。医学研究显示,姜黄油还能增强免疫功能、促进血液循环、加速排毒和刺激消化[4]。
姜黄根茎的含水量约为70%~80%,不适合长期储存,因此,要通过不同的干燥工艺降低水分以延长保质期,但目前国内外对姜黄的研究主要集中在姜黄素和姜黄油的药理作用方面,对其干燥工艺缺少系统研究。姜黄素和姜黄油作为光热敏感化合物,不同干燥温度和时间对其成分和含量都有直接影响,因此,本文以新鲜的姜黄根茎为材料,探究5种干燥方式,即晒干、室温23 ℃自然阴干、30 ℃热风烘干、60 ℃热风烘干和真空冷冻干燥对姜黄素和姜黄油的含量及组分的影响,以期为姜黄的开发利用和产品加工提供一定的技术支持。
1 材料与方法
1.1 材料与试剂
姜黄根茎:购于云南省红河哈尼族彝族自治州。纯水:实验室自制;分析纯:甲酸水;色谱纯:乙腈;标准品:购于上海源叶生物科技有限公司。姜黄素CAS号458-37-7,纯度≥98%;去甲氧基姜黄素CAS号22608-11-3,纯度≥98%;双去甲氧基姜黄素CAS号33171-05-0,纯度≥98%。
1.2 仪器与设备
电子天平:XSR105,宁波鸿蒙检测有限公司;气相色谱—质谱联用仪:Agilent 8890 GC,美国安捷伦公司;挥发油提取装置:江苏三爱思科学仪器有限公司;电子调温电热套:PTHW 1 000 mL,江苏三爱思科学仪器有限公司;高速多功能粉碎机:800Y,永康市铂欧五金制品有限公司;电热风干燥器:DHG型,上海成顺仪器有限公司;高效液相色谱仪:ACQUITY UPLC H-Class型,美国沃特世公司;超声波清洗机:SB-5200DT,宁波新芝生物科技有限公司;高速离心机:TG-16台式高速离心机,海昌仪器(苏州)有限公司;色度仪:CM-5 型分光测色仪日本柯尼卡美能达公司。
1.3 干燥方法及姜黄粉末的制备
选取姜黄根茎,洗净去除须根,纵切2 mm片,分别采取晒干、室温23 ℃自然阴干、30 ℃热风烘干、60 ℃热风烘干和真空冷冻干燥至恒重。再使用高速粉碎机分别进行破碎,得到姜黄粉末备用。
1.4 姜黄素类化合物的提取与测定方法
1.4.1 色谱条件
根据参考文献[5]进行改良。
液相色谱柱为CNW Athena C18 WP,4.6 mm×250 mm,5 μm;流动相为0.1%甲酸水∶0.1%甲酸乙腈=45∶55;洗脱方式为等度洗脱,18 min;柱温为室温;进样量为15 μL;流速为1.00 mL·min-1;检测波长为420 mm;采用外标法定量。
1.4.2 供试品溶液的制备
将样品混均匀后,精密称取样品0.500 0 g于25 mL旋盖离心管,定量加入25 mL甲醇溶液,超声提取1 h后,以10 000 r·min-1离心10 min,过0.22 μm滤膜后,吸取上清液进样分析。
1.4.3 标准溶液的制备
分别精密称取姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素标准品各0.1 g一起放置于10 mL容量瓶中,用甲醇定容至刻度,得到标准品浓度为200 μg·mL-1的标准液。进行等梯度稀释,配制成1、2、5、10、20、50、100 μg·mL-1的混合标准液。密封4 ℃保存。混合标准工作液临用现配。
1.4.4 姜黄素类化合物得率的计算
X=CVN/m。
式中,X为姜黄中BDMC、DMC、CUR得率,%;C为测定液中BDMC、DMC、CUR的质量浓度,g·mL-1;V为提取液体积,mL;N为稀释倍数;m为姜黄质量,g。
1.5 姜黄挥发油的提取与组分测定方法
1.5.1 姜黄挥发油的提取方法及得油率计算
姜黄挥发油的提取方法参照《中华人民共和国药典》2020年版四部通则2204中的“挥发油测定法”并进行改良如下[6]:取不同干燥方式下的姜黄粉末10 g,加入500 mL水,水蒸气蒸馏法提取5 h,收集所得挥发油,加无水Na2SO4干燥,4 ℃避光储存。
X=100%V/m。
式中,X为姜黄中姜黄挥发油得率,%;V为提取出挥发油的体积,mL;m为姜黄质量,g。
1.5.2 GC-MS条件
气相色谱条件:HP-5MS石英毛细管色谱柱(0.25 mm×30 m,0.25 μm);升温程序:50 ℃保持2 min,3 ℃·min-1速率升至80 ℃,保持2 min,5 ℃·min-1速率升至180 ℃,保持1 min,10 ℃·min-1速率升至230 ℃,保持5 min,最后20 ℃·min-1速率升至250 ℃,保持4 min;体积流量1.500 mL·min-1;载气氦气;进样量1 μL;进样口温度220.3 ℃;分流比1∶10。
质谱条件:离子源EI,温度230 ℃;电离能量70 eV;四极杆温度150 ℃;溶剂延迟时间7 min;质量扫描范围m/z为45~800。
定性和定量分析:对总离子流图中的各色谱峰相对应的质谱图进行NIST谱库检索和人工解析,并结合文献[7-8] 进行鉴定,采用峰面积归一化法计算检出成分的相对含量。
1.6 不同干燥方式下姜黄的色度测定
将色度仪调试到反射测量,测定光源D65,照明系统排除镜面反射,测定试场10°视角,测试区域30 mm,起止波长360~740 nm。对仪器进行白板与黑板校正后[9],称取姜黄粉末2 g均匀平铺在测色皿底部,进行样品测定,每组样品重复测定3次,取平均值。
2 结果与分析
2.1 干燥方式对姜黄素类化合物相对含量的影响
2.1.1 标准曲线的绘制
BDMC、DMC和CUR标准品的色谱图如图1所示,BDMC的保留时间为9.263 min,DMC的保留时间为10.027 min,CUR的保留时间为10.882 min,3种化合物能够实现基线分离。以峰面积为纵坐标(y),对应的质量浓度为横坐标(x)绘制标准曲线,分别得到BDMC、DMC和CUR的标准曲线方程,见表1。BDMC、DMC和CUR标准品在1~100 μg·mL-1范围内与峰面积呈良好的线性关系。

表1 BDMC、DMC和CUR标准曲线方程Table 1 BDMC,DMC,and CUR standard curve equations

图1 BDMC、DMC和CUR标准品的色谱图Fig.1 Chromatogram of BDMC,DMC,and CUR standards
2.1.2 不同干燥方式下姜黄素类化合物得率
如图2所示,姜黄素类化合物中CUR占比最高,最高为1.11%;其次为DMC,最高为0.36%;BDMC占比最少,最高为0.33%。在5种干燥方式中,BDMC和DMC得率最高的是自然阴干,为0.33%、0.36%;其次是30 ℃热风烘干,为0.32%、0.35%;再次为冷冻干燥,为0.29%、0.30%;最后是60 ℃热风烘干和晒干;CUR得率最高的是自然阴干,为1.11%;其次是30 ℃热风烘干,为1.10%;再次是60 ℃热风烘干,为0.96%;晒干和冷冻干燥最低;同时总姜黄素得率最高的也是自然阴干方式,为1.84%。可见,姜黄素类化合物具有很强的光不稳定性,并且高温条件下易分解。自然阴干是在室温23 ℃避光条件下进行,能有效减少光照和保持低温,从而减少了姜黄素类化合物结构的改变,降低了活性物质的分解,保存了大部分的姜黄素类化合物。
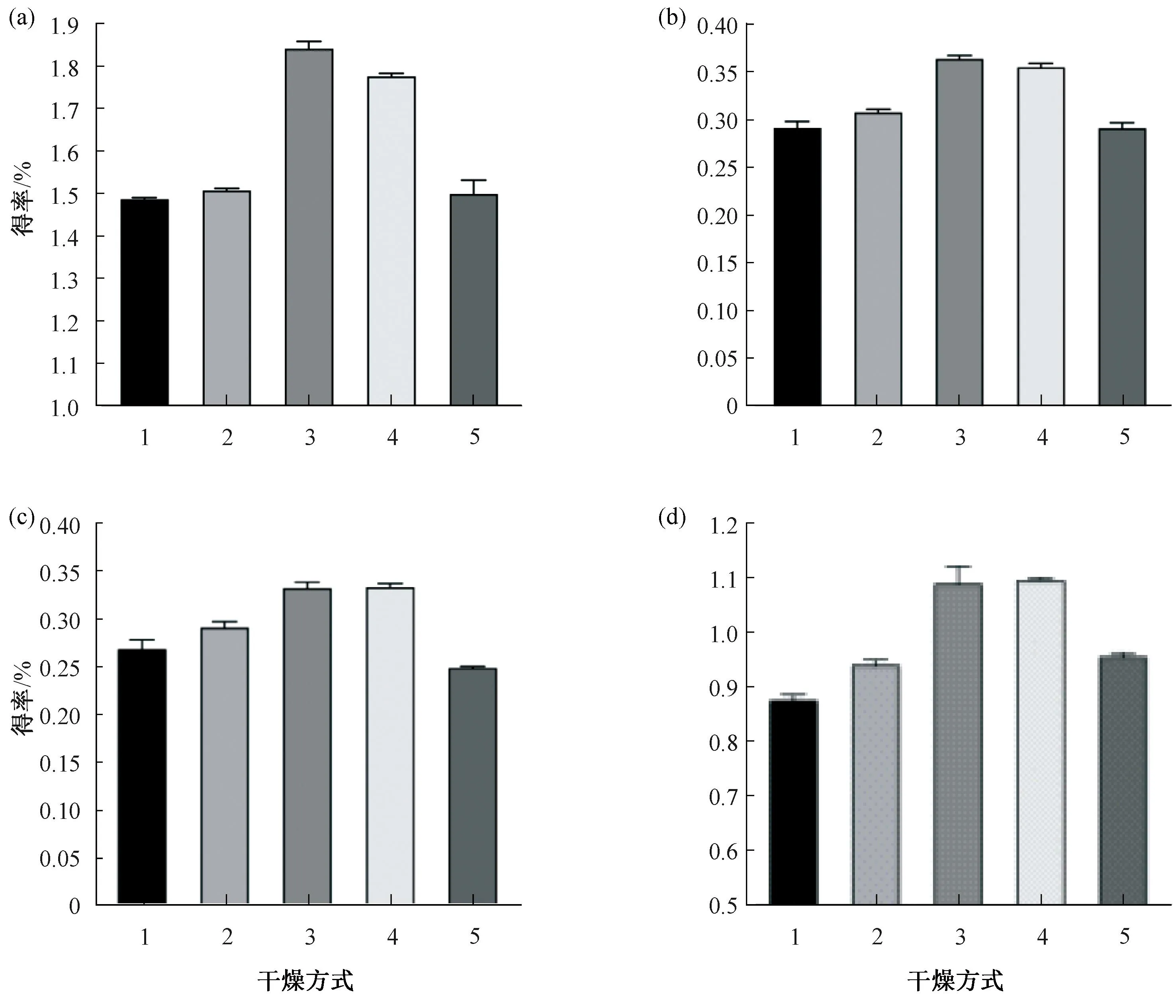
(a)表示CUR;(b)表示DMC;(c)表示BDMC;(d)表示总姜黄素;1表示晒干;2冷冻干燥;3表示自然阴干;4表示30℃热风烘干;5表示60℃热风烘干。图2 不同干燥方式下姜黄素类化合物的得率Fig.2 Yield of curcumin compounds under different drying methods
2.2 干燥方式对姜黄挥发油得率及其组成成分的影响
2.2.1 不同干燥方式下姜黄挥发油的得率
分别对5种干燥方式下的姜黄进行水蒸馏提取5 h,再进行姜黄挥发油含量测定。
从图3可见,5种干燥方式中自然阴干的姜黄根茎挥发油得率最高,为6.15%;其次是30 ℃热风烘干,为5.85%;再次是60 ℃热风烘干,为5.20%;得率最低的是晒干和冷冻干燥。推测可能是姜黄挥发油中的部分组分具有热敏感性,会随温度的升高发生分解,自然阴干相对温度较低,组分分解较少,因此得率最高。对于冷冻干燥提取率最低的原因也进行了查验,发现对冷冻干燥机中的冰块水蒸馏提取后的得油率约为2.00%,推测原因为鲜姜黄片在低温环境下被快速冻结,部分姜黄挥发油留在了冷冻干燥机中的冰块上,导致提取率降低。
2.2.2 不同干燥方式下姜黄挥发油的组成成分分析
从表2可知,5种干燥方式下所得姜黄挥发油的成分大致相同,但各组别间种类和相对含量有一定差别。
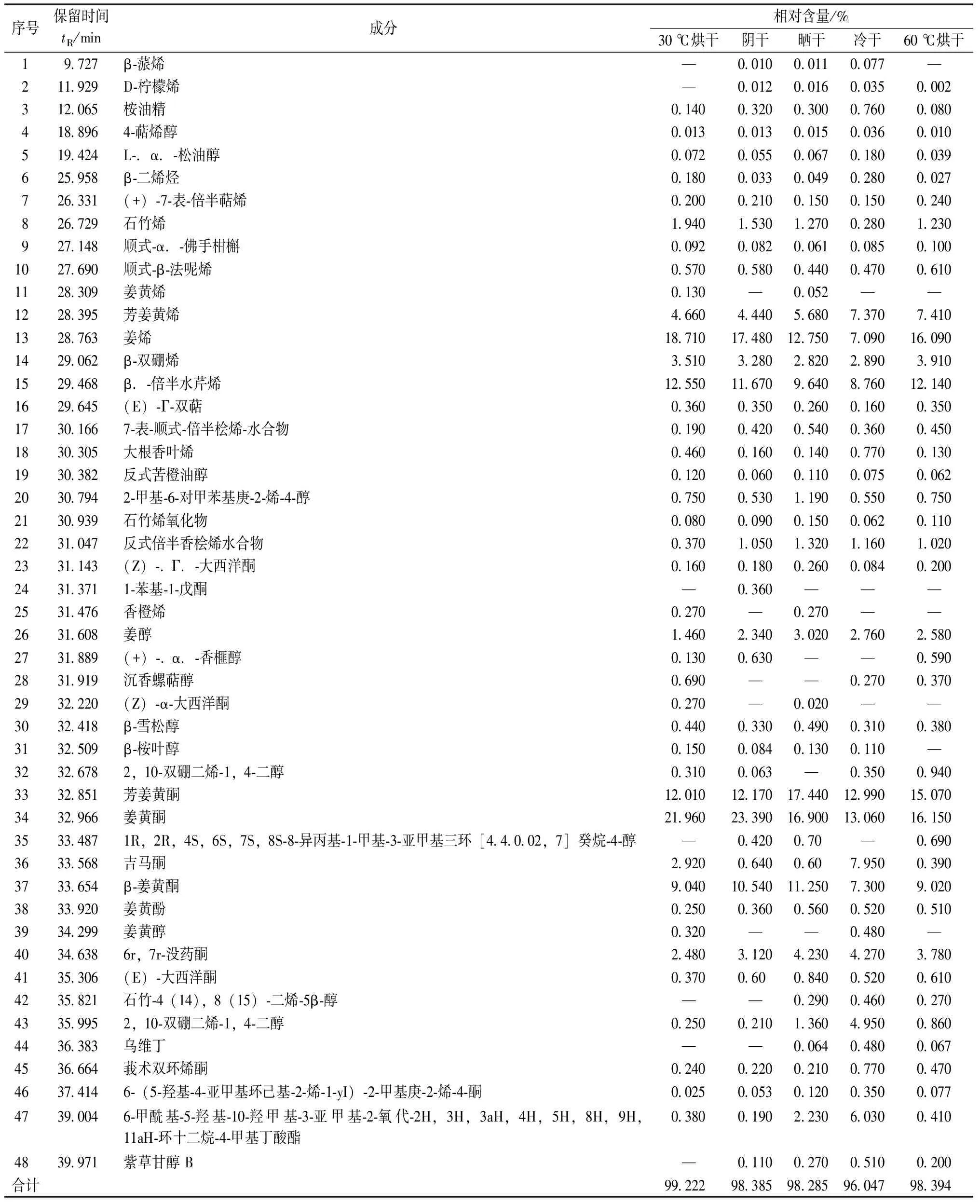
表2 不同干燥方式下姜黄挥发油组成及相对含量Table 2 Composition and relative content of volatile oil in turmeric under different drying methods
经自然阴干处理的姜黄其挥发油共鉴定出41种成分,其中相对含量在1%以上的成分有11种,占总体的92.51%;经30 ℃处理的姜黄其挥发油共鉴定出41种成分,其中相对含量在1%以上的成分有11种,占总体的91.96%;经60 ℃处理的姜黄其挥发油共鉴定出41种成分,其中相对含量在1%以上的成分有11种,占总体的89.84%;经晒干处理的姜黄其挥发油共鉴定出43种成分,其中相对含量在1%以上的成分有14种,占总体的92.69%。可见,自然阴干处理后所得的姜黄挥发油中主要成分的种类较多,占总体含量较高。
不同干燥方式对姜黄挥发油中活性成分的影响也各不相同,大部分成分随着温度的升高而减少,如姜黄酮、石竹烯、β-姜黄酮、姜烯、吉马酮等;也有部分成分随着干燥温度升高而有所增加,如芳姜黄烯、姜醇、芳姜黄酮、姜黄酚等;对于β-双硼烯、芳姜黄烯、姜烯,60 ℃热风干燥能够获得较高的相对含量。5种干燥方式所得姜黄挥发油组分中相对含量最多的皆为姜黄酮,其次为姜烯和芳姜黄酮,除芳姜黄酮随干燥温度的升高呈先升后降的趋势外,姜黄酮和姜烯都为先降后升。推测原因为在不同温度下热敏性成分姜黄酮和姜烯产生分解,转化为芳姜黄酮[10]。此外,在不同干燥方式下,姜黄挥发油中一些组分的相对含量也会出现下降甚至消失,或者产生一些特异性成分。根据以上现象推测原因为姜黄挥发油中存在光热敏感组分,不同的干燥方式会使其发生复杂异构化反应,导致含量变化。Singh等[11]的研究表明,高温会促进不稳定的α-姜黄酮和β-姜黄酮降解转化为ar-姜黄酮,这与实验结果中β-姜黄酮的含量变化规律相符,但并未测出ar-姜黄酮,推测β-姜黄酮降解为其他物质。Faiola等[10]研究发现,在较高温度下热敏性成分姜黄酮和姜烯产生分解,转化为芳姜黄酮,这与本研究结果相符合,由此推测较高温度下某些成分的增加也与类似的过程相关。
2.3 干燥方式对姜黄色泽的影响
2.3.1 不同的干燥方式下姜黄的色泽测定
L*代表明亮度,L*越大,明亮度越大,反之越小;a*代表红绿色度,a*>0为红色方向,反之为绿色方向;b*代表黄蓝色度,b*>0为黄色方向,反之为蓝色方向[12]。
由表3可知,不同干燥方式下的姜黄粉末色度值存在明显差异。在一定程度上,干燥温度越低,姜黄粉末亮度L*越高,其中冷冻干燥所得姜黄粉末亮度L*最高,推测原因可能为冷冻干燥是在低温真空环境下进行的,不会产生美拉德反应和降解;60 ℃处理的姜黄粉末亮度L*最低,推测原因为温度相对较高,美拉德反应比较强烈。但总姜黄素含量和亮度L*不存在线性关系,而是先增后降,这表明亮度L*和总姜黄素含量的关系不大。

表3 姜黄粉末色度值及总姜黄素含量(n=3)Table 3 Color value and total curcumin content of turmeric powder (n=3)
2.3.2 姜黄色泽与姜黄素含量的相关性分析
以L*、a*、b*值依次为自变量,总姜黄素含量为因变量,用SPSS25.0对不同干燥方式下的姜黄粉末色度值与总姜黄素含量之间进行Pearson相关性分析。如表4所示,总姜黄素含量与姜黄粉末L*、a*、b*之间都无相关性(P>0.05)。由此可见,总姜黄素含量与姜黄粉末色度值关系不大。

表4 姜黄色度值与总姜黄素含量相关性分析(n=34)Table 4 Correlation analysis between turmeric value and total curcumin content (n=34)
3 讨论
通过高效液相色谱(HPLC)对不同干燥方式下姜黄根茎中姜黄素类化合物检测发现,自然阴干时BDMC、DMC、CUR得率最高,其中CUR含量最高,BDMC和DMC相近,此时总姜黄素得率也最高,因此,采取自然阴干方式处理姜黄对姜黄素类化合物的保留最佳;通过GC-MS对不同干燥方式下姜黄根茎中姜黄挥发油成分检测发现,自然阴干时姜黄挥发油得率也是最高的,且与其他干燥方式所得姜黄油含量差异最显著;同时自然阴干处理后所得的姜黄挥发油组分也是最多的,相对含量在1%以上的成分占总体含量较高,且挥发油中主要药理成分姜黄酮、姜烯和芳姜黄酮含量占比也较高,因此,自然阴干处理方式所得姜黄挥发油的抗炎抑菌效果可能更佳;通过色度分析发现,不同干燥方式下姜黄粉末色度差异较大,但总姜黄素含量与姜黄粉末色度值关系不大。
可见,以姜黄素类化合物与姜黄挥发油的含量为主要指标,姜黄干燥处理以自然阴干的方式为最佳。研究结果为姜黄的开发利用提供一定的技术支持。

