红麻HcKAN4 基因克隆、表达及在类黄酮合成中的功能
吴法轩 李 秦 杨 昕 李新根 徐建堂 陶爱芬方平平 祁建民 张立武,*
1 福建农林大学作物遗传育种与综合利用教育部重点实验室 / 农业农村部闽台作物生物育种重点实验室 / 福建省作物设计育种重点实验室, 福建福州 350002; 2 福建农林大学农业农村部东南黄红麻实验观测站 / 福建省麻类种质资源共享平台 / 福建省南方经济作物遗传育种与多用途开发国际科技合作基地, 福建福州 350002
红麻(HibiscuscannabinusL.)为锦葵科木槿属的一年生常异花授粉纤维作物, 属于短日照喜温类型,主要种植在亚洲的中国、印度、孟加拉国、马来西亚以及非洲的马里、贝宁、赞比亚等国家[1]。红麻属于韧皮部纤维作物, 具有质地柔软、吸湿性强、透气性好、抑菌、易降解等优良特性。在建材、可降解塑料、吸污、饲料、汽车内衬和药用等领域都有广泛的应用[2-4]。
类黄酮化合物是植物中具有高度活性的次生代谢产物, 在植物抗氧化、抗病虫害等方面具有良好效果, 原花青素(proanthocyanidins, PAs)是在植物中广泛存在的一种类黄酮化合物, 能够决定植物器官颜色, 并在应对生物和非生物胁迫中发挥重要作用[5]。同时, 花青素可以有效清除自由基, 在抗氧化、抗衰老方面效果显著[6]。因此深入了解类黄酮在红麻中的合成及调控过程, 对于培育彩色纤维、增强抗逆性、提高纤维品质具有重要作用。
类黄酮生物合成途径已被广泛研究, 参与其生物合成的结构基因己相继被克隆和鉴定。类黄酮生物合成通路错综复杂, 其中先后涉及到十几个关键酶(PAL、C4H、4CL、CHS、CHI、F3H、F3’H、DFRLDOX、ANS、LAR、ANR、LAC 等)的催化反应[7]。此外, 类黄酮代谢的转录调控也被广泛研究, 涉及到多种转录因子(WIP-ZF、MYB、bHLH、WD40、WRKY、MADS)[7-8], 其中以MYB、bHLH 和WD40最为常见, 这 3 类转录因子可以以 MYB-bHLHWD40 (MBW)复合体的形式来调控植物PAs 的生物合成[9], 也可以单独发挥作用, 例如Ding 等[10]发现苹果的转录因子MdMYB28 可以负调控花青素的合成。MYB 转录因子决定MBW 复合体的特异性和被激活的基因, 是复合体的核心成员, 可通过过表达MYB就会明显促进PAs 的生物合成[11]。
在许多植物中, MYB 转录因子均已被报道参与类黄酮代谢的调控。例如, 在拟南芥(Arabidopsis thaliana)中, MYB 类转录因子TT2/AtMYB123通过调节ANR、DFR和AHA10的表达来特异调控种皮原花青素的积累[12]。在水稻(OryzasativaL.)中, MYB 转录因子OsPL 通过调控花青素代谢使种子耐热性增加[13]。在苜蓿(Medicagotruncatula)中,MtMYB5和MtMYB14通过与MtTT8和MtWD40-1相互作用形成复合体, 从而激活ANR和LAR的表达来协同调控种子外壳原花青素的积累[14]。MYB 转录因子不同成员除了正调控类黄酮的合成外, 也存在对其负调控。例如, 在苦荞(Fagopyrumtataricum)中, MYB 转录因子基因FtMYB11通过与FtSAD2或FtJAZ1的相互作用抑制苯丙烷的生物合成[15]从而抑制类黄酮的合成。拟南芥中AtKAN4基因过表达产生了一个显性突变系sk21-D, 突变体中的CHS、CHI、F3’H、DFR、LDOX、ANR等类黄酮合成相关基因的表达量均下降,表明AtKAN4基因可广泛调控拟南芥PAs 生物合成相关基因[16]。
病毒诱导的基因沉默(virus induced gene silencing, VIGS)是一种植物用来抵御入侵病毒的自然防御机制, 属于转录后基因沉默(post-transcriptional gene silencing, PTGS)[17]。利用VIGS 技术能够快速鉴定目标基因沉默后的表型和基因转录水平变化,不需要通过稳定遗传转化。因此它在功能基因组学研究中有显著的优势, 能快速地鉴定目的基因功能。VIGS 的沉默效率受多种因素的影响, 病毒载体的选择对沉默效率有着较大影响, 目前植物中应用范围较广的是烟草脆裂病毒(Tobacco rattle virus,TRV)。与其他病毒载体相比, TRV 具有沉默效率高和时间长等优点, TRV-VIGS 体系目前已在棉花[18]、亚麻[19]等多种寄主植物中应用[20]。
与黄麻等韧皮部纤维作物相比, 红麻纤维的纤维素含量较低而木质素含量较高。据报道[21], 有317个淀粉和糖代谢途径基因可能参与纤维素生物合成,包括CesA、Csls 基因家族。根据相关研究[22]表明,PAL、HCT、C4H、COMT、CAD、4CL 和F3’H 在木质素生物合成起关键作用。类黄酮代谢途径不仅可以独自影响纤维的发育, 还可能和木质素代谢途径或者与苯丙烷代谢途径的其他分支代谢途径共同地来调控纤维的发育[23]。植物MYB 转录因子调控类黄酮代谢和纤维发育的机制复杂多样[24], 而在红麻中鲜有报道。本研究以红麻优良品种‘福红952’为材料, 基于其全基因组测序数据[25], 克隆获得一个与拟南芥AtKAN4的同源基因HcKAN4, 通过Gateway 技术构建HcKAN4的VIGS 载体, 获得基因沉默植株; 结合实时荧光定量PCR, 分析其影响类黄酮合成途径相关基因的表达情况。这将丰富MYB转录因子KAN4 在红麻类黄酮合成途径中的研究,为红麻类黄酮合成及调控的分子机制研究和纤维品质改良提供理论依据。
1 材料与方法
1.1 试验材料
本研究以红麻‘福红952’为试验材料, 由福建农林大学麻类遗传育种与综合利用实验室保存提供。大肠杆菌菌株DB3.1、TOP10、农杆菌菌株GV3101、Gateway 入门载体 pDONR207、载体 pTRV1 和pTRV2 等均由福建农林大学麻类遗传育种与综合利用实验室保存。RNA 提取试剂盒和实时荧光定量PCR 试剂盒购自天根生化科技(北京)有限公司。
1.2 试验方法
1.2.1 RNA 提取和cDNA 合成 使用RNA 提取试剂盒提取‘福红952’红麻叶片的总RNA。用超微量分光光度计Nano Drop ND-1000 (Nano Drop, 美国)检测RNA 样品浓度, 并用1%琼脂糖凝胶电泳检测其完整性。用RNA 反转录试剂盒将提取的总RNA反转录为 cDNA, 反转录体系为(5× Fastking-RT SuperMix: 4 μL、Total RNA 50 ng: 2 μg、RNase-Free ddH2O 补足到20 μL), 反应程序为42℃反应15 min、95℃反应3 min, 以cDNA 为模板进行红麻HcKAN4基因的克隆及实时荧光定量PCR 分析。
1.2.2 红麻HcKAN4基因克隆 实验室前期基础发现HcKAN4基因对类黄酮合成有着调控作用。从已报道文献[16]和TAIR 数据库(https://www.arabidopsis.org/)获得拟南芥AtKAN4 (AT5G42630)蛋白序列。利用AtKAN4 氨基酸序列进行BLASTP 比对分析, 获得相似性较高的同源基因, 命名为HcKAN4(红麻基因组数据库编号:Hc.03G039160)。以红麻cDNA 为模板设计特异引物克隆HcKAN4基因(附表1)。PCR程序为: 95℃预变性2 min; 95℃变性45 s, 55℃退火45 s, 72℃延伸30 s, 34 个循环; 72℃延伸10 min。PCR 反应结束后将产物用1%琼脂糖凝胶电泳检测,使用DNA 纯化试剂盒(Vazyme, 中国南京)回收目的条带, 送尚亚生物技术公司(福州)测序, 并通过DNAMAN 软件进行序列比对。

表1 NCBI (CDD)鉴定红麻类黄酮合成基因及其结构域Table 1 Genes related to flavonoid synthesis and their domains identified by NCBI (CDD)
1.2.3 红麻HcKAN4 蛋白的系统进化树构建及序列比对分析 在中国国家基因组科学数据中心(National Genomics Data Center)基因组数据库Genome Warehouse (https://ngdc.cncb.ac.cn/gwh)中进行BLASTP比对, 得到‘福红952’红麻KAN4基因的蛋白质序列,用MEGA11.0 软件绘制系统进化树。使用NCBIBlast 在线分析获得不同物种KAN4基因的同源蛋白序列, 通过多序列比对软件DNAMAN 对不同植物KAN4 蛋白序列进行比对分析。
1.2.4 红麻HcKAN4基因表达分析 根据实验室前期建立的红麻‘福红952’不同发育时期根、茎、叶和花等不同组织的转录组数据库, 用R 语言中的pheatmap 函数对‘福红952’红麻HcKAN4基因进行电子表达量热图绘制。
1.2.5 TRV-VIGS 载体构建 以克隆获得的HcKAN4基因为模板, 通过primer 5.0 软件设计位于HcKAN4基因CDS 上约250 bp 特异性片段的引物HcKAN4-SF 和HcKAN4-SR (附表1)。电泳检测PCR产物并回收目标条带, 并测序验证。
pTRV2-HcKAN4 载体构建: 将扩增得到的HcKAN4基因特异性片段、载体pDONR207 和BP酶按BP 反应体系(HcKAN4-250 bp (20 ng μL-1):0.5 μL, pDONR207 vector (40 ng μL-1): 0.5 μL, BP Clonase reaction buffer: 0.25 μL)混匀, 25℃连接12 h,转化到DB3.1 感受态细胞中, 然后涂布在含有50 μg mL-1庆大霉素的LB 平板上。培养12 h 后挑取单克隆, 进行菌液PCR 检测。将阳性菌液提取质粒, 命名为 pDONR207-HcKAN4。将质粒 pDONR207-HcKAN4、载体pTRV2 和LR 酶按LR 反应体系(pDONR207-HcKAN4(80~100 ng μL-1): 0.5 μL,pTRV2 (80~100 ng μL-1): 0.5 μL, LR Clonase reaction buffer: 0.25 μL)混匀后, 过夜连接。转化TOP10 感受态细胞, 37℃培养12 h, 挑取单克隆, 菌液PCR 检测,菌液送尚亚生物技术公司进行测序, 序列比对正确,提取质粒, 将其命名为pTRV2-HcKAN4。
1.2.6 农杆菌转化侵染液制备 将 pTRV1、pTRV2、pTRV2-HcKAN4质粒分别转化根瘤农杆菌GV3101 感受态细胞, 挑取单克隆, 接种到含50 μg mL-1的卡那霉素、50 μg mL-1的庆大霉素和50 μg mL-1的利福平的液体培养基, 28℃培养12 h,菌液PCR 检测后验证阳性克隆。将验证为阳性的菌液, 按1∶100 的比例接种到含有卡那霉素、庆大霉素、利福平的150 mL LB 液体培养基中, 28℃培养12 h, 离心(5000 转min-1, 10 min)收集菌体。以适当体积的重悬液(10 mmol L-1MgCl2, 10 mmol L-12-吗啉乙磺酸以及200 μmol L-1乙酰丁香酮)重悬菌体, 液浓度OD600=0.8。将携带有pTRV1 载体重悬液与分别携带pTRV2、pTRV2-HcKAN4的重悬液按体积比1∶1 混匀, 用于侵染种植7 d 的红麻真叶。将侵染后的植株置于温度25℃、光/暗周期(14 h/10 h)的条件下生长, 并用防虫网遮盖, 根据生长情况浇营养液。
1.2.7 红麻类黄酮合成相关基因鉴定 利用拟南芥类黄酮生物合成相关基因蛋白序列与红麻蛋白质数据库进行BLASTP 比对, 鉴定得到红麻类黄酮生物合成相关基因, 分别为HcPAL、HcCHS、HcF3’H、HcFLS、HcF3’5’H。通过NCBI-CDD 分析进一步确认红麻类黄酮合成候选基因的蛋白质结构域, 再根据实验室前期建立的红麻‘福红952’在不同发育时期不同组织的转录组数据(种子萌发后10 d 下胚轴、种子萌发后60 d 茎皮、种子萌发后120 d 茎皮), 分析类黄酮合成相关基因在红麻茎皮中的表达模式。
1.2.8 红麻细胞壁合成相关基因的筛选 根据实验室已发表文献[25]得到红麻木质素合成途径相关基因HcPAL、HcC4H、Hc4CL、HcCOMT、HcHCT、HcCCR、HcCAD、HcC3H、HcF5H, 纤维素合成途径相关基因HcCSLD12、HcCESA9、HcCESA5、HcCEL6, 分析红麻生长发育过程中细胞壁合成相关基因的电子表达模式。
1.2.9 实时荧光定量PCR 分析 以红麻Hc18sRNA为内参基因, 使用荧光定量PCR 仪试剂盒(GOTaqqPCR Master Mix (Promega, 美国)), 在实时荧光定量PCR 仪CFX96 (Bio-Rad, 美国)中进行qRT-PCR扩增。qRT-PCR 反应体系为cDNA 2.0 μL、左引物和右引物各0.7 μL、SYBR Green I 10.0 μL、ddH2O 6.6 μL, 扩增程序为50℃ 2 min, 95℃ 10 min; 95℃变性15 s, 60℃退火/延伸1 min, 40 个循环。每个样品设置3 个技术重复, 采用2-ΔΔCt计算基因的相对表达量[26]。采用Microsoft Excel 软件进行数据处理和作图, 用SPSS Statistics 25 软件分析显著性。
2 结果与分析
2.1 红麻HcKAN4 基因克隆与生物学信息分析
以红麻‘福红952’叶片cDNA 为模板, 以HcKAN4-F/R为引物克隆获得HcKAN4基因(图1-a), 扩增结果和预期片段大小一致。基因结构分析表明(图1-b),HcKAN4基因包含6 个外显子、521 bp 的5′非翻译区(non translated region, UTR)和226 bp 的3′UTR, 编码322 个氨基酸。预测蛋白分子量为35.38 kD, 等电点(pI)为6.90, 分子式为C1523H2425N449O490S16。该蛋白氨基酸含量较多的有Ser (41 个, 12.7%)、Leu (39 个,12.1%)、Gly (24 个, 7.5%)、Thr (20 个, 6.2%)、Asp (21个, 6.5%), 氨基酸不包含Pyl 和Sec。通过蛋白质序列比对分析表明, 红麻、棉花、木槿、榴莲和葡萄的KAN4 蛋白序列比对都包含一段高度保守的氨基酸序列, 属于MYB 保守结构域, 属于MYB 家族(图1-c), 其氨基酸序列与棉花、木槿、榴莲和葡萄比较发现都具有较高的同源性, 其中与木槿同源性最高,达到87.42%, 说明该基因在锦葵科植物中具有较高的保守性。使用MHMM 软件对Hc.KAN4蛋白的跨膜结构区进行分析, 发现Hc.KAN4整条肽链都在细胞膜外侧, 说明不存在跨膜螺旋(附图 1)。通过MEGA7.0 软件构建Hc.KAN4蛋白与其他植物KAN4蛋白的系统发育树, 探究它们之间的同源关系(附图2)。由图可知,Hc.KAN4与拟南芥和木槿的同源关系较近, 与油菜、辣椒的同源关系较远。
2.2 HcKAN4 基因在不同时期不同组织中的表达分析
由图2-a 可知,Hc.KAN4基因在旺盛生长期(种子萌发后60 d 根、茎皮、茎骨和叶)及工艺成熟期(种子萌发后120 d 茎皮)的表达特征。Hc.KAN4在茎和叶中均有不同程度的表达, 在旺盛生长期根和茎骨中表达低, 而工艺成熟期(种子萌发后120 d)茎皮表达量最高, 说明Hc.KAN4基因具有组织特异性。在种子萌发后120 d 时茎皮中的表达量约为60 d 的12倍, 说明Hc.KAN4基因随着植物生长在茎皮中发挥着重要作用。分析Hc.KAN4基因在不同发育时期的圆叶(R)、三裂叶(B3)、五裂叶(B5)和七裂叶(B7)叶片的表达特征(图2-b)发现,Hc.KAN4基因在R7 时具有最高表达量, 是R、B3、B5 时期的8.56 倍、1.21倍、4.86 倍, 表明随着叶片生长发育, 该基因表达量总体呈升高的趋势, 推测Hc.KAN4基因可能参与红麻叶片发育的调控。
2.3 红麻HcKAN4 沉默载体的构建及农杆菌转化
为了验证该基因的功能, 以TRV 作为病毒载体沉默目的基因HcKAN4, 构建TRV-HcKAN4载体并转化农杆菌GV3101。以红麻叶片cDNA 为模板进行PCR, 得到一条与预期大小一致的扩增片段, 表明为特异性片段。回收该目的片段后通过Gateway技术构建 pTRV2-KAN4载体, 经冻融法获得转入pTRV1、pTRV2 (空载)、pTRV2-KAN4载体的农杆菌GV3101, 用特异引物进行菌液PCR 鉴定, 结果如图3 所示, 出现符合预期的条带, 表明3 个TRV-VIGS表达载体成功转入到农杆菌GV3101 中。

图3 红麻Hc.KAN4 基因重组载体质粒转化后菌液PCR 检测Fig. 3 PCR detection of Hc.KAN4 recombinant plasmid transformation in kenaf

图4 红麻HcKAN4 的cDNA 和氨基酸序列Fig. 4 cDNA and amino acid sequences of HcKAN4 in kenaf
2.4 TRV-VIGS 诱导HcKAN4 基因沉默的效率检测
当沉默HcPDS基因的植株开始出现白化表型,随机选取6 株沉默HcKAN4基因的红麻植株, 以及长势与沉默植株一致的3 株空载处理的红麻植株作为对照。本研究通过qRT-PCR 检测TRV-VIGS 对红麻叶中HcKAN4基因表达水平的影响(图5-a)发现,VIGS 沉默后, 与对照相比, 6 株沉默植株的相对表达量都达到显著性降低, 沉默效率达到100%。为证实TRV-VIGS 沉默效果是否是整株植物沉默, 随机选取2 株沉默HcKAN4植株, 取其茎皮和2 株空载处理植株作为对照(图5-b)。与对照相比, 沉默植株茎皮的相对表达量也出现了降低, 沉默效率100%,说明TRV-VIGS 是整株沉默且沉默效率良好。
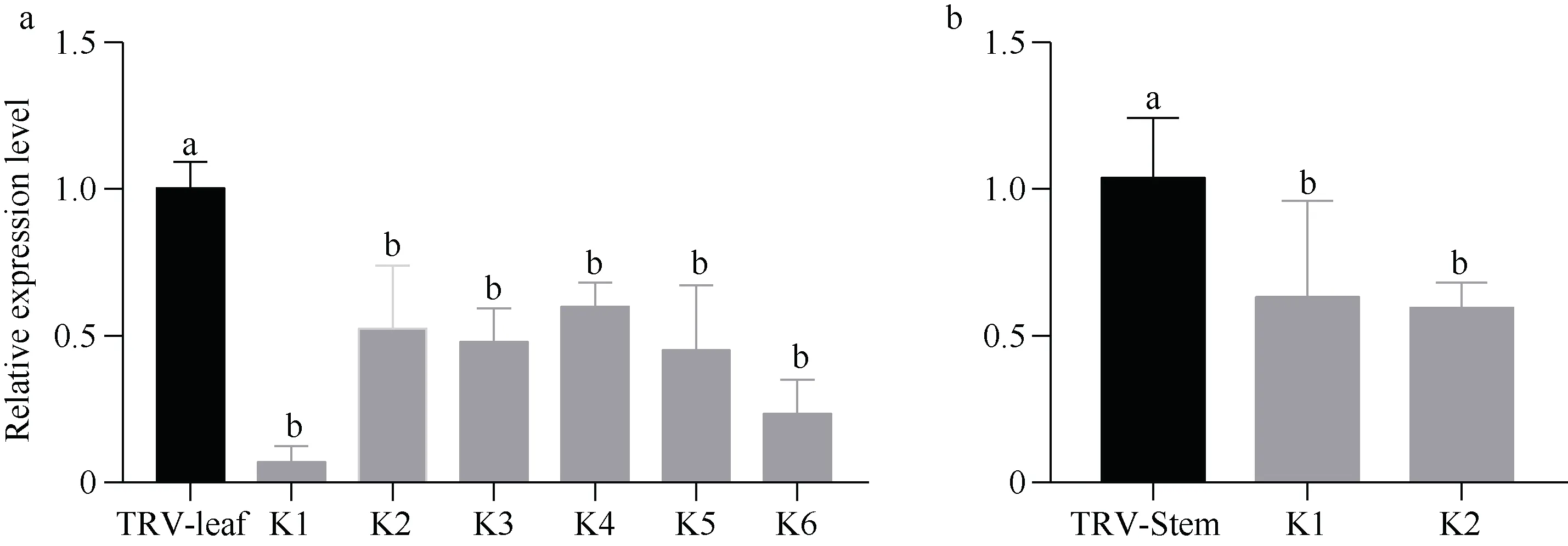
图5 HcKAN4 基因沉默后红麻植株的沉默效果检测Fig. 5 Silencing effect detection of individuals after HcKAN4 gene silencing in kenaf
2.5 HcKAN4 基因沉默对类黄酮合成基因表达的影响
2.5.1 类黄酮合成相关基因在不同发育时期茎皮中的表达分析 利用拟南芥类黄酮合成相关基因蛋白质序列, 通过与红麻蛋白质数据库BLASTP 鉴定, 得到红麻类黄酮合成相关基因, 通过NCBI-CDD 对这些基因的结构域进一步分析(表1)。由表1 可知,Hc.CHS蛋白具有PLN03172 super family 结构域,Hc.F3'H具有p450 super family 结构域,Hc.ANS具有PLN03178 结构域,Hc.ANR具有PLN00198 super family 结构域,Hc.F3’5’H具有p450 super family 结构域。
通过对鉴定得到的类黄酮合成基因在红麻不同时期茎皮的电子表达量进行表达模式分析(图6)发现, 5 个类黄酮合成基因的电子表达量都随着生长时间增加在茎皮中的表达量呈显著性增加的趋势, 说明类黄酮在植物茎皮的生长发育中起着重要作用。由图7-a 可知, 红麻木质素合成相关基因Hc.PAL、Hc.C4H、Hc.COMT、Hc.HCT、Hc.CCR、Hc.CAD、Hc.C3H、Hc.F5H的电子表达量随着植株生长时间的增加呈显著性降低的趋势, 只有木质素合成相关基因Hc.CCT的电子表达量先降低后增加的变化;由图7-b 可知, 红麻纤维素合成相关基因Hc.CSLD、Hc.CESA9、Hc.CESA6、Hc.CEL6的电子表达量随着植物生长时间增加呈显著性降低的趋势。说明随着植株生长时间增加, 茎皮中类黄酮合成基因的电子表达量呈显著性增加趋势, 而茎皮中的木质素和纤维素合成相关基因呈显著性降低趋势, 类黄酮表达量的增加导致了木质素基因和纤维素合成酶基因表达量的减少, 由此可说明类黄酮相关基因高表达可能不利于红麻纤维品质改良。
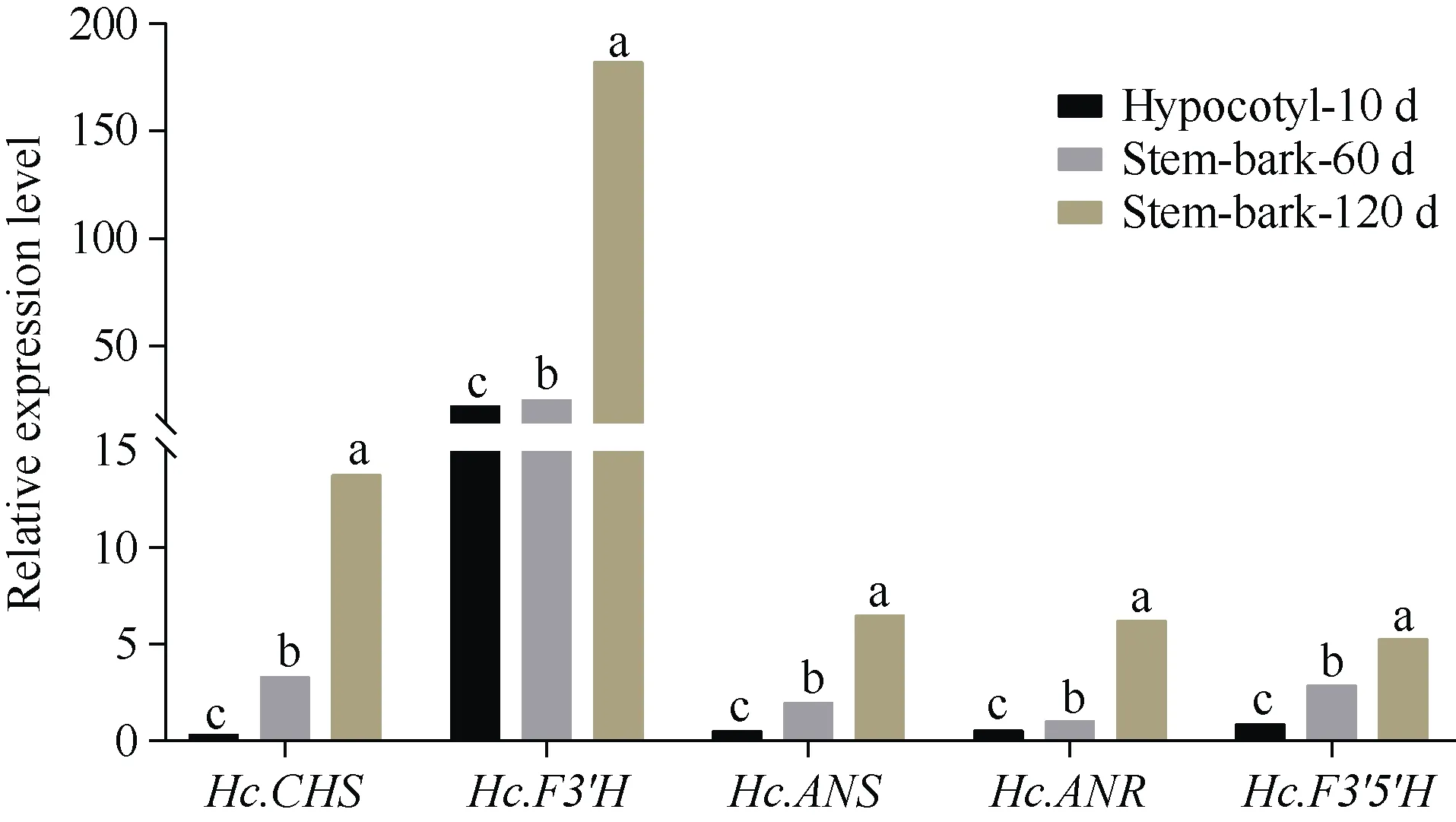
图6 红麻类黄酮合成相关基因在不同时期茎皮的表达分析Fig. 6 Relative expression level of genes related to flavonoid biosynthesis at different stages in kenaf

图7 红麻纤维素和木质素合成相关基因在不同时期茎皮的表达量Fig. 7 Relative expression level of genes related to cellulose and lignin biosynthesis at different stages in kenaf
2.5.2HcKAN4基因沉默植株类黄酮合成相关基因的表达分析 对HcKAN4基因VIGS 沉默处理的和对照组的红麻茎皮中的类黄酮合成相关基因进行qRT-PCR 检测(图8)发现,HcKAN4基因VIGS 沉默植株中, 类黄酮合成基因HcF3’H、HcCHS、HcF3’5’H、HcANS、HcANR在茎皮的表达量下调达到极显著水平, 分别是对照组的0.51、0.14、0.23、0.11 倍。表明HcKAN4 基因能够影响红麻类黄酮合成基因的表达, 从而影响类黄酮的生物合成。

图8 红麻HcKAN4 基因VIGS 沉默后类黄酮合成相关基因的qRT-PCR 分析Fig. 8 Relative expression level of flavonoid synthesis-related genes after VIGS silencing of HcKAN4 gene in kenaf
3 讨论
3.1 MYB 转录因子在类黄酮和纤维发育中的作用机制
MYB 转录因子在类黄酮合成和纤维发育中发挥着重要作用, 本研究利用TRV-VIGS 技术鉴定了HcKAN4基因在红麻类黄酮合成中的作用。结果显示, 在HcKAN4基因沉默后, 类黄酮合成基因表达量均显著减少, 说明HcKAN4是红麻类黄酮代谢途径中部分酶基因的关键调控因子。进一步分析发现,该基因在红麻中主要在茎、叶中表达而在根中不表达。在油菜中,KAN4基因在根茎叶中都有表达, 在根中的表达量显著高于茎、叶[27], 表明该基因同源基因在不同植物存在不同表达模式, 具有组织特异性。
多种转录因子对类黄酮生物合成通路中的基因有调控作用, MYB 转录因子调控类黄酮的途径也有相关报道。Zhai 等[28]发现PbMYB10b可以调控PAs的生物合成, 但其功能可以被其他MYB 转录因子补充。Li 等[29]发现FhMYB5 和bHLH 转录因子基因FhTT8L和FhGL3L共同作用时, 类黄酮合成基因被激活。Zhu 等[30]从菊花中发现R2R3-MYB 转录因子的CmMYB8基因对木质素和类黄酮化合物的合成起到负调控作用。在棉花中发现R2R3-MYB基因与纤维品质有遗传相关性[31]。本研究发现, 沉默HcKAN4基因显著下调红麻类黄酮化合物合成酶基因的转录水平, 可能正向调控木质素合成相关酶基因的表达。根据这些结果推测, 红麻HcKAN4沉默后可能抑制了黄酮类化合物的合成而促进纤维素含量积累。而提高纤维素含量是改良纤维品质的关键途径,因此, 这为改善红麻纤维品质的分子育种提供了新的研究思路。
关于HcKAN4基因与类黄酮合成相关基因HcF3’H、HcCHS、HcF3’5’H、HcANS、HcANR之间的调控关系, 是通过转录调控还是蛋白结合等方式实现, 目前还没有相关文献报道。生物信息学分析结果显示, 红麻类黄酮合成相关基因HcF3’5’H(Hc.10G006460)启动子上游1959 bp 处存在1 个HcKAN4的结合元件(TTTTTACGGTTA), 其功能是MYB binding site involved in flavonoid biosynthetic genes regulation。多项研究显示, 该元件是MYB 转录因子家族调控下游靶基因的核心元件。因此, 转录因子HcKAN4可能结合HcF3’5’H启动子进而调控类黄酮的合成。具体调控机制有待进一步深入研究。
3.2 TRV-VIGS 的影响因素
VIGS 具有不通过稳定遗传转化就降低目的基因表达水平的特征, 从而可以研究目的基因表达水平降低后对作物表型的影响。VIGS 的沉默效率受多种因素影响, 如载体种类[32]、侵染方法[33]、侵染时间[34]等。VIGS 在不同的植物中沉默效率也有较大差别, Jia 等[35]发现草莓CHS 基因的沉默效率达80%左右, 而本研究中沉默Hc.KAN4基因沉默效率为100%。现阶段VIGS 研究通常沉默一个基因, 从而研究基因功能作用。李玉霞等[36]通过共沉默GbCHI、GbDFR和GbF3’H来研究在海岛棉中的抗枯萎病发现, 共沉默相对于单独沉默GbF3’H的作用效果有显著提升。通过共沉默来探讨红麻HcKAN4基因与类黄酮合成相关基因HcF3’H、HcCHS、HcF3’5’H、HcANS、HcANR之间的调控关系, 有待进一步研究。
4 结论
HcKAN4基因表达具有组织特异性, 在茎、叶中的表达量显著高于根中。TRV-KAN4 的沉默效率良好, 且沉默植株中类黄酮合成相关基因的表达量与对照相比显著下降, 通过对植株在相同组织不同时期的表达量发现, 类黄酮合成相关基因的表达量呈上升趋势, 而纤维素和木质素相关基因的表达量呈下降趋势。推测该转录因子可以影响类黄酮的生物合成, 进而影响红麻的纤维发育。

