小麦TaPOD 家族的全基因组鉴定及表达分析
琚吉浩 马 超 王添宁 吴 毅 董 钟 方美娥 陈钰姝张 均,* 付国占,*
1 河南科技大学农学院, 河南洛阳 471000; 2 河南科技大学食品与生物工程学院, 河南洛阳 471000
过氧化物酶(Peroxidase, POD)是一种以过氧化氢为电子受体具有催化底物氧化的酶。其包含有两类: 血红素过氧化物酶(heme Peroxidase)和非血红素过氧化物酶(nonheme Peroxidase); 血红素过氧化物酶进一步可以分为动物过氧化物酶和非动物过氧化物酶, 而非动物过氧化物酶主要分为3 类, 分别称为I 类过氧化物酶(Class I Prxs)、II 类过氧化物酶(Class II Prxs)、III 类过氧化物酶(Class III Prxs)[1], 它们所包含的种类以及主要存在的位置不同。I 类过氧化物酶主要是微生物中的过氧化物酶和抗坏血酸过氧化物酶, II 类主要是真菌分泌性过氧化物酶[2]。III 类过氧化物酶主要是植物中的过氧化物酶, 又称分泌性植物过氧化物酶[3]。
POD基因参与了植物广泛的生理过程, 大量研究表明细胞生长和细胞壁松动、木质化、生物以及非生物胁迫反应、植物生长、成熟和衰老都与之密切相关[4]。该基因通过调控活性氧(reactive oxygen species, ROS)的产生在棉花纤维细胞的伸长过程中发挥重要的作用[5]。在拟南芥细胞损伤和正常生长过程中, 根的曲率伸长率会受到H2O2浓度的影响, 同时AtPRX有增强细胞壁限制细胞扩张的作用[6]。另外,POD家族基因与植物的生长发育关系密切。在一些单子叶植物中,POD基因可以参与调节H2O2水平来直接控制细胞壁的伸长过程, 因此POD基因参与调控了根系及幼苗叶片的生长[7]; 在双子叶植物西葫芦中, 过量表达APRX基因同样可以产生更长的根和芽的表型[8]。植物细胞在生物以及非生物胁迫下会积累过量的活性氧(ROS)[9], 从而改变细胞组分, 导致细胞膜系统受到损伤[10], 最终使植物减产甚至死亡。然而, 植物体内存在抗氧化酶系统可以清除ROS, 其中POD 在这一过程中起着关键作用[11]。有研究表明, 过量表达CrPRX基因可以提高烟草对盐和干旱胁迫的耐受性[12], 在小麦中TaPRX-2A的过量表达也可以增强小麦对盐胁迫的耐受性[13]。
小麦由于其具有较长的生育期而更容易受到不利环境的影响。随着气候的恶化和环境污染的加剧, 环境胁迫成为影响小麦生长发育和产量的重要障碍[14]。特别是一些极端天气的发生, 将严重影响小麦的产量。例如, 在小麦拔节到孕穗期遭遇倒春寒造成小麦的严重减产[15]; 在小麦扬花灌浆期受到干热风影响, 也会严重干扰小麦的各种生理功能, 导致显著减产[16]。因此对于小麦的抗逆性和生长发育的研究显得意义重大。多数研究证明, 提高植物的抗氧化物酶的活性对提高植物的抗逆性有一定作用[16]。而且POD基因广泛存在于植物的整个生理过程中, 小麦的生长发育、逆境胁迫响应和种子萌发都与之相关[17]。尽管POD基因家族在植物的生长发育和逆境响应中具有重要的作用, 但该家族在小麦中的家族成员还缺乏系统的鉴定和分析。本研究通过生物信息学分析的方法鉴定了659 个小麦TaPOD基因家族成员, 分析了其基因结构、种内共线性以及重复关系、进化关系、启动子顺式作用元件、基因表达模式等, 有助于进一步了解小麦中TaPOD家族的结构和进化关系, 为进一步推进小麦TaPOD家族成员应用于提高小麦抗旱性进而增加小麦产量提供理论依据。
1 材料与方法
1.1 小麦TaPOD 家族的全基因组鉴定
从 EnsemblPlants 数据库(http://plants.ensembl.org/index.html)获取小麦氨基酸序列、小麦基因注释文件(gff文件)、基因组核酸序列, 以拟南芥AtPOD 蛋白序列作为query 序列进行BLASTP 比对(E-value<1e-5)获得同源序列。在Pfam 数据库(http://pfam.xfam.org/)下载TaPOD 保守结构域(PF00141), 利用HMM3.0 (http://hmmer.org/)进行保守结构域比对, 筛选出含有保守结构域的小麦TaPOD 家族候选成员, 通过BLAST 和HMMER 共同选择得到TaPOD 家族成员。使用在线工具ExPASy (https://web.expasy.org/protparam/)对TaPOD 蛋白进行等电点、分子量、亲水性分析。
1.2 小麦TaPOD 基因系统发育、基因结构和保守基序分析
利用MEGA11[18]工具对TaPOD 蛋白序列进行多重比对, 同时利用该工具采用邻接法(Neighbor-Jointing, NJ)构建系统发育进化树(bootstrap, 1000; motif, 10)。使用gff 基因注释文件进行基因结构分析。为鉴定TaPOD 蛋白motif,使用TaPOD 氨基酸序列, 在MEME[19]网站上进行分析,使用默认参数, 鉴定5 个motif。利用Tbtools[20]软件进行可视化分析。
1.3 小麦TaPOD 基因染色体定位和共线性分析
根据IWGSC (http://wheat-urgi.versailles.inra.fr/)小麦基因组的注释文件数据获得TaPOD基因在染色体上的物理位置。利用TBtools 构建基因在染色体上的物理图谱。利用MCScanX[21]进行共线性分析(E-value<1e-5), Advance Circos 进行可视化分析。利用Tbtools 进行序列中未知碱基分布分析, 同时做可视化分析。
1.4 小麦TaPOD 基因家族Ka/Ks 分析
在EnsemblPlants 数据库中获取小麦的基因组, 使用MCScanX 软件对TaPOD家族进行共线性分析, 选择具有共线性的基因对, 计算非同义替换率(Ka)和同义替换率(Ks)的比值, 来推断自然选择压力, 从而研究基因进化中的选择压力。若Ka/Ks比率大于1, 则认为该基因在进化过程中受到了正向选择, 加快基因进化速度; 若Ka/Ks比率等于1, 则为中性选择, 也就是自然选择对其未产生显著影响;Ka/Ks比率小于1, 则认为该基因经过了纯化选择。
1.5 小麦TaPOD 基因的顺式作用元件分析
截取小麦TaPOD基因CDS 上游2.0 kb 的DNA 序列,提交至PlantCARE 数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)进行启动子顺式作用元件的预测。筛选出候选的结合元件进行可视化分析。
1.6 小麦TaPOD 基因在不同组织中的表达特性
为鉴定小麦TaPOD基因在不同组织中的表达特性,以普通小麦中国春作为试验材料, 采集五叶期小麦的根系、叶片以及灌浆后15 d 的籽粒材料进行RNA-Seq, 由百迈客生物科技有限公司完成测序。根据TaPOD基因的FPKM 值绘制表达量热图。
1.7 小麦叶片总RNA 的提取、cDNA 的合成及RT-qPCR检测
选用中国春小麦品种为试验材料, 选择籽粒大小一致的种子, 用蒸馏水冲洗后, 进行小型盆栽种植, 在室温下待种子发芽后置于光照培养箱中, 在22℃、光照强度180 μmol m-2s-1、光/暗周期为16 h/8 h 的条件下培养。待其生长至二叶一心期时进行生长素(100 μmol L-1IAA)、赤霉素(100 μmol L-1GA)、脱落酸(100 μmol L-1ABA)、玉米素(100 μmol L-1ZT)、盐胁迫(200 mmol L-1NaCl)、低温(4 ℃)、高温(38 ℃)、干旱(20% PEG-6000)处理, 以正常生长为对照。在处理后的12 h 取不同处理的叶片, 立即置于液氮保存。使用TRIZOL (TaKaRa, 9108Q)试剂提取RNA, 反转录成cDNA (PrimeScrip RT reagent Kit with gDNA Eraser (Perfect Real Time), RR047Q), 利用软件Primer Premier 5 设计引物(表1), 用于之后的qPCR 分析。其中qPCR 反应体系与程序参考ChamQ Universal SYBR qPCR masier Mix (Vazyme)试剂盒说明书, 采用2-ΔΔCt法计算相对表达量[22]。

表1 部分TaPOD 基因荧光定量所用的引物Table 1 Partial primers of TaPOD genes for RT-qPCR
2 结果与分析
2.1 小麦TaPOD 家族全基因组鉴定
根据拟南芥107 个TaPOD 的蛋白序列, 利用BLASTP得到500 个候选基因, 通过结构域使用HMM 比对得到747 个候选基因, 合并去重后在小麦基因组数据库中总共得到731 个TaPOD候选基因, 利用NCBI-CD 去除结构域不完整的成员, 最终得到659 个TaPOD基因。根据蛋白序列编号从小到大原则, 将其重新命名为TaPOD1至TaPOD659。对其蛋白质的一级结构进行分析(附表1), 659个TaPOD基因的氨基酸数量为 206~518; 分子量为22.94~53.58 kD; 理论等电点为4.20~11.36, 其中有283 个蛋白理论等电点位于碱性位置, 1 个位于中性位置, 其他位于酸性位置; 不稳定指数在18.69~82.99, 有398 个不稳定指数小于40 的蛋白; 亲水值在-0.52~0.30 之间, 其中有253 个亲水蛋白, 其他为疏水蛋白。
2.2 小麦TaPOD 基因家族系统发育、基因结构和保守基序分析
基于进化关系,TaPOD家族可以分为7 组(I~VII) (图2)。每组成员分布不均匀, 第IV 组成员数量最多, 第V 组成员数量最少。多数情况下, 聚在同一分组的TaPOD基因表现出相似的序列结构。利用MEME motif 搜索工具, 鉴定出5 个相关的保守基序(图1)。其中有537 个TaPOD基因包含5 个motif (图3), 有122 个基因存在缺失, 缺少motif3 结构的基因有10 个, 同时存在22 个基因仅包含motif3。依据基因组注释文件, 获得了TaPOD基因的外显子和内含子结构。由图3 可知, 所有基因均具有完整的CDS, 但有76 个基因不存在UTR, UTR 的缺少可能是导致基因功能发生变化的原因。进化关系较近的基因存在保守的外显子-内含子结构, 尤其在这些基因的保守结构域中表现更为明显。
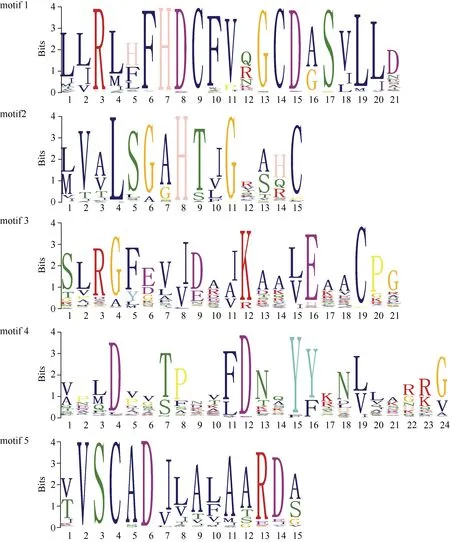
图1 小麦TaPOD 家族成员的保守序列标识Fig. 1 Identification of conserved sequence of TaPOD family members in wheat
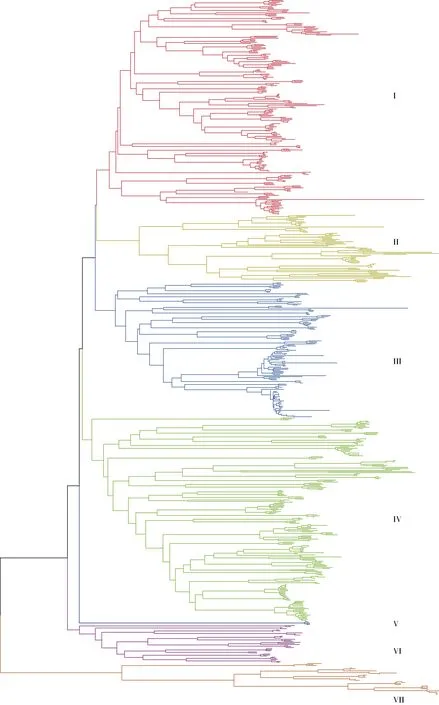
图2 小麦TaPOD 家族成员的系统发育关系Fig. 2 Phylogenetic relationships among members of TaPOD family in wheat
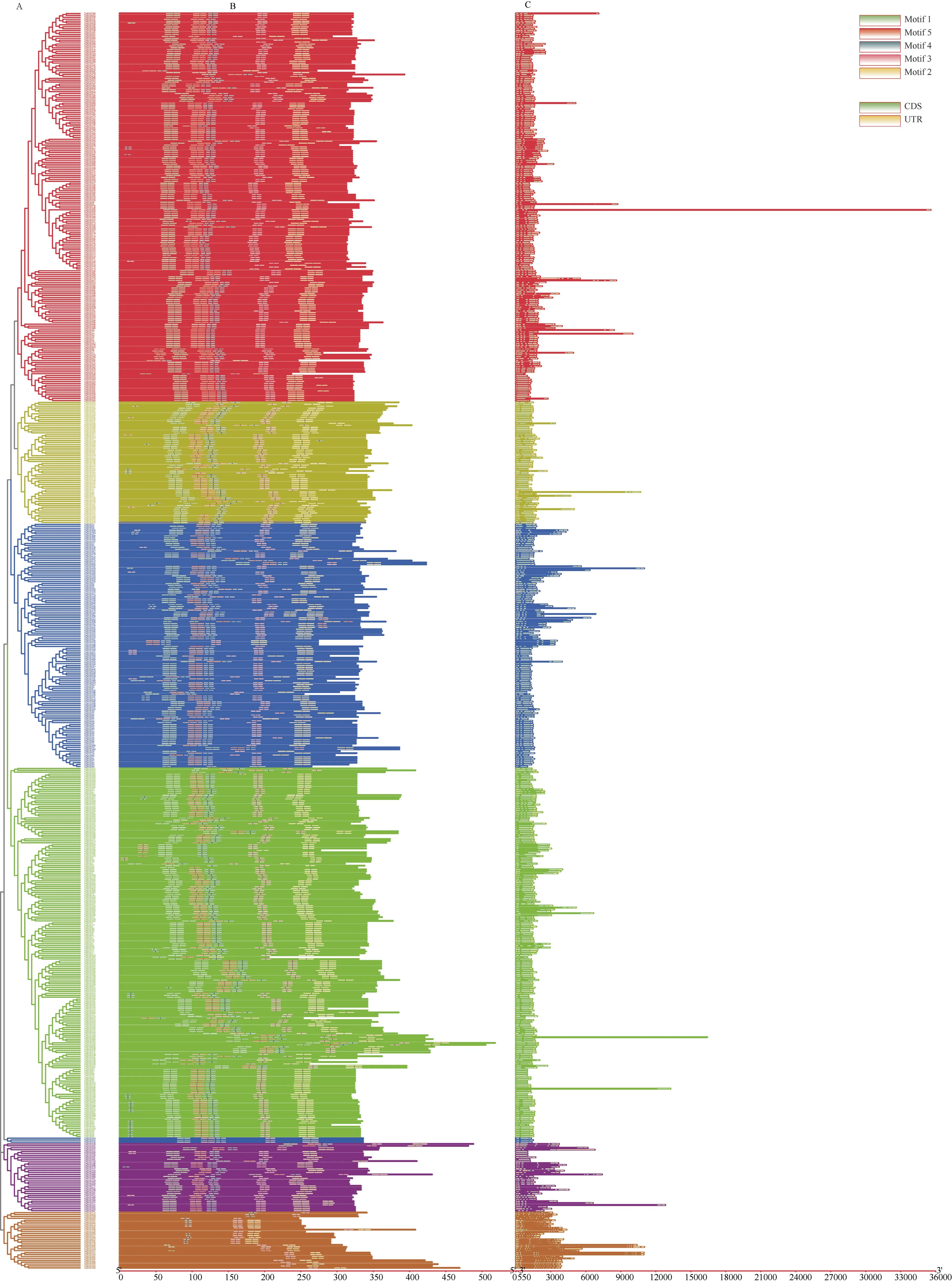
图3 小麦TaPOD 基因的保守基序及基因结构分析Fig. 3 Analysis of the phylogenetic relationship and gene structure of TaPOD gene in wheat
2.3 小麦TaPOD 基因的染色体分布及共线性分析
根据基因在染色体上的位置, 绘制TaPOD基因的染色体定位图(图4)。结果表明, 小麦TaPOD基因在3 个亚基因组(A、B、D)上分布较为均匀(A: 215、B: 220、D: 210)。在2 号染色体(2A、2B、2D)上数量最多, 有180 个基因, 在4 号染色体(4A、4B、4D)上最少, 有49 个基因。其中, 265个小麦TaPOD基因形成了152 对串联重复基因对(图4 中黑色小线条连接表示)。由于六倍体小麦中的基因密度较大, 染色体中呈现密集的蓝色线条, 只有染色体两端存在密度较小的区域呈现黄色线条。
为明确小麦TaPOD基因的扩展与小麦多倍化间的关系, 通过MCscanX 对TaPOD基因进行重复模式分析。结果显示, 小麦中共存在81,537 个共线性区域(包含Un 染色体), 163,074 个基因(图5)。其中有396 个TaPOD基因定位在共线性区域内, 表明这些成员是由于基因的片段复制而产生, 也可能是随着小麦多倍化过程中产生。而在串联复制和片段复制事件中涉及到103 个TaPOD基因, 证明这些基因是由两种模式共同作用而扩增出来的。同时图中环1 显示小麦中的基因密度普遍较大。由环3 可知, 在Un 染色体上存在大量未知碱基部分(序列中用N 表示),而其他染色体仅在个别位置存在未知碱基的分布, 同时环2 中线的波动也与之相互印证。
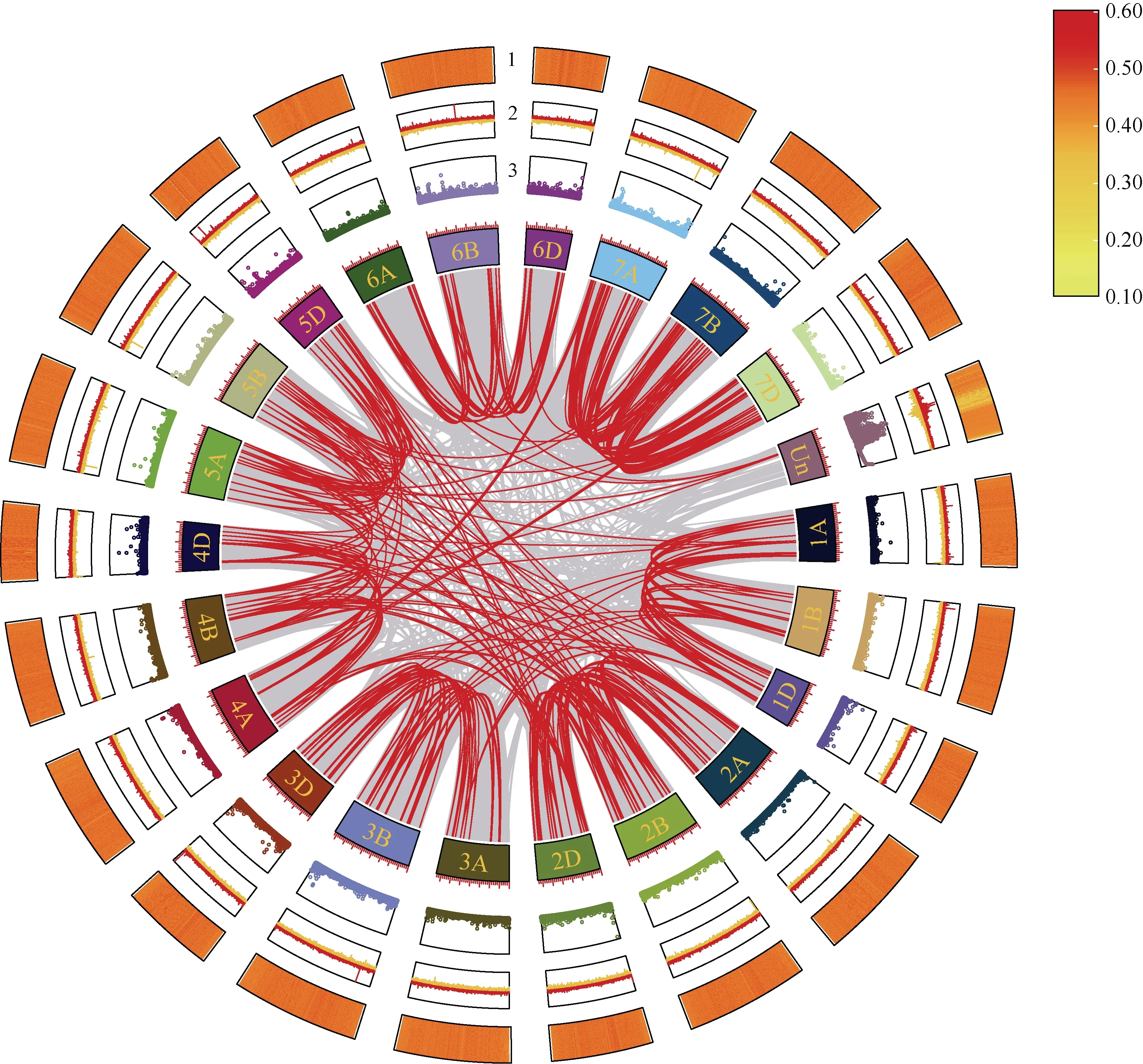
图5 小麦TaPOD 基因的区域共线性关系Fig. 5 Regional collinearity of TaPOD gene in wheat
为了确定小麦TaPOD重复基因在进化过程中受到的自然选择压力, 对396 个重复基因进行了Ka/Ks分析(附表2)。由表2 (部分)显示, 396 个重复事件中, 有4 个事件的Ka/Ks比率大于1 (TraesCS1B02G096000.1 和TraesCS1D02G 080000.1; TraesCS3B02G034300.1 和 TraesCS3D02G 031800.1; TraesCS4A02G036100.1 和TraesCS4D02G 268200.1; TraesCS4B02G268900.1 和 TraesCS4D02G 268200.1), 比率分别为1.26、1.81、1.45、1.88, 这4 对复制事件可能是加速基因进化的关键所在。剩余的TaPOD基因Ka/Ks值在0.023629782~0.963772088 之间, 表明这些基因在进化中得到了纯化选择。
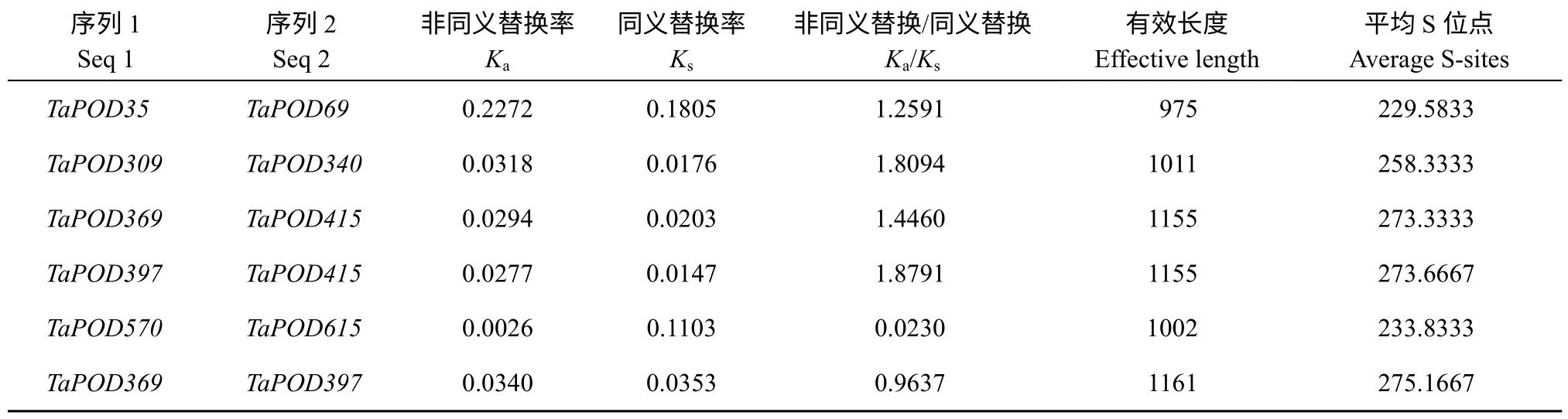
表2 TaPOD 基因Ka/Ks 分析(部分)Table 2 Ka/Ks of repeated events in wheat TaPOD (Part)
2.4 小麦TaPOD 基因启动子的顺式作用元件分析
转录因子通过与顺式作用元件结合来调控基因表达,对小麦TaPOD基因启动子区域的顺式作用元件进行分析,可以为研究这些基因的表达调控提供理论依据。结果表明(图6), 其上游2 kb 区域包含有12 种与植物生长发育、7种与植物抗性以及11 种参与激素反应的顺式作用元件。从中筛选23 种元件进行了可视化分析。在659 个小麦TaPOD基因中,TaPOD13、TaPOD22和TaPOD24仅含有3 个元件结合位点, 而TaPOD366中存在48 个启动子元件结合位点, 其他基因的结合位点数量在这两者之间。其中含有与光反应有关的 G-box 启动子顺式作用元件,只有33 个成员不存在这个结合位点。而与昼夜节律的控制有关的circadian 启动子顺式作用元件数量较少, 只在90 个成员中存在。同时从整体来看, 与植物生长发育、激素反应、抗逆性响应有关的启动子元件分别占总元件数的47.4%、39.3%、13.3%。以上结果表明,TaPOD家族成员可能主要参与调控植物生长发育以及响应多种逆境胁迫。

图6 小麦TaPOD 基因启动子顺式作用元件Fig. 6 Cis-acting element of TaPOD gene promoter in wheat
2.5 小麦TaPOD 基因家族的组织表达模式分析
小麦TaPOD基因表达模式分析见图7, RNA-Seq 结果中总鉴定到的TaPOD家族成员422 个, 这些成员可以分为7 类(A~G), 其中86.5%TaPOD基因在小麦根系中的表达量较高, 而在籽粒和叶片中表达量较低或不表达。在A和G 组中, 有53 个基因在小麦根、籽粒、叶片中均有表达, 在这其中有17 个基因具有较高的表达量。其中有104个TaPOD成员只在根中表达, 而只在叶片中表达的有5 个成员以及有2 个成员只在籽粒中表达并且表达量都小于1;有11 个家族成员在根中不表达而在籽粒和叶片中有表达量; 在3 个组织都有表达量的有117 个, 占全部成员的30%,同时3 个组织中表达量都大于1 的有38 个成员; 这其中还有52 个成员在这3 个组织中表达量为0。进一步分析可知,TaPOD237在小麦根系表达量最高, 而在籽粒中表达量为0,在叶片中表达量小于0.1;TaPOD630在籽粒和叶片中表达量都最高, 而在根系中仅有0.24;TaPOD163、TaPOD228在小麦根系、叶片和籽粒中均具有较高的表达量。这说明TaPOD基因在植物的各个组织中都具有很大作用, 同时对小麦根系生长发育过程具有更重要影响。
2.6 小麦TaPOD 基因家族对外源激素和逆境响应的表达模式分析
为研究TaPOD基因对外源激素和逆境的响应, 在图7中的聚类分组中每组挑选一个, 同时挑选TaPOD534(POD11-A)的另外2 个亚基因组成员(TaPOD570(POD11-B)、TaPOD615(POD11-D)), 共挑选9 个TaPOD基因进行RT-qPCR 验证, 结果显示(图8), 在4 种外源激素的处理下,TaPOD8、TaPOD340、TaPOD256的表达量均有所提高, 而TaPOD228对于外源激素没有响应。在赤霉素处理下, 除TaPOD228与TaPOD26没有显著变化外, 其他7 个基因的表达量明显上调, 其中TaPOD8和TaPOD340上调最高, 其相对表达量较对照分别提高了 42.4 倍和 34.1 倍。TaPOD534、TaPOD615、TaPOD8、TaPOD256、TaPOD458、TaPOD340在生长素的处理下相对表达量显著升高。多数基因对脱落酸的响应较弱, 只有TaPOD340的相对表达量较对照上调2.1 倍,TaPOD570的相对表达量较对照下调0.5倍。TaPOD458、TaPOD26、TaPOD340在玉米素的处理下,相对表达量较对照分别上调了6.3、2.6 和4.5 倍,TaPOD507的相对表达量较对照下调0.7 倍, 其余5 个激素相对表达量没有明显变化。
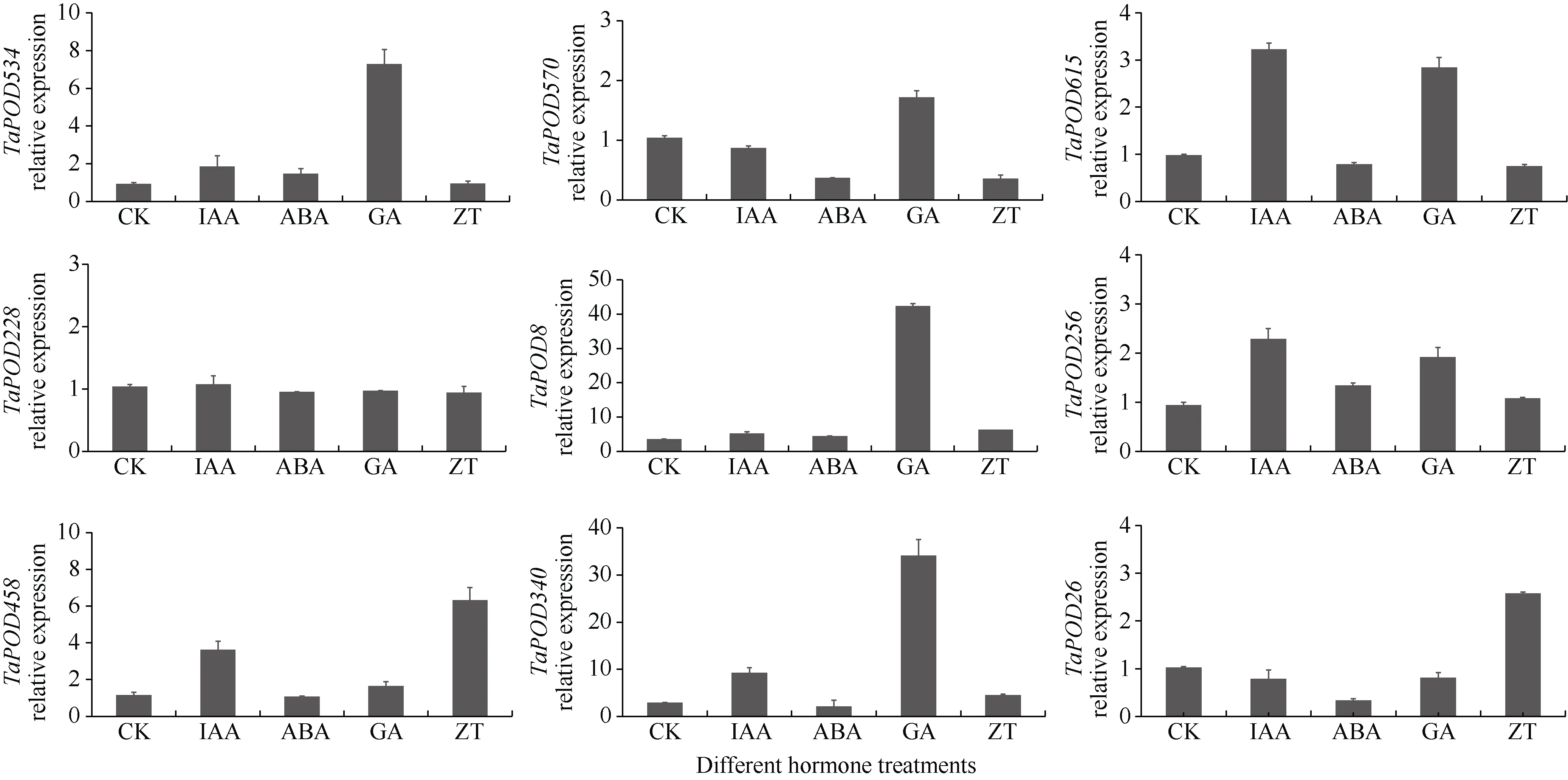
图8 TaPOD 基因家族成员在4 种激素处理下的表达模式分析Fig. 8 Relative expression pattern of TaPOD gene family members under four hormone treatments
在4 种逆境胁迫下,TaPOD228和TaPOD26的相对表达量均显著下调, 而TaPOD458和TaPOD534则全部上调,且上调倍数较大(图9)。在盐胁迫下,TaPOD534、TaPOD8、TaPOD256、TaPOD458、TaPOD340相对表达量显著上调,其中TaPOD534与对照相比上调了13.3 倍; 而TaPOD570、TaPOD615、TaPOD228、TaPOD26均下调表达, 其中TaPOD615下调不显著。在低温胁迫下,TaPOD534、TaPOD615、TaPOD8、TaPOD256、TaPOD458、TaPOD340相对表达量均显著上调, 且TaPOD340与对照相比上调了23 倍。在高温胁迫下, 只有TaPOD534、TaPOD8、TaPOD458的相对表达量显著上调, 其他基因均为下调表达。在干旱胁迫中,TaPOD458、TaPOD534的相对表达量较对照分别上调15.3 倍和8.6 倍。
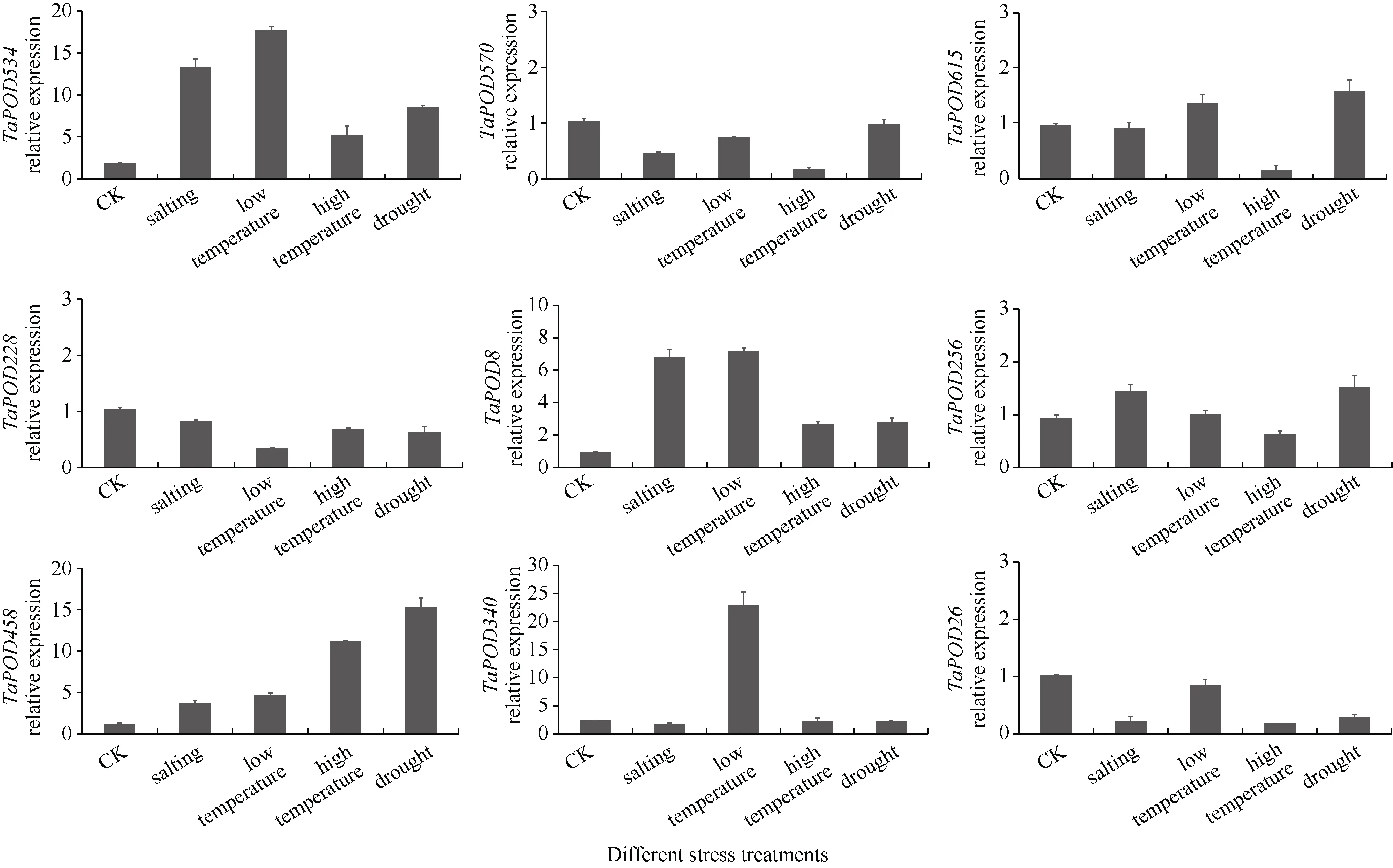
图9 TaPOD 基因家族成员在4 种逆境胁迫下的表达模式分析Fig. 9 Relative expression pattern of TaPOD gene family members under four stresses
3 讨论
POD在植物的生长发育、逆境响应、光合作用等过程有着重要的调控作用。目前,POD已经在拟南芥[23]、水稻[24]、玉米[25]、稷[26]、毛果杨[27]、葡萄[28]中进行了广泛的研究, 本研究在小麦全基因组中共鉴定了 659 个TaPOD家族成员, 在所有染色体上均鉴定到TaPOD基因(包括Un 染色体)。其中, 2 号染色体上TaPOD基因较多,而4 号、5 号、6 号染色体上较少, 说明基因在进化过程中存在不均匀分布的现象。共线性分析发现, 在小麦的21条染色体中都存在TaPOD基因的串联重复现象以及片段重复现象, 并且两者的数量都较大, 这是TaPOD基因家族扩张的主要途径[27]。TaPOD基因重复事件的Ka/Ks分析,发现其中有4 组重复事件的比值大于1, 说明存在自然的正向选择, 这可能是TaPOD进化较快的主要表现途径[28]。其他的比值都小于1 表现为纯化选择, 这和大多数基因家族情况一致[29-30]。在我们鉴定到的659 个TaPOD基因中包含了I 类26 个成员, II 类23 个成员, III 类610 个成员, 而在拟南芥中鉴定到73 个III 类POD成员[31], 在水稻中鉴定到138 个成员[24], 在玉米中鉴定到119 个成员[25], 小麦(六倍体)中存在如此大量的POD家族成员远超过其他物种(二倍体), 可能是由于多种重复事件而造成的, 这些重复与基因组的大小并无直接的联系, 同时基因的进化也会造成基因结构上的不同。
TaPOD基因结构存在差异, 系统发育树中不同分组间的基因结构差异更大, 这些结构上的差异可能是造成功能差异的主要原因。分析鉴定出的5 个保守基序发现,不同进化分支上的TaPOD 蛋白中的motif 组成存在差异,这也可能会导致不同TaPOD家族成员功能上的差异。另外, 进化树VI、VII 分支的基因结构与其他组的结构差异较大, 外显子数量明显较多, 这与番茄中鉴定到的POD基因结构相似[31], 推测属于I 类POD。其他的分组里面基因结构也都较为保守, 含有1~4 个外显子, 与胡萝卜中鉴定到的POD基因结构近似[32]。这说明POD在进化过程中基因结构较为保守, 推测这些POD功能可能也是相似的[33]。同时, 基因UTR 区域结构的不同可能也会造成功能上的变化, 这需要我们进一步去探究。
通过对小麦TaPOD基因启动子区域的顺式作用元件分析, 发现数量最多的是参与光反应的作用元件, 也包含大量生物和非生物胁迫相关的调节元件, 这与程灵彤等人的研究结果一致[34]。也有研究指出玉米POD家族成员具有与激素、干旱和低温响应有关的MBS、P-box、SpI、AE-box 顺式作用元件[35]。本研究结果表明, 659 个TaPOD家族成员中, 包含元件数量最多的成员(TaPOD299)有23个, 最少成员(TaPOD22、TaPOD24和TaPOD592)只有2个; 其中, 有626 个POD成员含有G-box 结合元件, 有386 个POD成员含有CAT-box 元件, 这些元件主要参与小麦生长发育的调控。此外这些成员还有与根、胚乳、细胞分生组织特异性表达有关的元件, 以及在水稻干旱胁迫中发挥作用的ABRE 顺式元件[36]。由此推测, 不同的顺式作用元件可能反映了潜在的功能变异, 而元件的不同对转录水平的基因表达起到决定作用[34]。
基因在RNA 水平的表达往往是影响生物表型的重要因素。根据基因在不同组织中的表达水平分析可知, 在根系中表达量最高的成员TaPOD237其注释属于根系POD主要在根系表达, 可能与大多数POD基因相同, 对植物根系的伸长生长以及根系的保护防御有重要意义, 同时也可能在根毛的发育中起重要作用[37]; 叶片和籽粒中表达最高的成员TaPOD630属于PODP7亚家族, 在叶片的伸长区和表皮中表达较为突出, 可能参与叶片细胞壁的扩张, 同时也可能在植物的防御机制中有重要作用, 具有抗真菌病害的功能[38]; 在3 个组织中表达量都较高的成员TaPOD163、TaPOD228属于抗坏血酸过氧化物酶, 有研究显示其具有H2O2体内平衡、叶绿体保护、植物结构维持的功能[39], 还可以作为分子伴侣的存在, 同时可能对糖信号有一定的影响作用[40]。同时从整体来看小麦中TaPOD基因主要在根部表达, 这可能是因为POD 是木质素大分子合成酶的最后一步[41], 而根系在生长过程中需要通过大量的木质化来强化其耐磨损性[42]。籽粒和叶片中表达量较少, 则可能是生育后期活性不高或是这些基因在根和叶中有不同的功能导致的[43]。同时, 植物的生长发育会受到植物激素的精确调控。在本试验条件下,TaPOD228对于4 种激素响应均不明显, 这可能是由于其属于抗坏血酸过氧化物酶, 与植物中的抗坏血酸含量的关系较为密切, 且参与抗坏血酸循环[44]。而除TaPOD26以外, 其他POD基因在赤霉素处理下有明显上调, 这可能与其启动子序列含有P-box、GARE-motif 等与赤霉素相关的启动子元件有关。这9 个基因表现出了对于4 种激素不同的反应,TaPOD340对生长素响应最明显, 可能与其中含有AuxRR-core 生长素响应元件有关, 有研究显示该启动子顺式作用元件对于生长素反应必不可少[45]。TaPOD8在赤霉素处理下显著上调,TaPOD458和TaPOD26响应玉米素处理, 这表明不同的TaPOD基因对于激素的响应模式或是信号通路存在差异。
植物的生命周期内会受到各种非生物胁迫的影响,例如盐、低温、高温、干旱[46]。本试验结果表明,TaPOD534、TaPOD8和TaPOD458在4 种逆境条件下的相对表达量均有所提高, 同时其中含有LTR、MBS 等与干旱和温度有关的启动子元件, 推测这3 个POD基因参与了多种逆境调控, 这与大多数前人的研究结果相符[47-48]。TaPOD570、TaPOD228、TaPOD26基因在逆境胁迫下其表达量呈下调的状态, 推测这3 个基因可能主要在植物的生长发育中发挥作用。这之中TaPOD458、TaPOD340在盐胁迫和低温胁迫下上调倍数较大可能与其含有 DRE core 启动子顺式作用元件有关[49]。另有研究显示,OsAPX2由盐胁迫诱导, 从而使转基因拟南芥表现出更高的耐盐性[50]。本研究中发现TaPOD534、TaPOD8在盐胁迫下有明显上调, 但是在启动子顺式作用元件的预测中没有发现与盐胁迫有关的启动子作用元件, 可能说明其在盐胁迫条件下通过其他途径发挥他们相关的作用, 有待进一步研究。不同POD成员在这4 种胁迫下各有不同的表现,表明TaPOD成员间在响应胁迫方面有不同的生理功能,这也与多数研究结果一致[43]。值得注意的是, 脱落酸与干旱和盐胁迫有重要关系, 且外源性的ABA 处理可以诱导多种干旱胁迫响应基因[43,51-52], 这与本试验结论有所不同, 推测可能是不同物种之间存在差异或是处理条件不同造成的, 有待进一步研究。
附表请见网络版: 1) 本刊网站http://zwxb.chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3) 万方数据http://c.wanfangdata.com.cn/Periodicalzuowxb.aspx。

