驱动基因阳性肺癌外周血EGFR甲基化及临床意义
刘 东 李 真 王保庆 王自全 王丙武 李庆妍
肺癌是男性和女性癌症死亡的主要原因,占全球所有癌症死亡人数的1/3,中国肺癌发生率和病死率也是居高不下。非小细胞肺癌(non small-cell lung cancer, NSCLC)占肺癌病例的80%以上,其5年生存率低至约18%[1]。而肺癌病死率和预后差的主要原因与肺癌发生的生物学机制有关,且个体差异较大。EGFR突变是非小细胞肺癌发生的驱动基因之一,IPASS研究表明针对EGFR驱动基因阳性肺癌的患者使用吉非替尼,总体治疗有效率可达71.2%,但仍有部分患者无效,可能与合并其他基因突变、扩增和其他未知机制有关,表明了肺癌靶向治疗的异质性[2]。
近年来不涉及DNA序列的表观遗传学改变,参与了肺癌的发生、发展,成为肺癌研究热点[3]。有研究表明EGFR蛋白低表达合并EGFR高甲基化的非小细胞肺癌患者对EGFR靶向治疗不敏感[4,5]。但EGFR驱动基因阳性肺癌的发生是否合并EGFR启动子CpG岛甲基化状态目前存在争议,且与肺癌发生、发展相关的差异性甲基化CpG位点的研究目前尚未见报道[6~8]。MALDI-TOF MS技术是近年来的新兴的甲基化检测技术,可实现DNA甲基化的定性、定量、定位分析,本研究利用MALDI-TOF MS技术检测EGFR驱动基因阳性肺癌患者的EGFR基因CpG岛内甲基化位点状态,筛选肺癌发生的差异性甲基化CpG位点,探讨其与临床病理特征、EGFR突变亚型之间的关系,为驱动基因阳性肺癌发病机制、预后预测及靶向治疗提供新的理论依据。
材料与方法
1.材料:随机收集徐州医科大学第二附属医院2021年1月~2022年11月收治的32例肺腺癌患者,均经肺穿刺活检或手术切除,病理证实均为肺腺癌,EGFR 19del患者17例,EGFR 21 L858R患者15例,3个月内未经放化疗。其中男性14例,女性18例,患者年龄范围51~82岁,中位年龄63岁。以24例正常体检健康人群作为正常对照组,肺癌患者及正常对照组均空腹采集外周静脉血3ml,-80℃冰箱保存备用。本课题实施前所有研究对象均知晓并签署知情同意书,并经徐州医科大学第二附属医院医学伦理学委员会批准后实施{伦理学审批号:[2020]121301}。
2.外周血DNA提取:采集肺癌患者及正常体检人群外周血,运用DNA提取试剂盒(BioTeKe Corpration)提取DNA,具体操作严格按照试剂盒操作说明。运用Nanodrop ND-1000紫外分光光度仪检测DNA浓度和纯度进行质量鉴定,确保纯度(A260/A280)为1.5~2.2,浓度>50ng/μl,-80℃冰箱保存备用。
3.EGFR基因甲基化引物设计:查询EGFR基因序列,位于7号染色体,位置:55014017~55020016(数据来源:NCBI,GRCh38.p13版本),选择距离转录起始位点-5000bp~1000bp范围为靶向区域进行引物设计,利用CpG岛在线预测网站,预测序列潜在的CpG岛,发现1个CpG岛。采用Agena EpiDesigner程序对靶向序列进行引物方案设计。综上因素评估,选择#29和#30引物进行扩增,详见图1,具体引物信息详见表1。

表1 EGFR#29、EGFR#30PCR扩增引物信息

图1 EGFR基因CpG岛靶向区域引物设计
3.MALDI-TOF MS技术进行DNA甲基化定量检测分析:MALDI-TOF MS技术基于MassARRAY系统平台,是一种新型高通量甲基化定量检测方法,可完成特定位置甲基化位点的定量、定性、定位的高通量甲基化检测。提取后达标的DNA严格按照EZ-96 DNA甲基化试剂盒(Zymo Research)亚硫酸氢盐处理流程和美国Sequenom公司的推荐方式操作。经PCR扩增,虾碱性磷酸酶处理PCR扩增产物(SAP)、体外转录及T裂解、树脂样本纯化,由MassARRAY Nanodispenser 点样机(美国Agena公司)进行384-well SpectroCHIP®bioarray芯片(美国Agena公司)点样,Massy array质谱仪(美国Agena公司)进行质谱检测得出质谱图,最后经MassARRAY EpiTYPERTM软件(美国Agena公司)分析质谱图从而得出所检测基因具体CpG位点的甲基化数据,具体检测步骤严格按照制造商的说明操作。
图2 EGFR#29、EGFR#30PCR扩增产物琼脂糖凝胶电泳图
4.统计学方法:应用GraphPad 8.0及SPSS 20.0统计学软件对数据进行统计分析。GraphPad 8.0绘制肺癌患者及正常对照组外周血中EGFR位点甲基化比较直方图;EGFR甲基化位点在肺癌与正常对照组之间的比较采用Mann-WhitneyU检验分析;EGFR甲基化与临床资料、EGFR突变亚型组间或多组间的比较采用Mann-Whitney检验和Kruskal-Wallis检验分析,以P<0.05为差异有统计学意义。
结 果
1.DNA质量鉴定结果及EGFR甲基化PCR扩增结果:对肺癌及正常对照组外周血提取DNA运用琼脂糖凝胶电泳进行完整性检测。浓度和纯度达标的DNA用于亚硫酸氢盐修饰,PCR扩增产物经琼脂糖凝胶电泳,在目的区域出现扩增片段详见图2。
2.EpiTYPER 软件甲基化分析结果:运用EpiTYPER甲基化分析软件分析样本质谱图,显示EGFR#29扩增子包含20个CpG位点,T裂解为15个CpG单位,包含20个CpG位点,覆盖率为100%(20/20)。EGFR#30扩增子中包含47个CpG位点,T裂解为23个CpG单位,其中2个单位(包含8个CpG位点)即CpG_30.31.32.33和CpG_34.35.36.37不可被分析,因此21个CpG单位可分析,实际包含39个CpG位点,覆盖率达83.0%(39/47)。EGFR#29和EGFR#30部分位点甲基化水平详见图3。
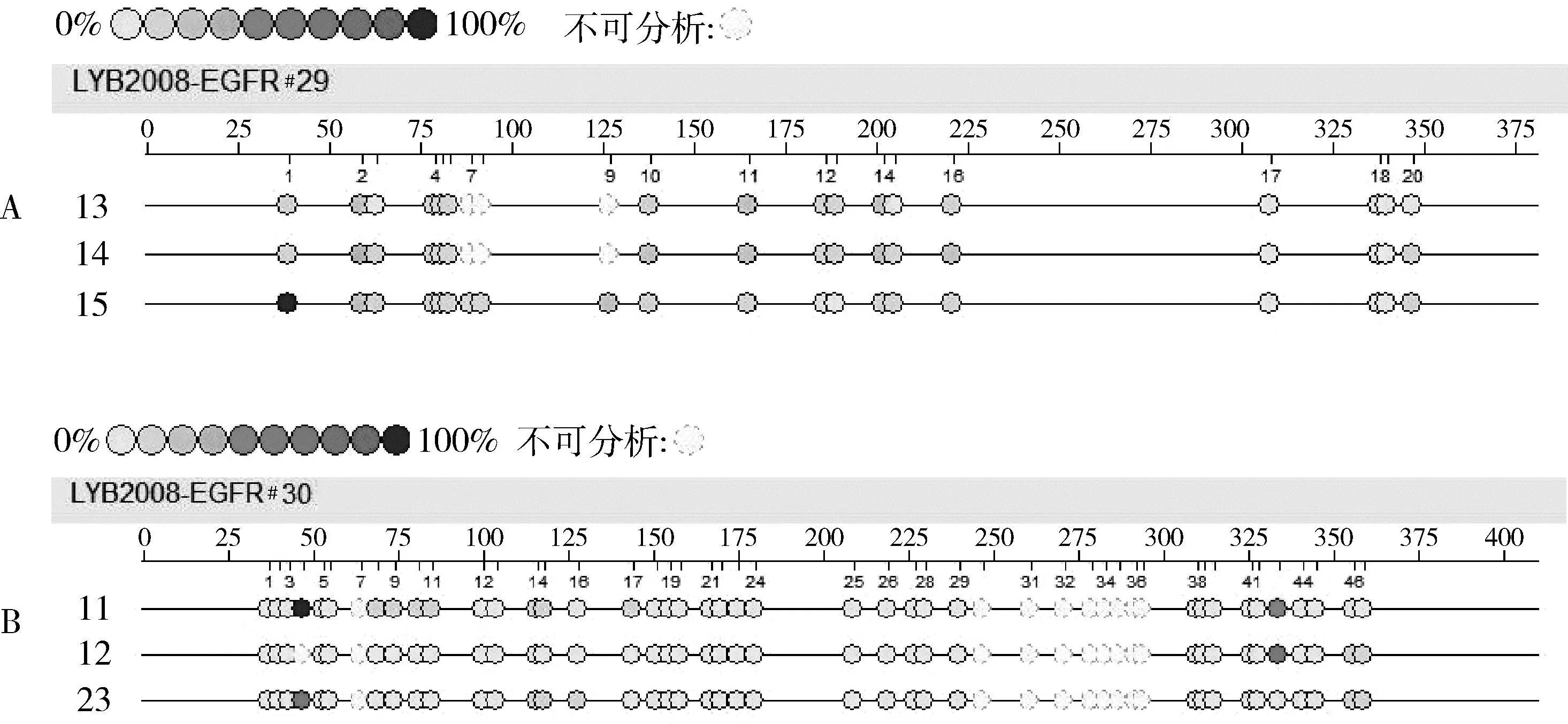
图3 EGFR#29(A)、EGFR#30(B) CpG位点甲基化情况
3.EGFR甲基化在肺癌与正常对照组中平均甲基化率对比:比较肺癌及正常对照患者外周血中EGFR CpG位点甲基化差异,详见图4。EGFR#29 15个CpG位点中除了4个位点CpG_3、CpG_7、8,CpG_10,CpG_20,11个CpG位点在肺癌组中甲基化率均低于正常对照组,其中EGFR#29 CpG_2在肺癌平均甲基化率(25.7%±2.1%)低于正常对照组(36.5%±4.6%),差异有统计学意义(P<0.05)。而EGFR#30 21个可分析CpG单位中有11个在肺癌组中甲基化率均低于正常对照组,其中CpG_8.9.10.11、CpG_25、CpG_40.41.42在肺癌组中甲基化率(4.6%±0.4%、2.8%±0.7%、4.4%±0.4%)低于正常对照组(6.0%±0.6%、4.8%±0.9%、7.1%±0.4%),差异有统计学意义(P<0.05)。
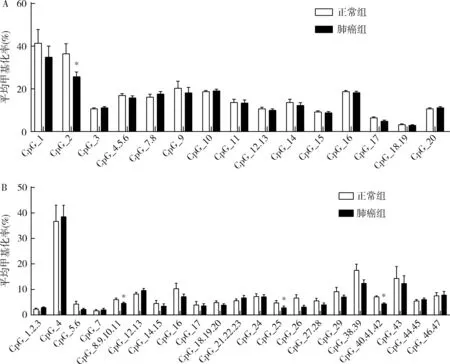
图4 肺癌患者及正常对照组外周血中EGFR#29(A)、EGFR#30(B)CpG平均甲基化率比较Mann-Whitney U检验分析与正常组比较,*P<0.05
4.EGFR甲基化与肺癌患者临床病理特征、EGFR突变亚型的关系:本研究将EGFR差异性甲基化CpG单位与肺癌临床特征等进行相关性分析,详见表2。结果发现EGFR#29 CpG_2,EGFR#30 CpG_8.9.10.11、CpG_25、CpG_40.41.42甲基化与肺癌患者患者年龄、分化程度、发病位置、TNM分期均无相关性(P>0.05)。在性别比较中发现,4个CpG位点在女性肺癌组较男性呈低甲基化状态,其中EGFR#30 CpG_2在性别组中比较,差异有统计学意义(P<0.05)。在吸烟史对比中,2个CpG位点CpG_8.9.10.11、CpG_25、CpG_40.41.42在吸烟组肺癌患者中呈甲基化率升高趋势,其中CpG_25在两组中的甲基化差异有统计学意义(P<0.05)。而EGFR#30 CpG_8.9.10.11在淋巴结转移组中甲基化水平要低于无淋巴结转移组(P<0.01)。在EGFR甲基化与EGFR突变类型的相关性分析研究中,4个CpG位点在EGFR 19del和21 L858突变组中的甲基化比较,差异无统计学意义(P>0.05)。
表2 EGFR 差异性甲基化CpG单位与肺癌临床病理特征、EGFR突变亚型的关系
讨 论
肺癌的发生、发展是一个多因素参与的过程,可能包括环境因素、遗传学和表观遗传学共同作用的结果。而肺癌的异质性在一定程度上决定了肺癌患者的治疗疗效和预后[9]。随着基因检测技术的进步,肺癌中EGFR 驱动基因的发现,针对EGFR靶点的精准治疗使得非小细胞肺癌治疗有效率明显提高,提高了患者生存期[10]。EGFR 酪氨酸激酶抑制剂奥希替尼的应用目前已成为 EGFR突变的晚期或可切除NSCLC患者的标准治疗方法,但即使这样,仍然有部分患者治疗无效,预后差,推测可能合并其他突变或新的机制。不涉及DNA序列变化的表观遗传学改变,近年来成为肺癌研究的热点,且与肺癌的发生、发展有关[11~16]。而目前关于EGFR驱动基因阳性是否合并表观遗传学的改变,国内外也进行了一系列探讨,但目前仍存在争议[6~8]。
MALDI-TOF MS技术可检测全基因组甲基化水平和特定CpG位点的甲基化,实现了甲基化定性、定量及定位的检测。它比亚硫酸氢盐测序PCR能更有效地反映低甲基化区域的真实甲基化水平,可以检测到低至5%的甲基化水平[17]。因此,课题组利用MALDI-TOF MS技术检测驱动基因阳性肺癌患者及正常对照组外周血中EGFR基因甲基化状态。研究选取了EGFR基因CpG岛的两个扩增区域,检测后发现EGFR基因在驱动基因肺癌患者较正常健康对照组中存在差异,且在肺癌中呈现广泛低甲基化状态,这与既往的研究一致,并筛选出4个差异性甲基化CpG单位EGFR#29 CpG_2,EGFR#30 CpG_8.9.10.11、CpG_25、CpG_40.41.42[7,8]。推测在EGFR驱动基因阳性肺癌发生机制中,DNA低甲基化可能使得原癌基因EGFR激活参与肺癌的发生,且EGFR突变合并EGFR低甲基化改变可能在局晚期及晚期肺癌发生中存在协同效应。
Hu等[18]研究表明,在大多数肺腺癌早期癌症进展期,DNA遗传学改变以及DNA甲基化的变化也可能同时发生。但EGFR突变与EGFR甲基化在肺腺癌进展演变过程中存在何种协同表达模式,目前仍无定论。而强少盈等[6]研究出现相反的结果,发现在EGFR-TKI敏感突变的11例肺癌患者中未见检测到甲基化,而在无EGFR-TKI敏感突变的29例肺癌患者甲基化率为34.5%,究其原因可能与甲基化检测的方法不同有关。探讨差异性甲基化CpG位点与EGFR驱动基因阳性肺癌患者临床特征的相关性,结果发现EGFR甲基化与肺癌患者患者年龄、分化程度、发病位置、TNM分期均无明显相关性。而EGFR 4个CpG单位在女性肺癌患者中呈现更低的甲基化,其中EGFR#30 CpG_25的差异更明显。EGFR4个CpG单位中有3个在吸烟组肺癌患者中呈甲基化率升高趋势,其中CpG_25甲基化差异更为明显,推测长期吸烟的患者可能使得EGFR CpG位点发生甲基化改变,这与既往的研究结果大致一致,细胞长期暴露于香烟烟雾会导致进行性表观遗传变化参与肺癌的发生,并已筛选出部分与肺癌患者吸烟相关的甲基化CpG位点作为肺癌发生风险的预测因子,但这与Li得出的研究结果不同,究其原因可能与检测方法及CpG岛扩增区域不同有关[19~21]。
在淋巴转移比较中发现,EGFR#30 CpG_8.9.10.11在淋巴结转移组中的甲基化水平要明显低于无淋巴结转移组,提示出现EGFR#30 CpG_8.9.10.11低甲基化的肺癌患者更容易出现淋巴结转移,并可能作为预后预测的分子标志物。作为一种重要的化学修饰,DNA甲基化状态可能和染色体不稳定性增加以及癌症突变率有关[18,19]。有研究表明,DAPL1基因的高甲基化可能与非小细胞肺癌19外显子缺失突变亚型有关。而EGFR CpG位点甲基化与EGFR突变亚型是否存在相关性未见报道。本研究也进行了探讨,发现在EGFR 19del和21 L858突变组中EGFR位点存在不同程度的甲基化,但差异无统计学意义。
本研究通过MALDI-TOF MS技术检测驱动基因阳性肺腺癌患者及正常人群外周血中EGFR CpG岛甲基化状态,发现肺腺癌患者在发生EGFR突变的同时合并了EGFR的低甲基化改变,推测EGFR低甲基化改变与EGFR突变在晚期肺癌发生中可能存在协同效应,并筛选出与驱动基因阳性肺癌患者发生显著相关的差异性甲基化CpG位点,因此,通过肺癌患者外周血检测可能作为肺癌诊断的生物学标志物。同时本研究还筛选出与性别、吸烟以及淋巴结转移有关的CpG位点,可能作为肺癌患者发生、发展及预后预测的重要分子标志物。限于样本量较少,结果可能存在一定局限性,仍需扩大样本量进一步研究,而精准筛选与EGFR表达密切相关的差异性甲基化CpG位点也是课题组后续的研究方向。DNA甲基化是可逆的过程,针对驱动基因阳性肺癌发生、发展相关的特异性甲基化CpG位点进行去甲基化药物干预,可能为肺癌的靶向治疗和联合治疗提供了新的思路。

