驱动蛋白家族成员15(KIF15)对肝细胞癌增殖能力的影响及其作用机制
仇建南, 汪 鹏, 曹 胤, 王忠夏, 吴俊华, 江春平
1 南京大学医学院附属鼓楼医院肝胆外科, 南京 210008
2 南京大学医学院基础医学部, 南京 210093
肝细胞癌(HCC)是人类最常见的恶性肿瘤之一,在世界范围内的发病率不断上升。尽管肝部分切除术和肝移植术是目前主要的治疗手段,但是很多患者确诊时已经丧失了手术机会,预后较差。虽然HCC的治疗已经取得一些新的进展,比如靶向药物治疗、免疫治疗等[1-2]。但是HCC发生发展的机制仍然需要进一步深入探究。
驱动蛋白家族成员15(KIF15)具有四聚体纺锤马达结构,其马达结构域结构以ATP样构型,颈部接头与催化核心对接;通过水解ATP 为多种物质的运输提供能量[3-4]。KIF15 在肿瘤中的作用被广泛报道,例如KIF15通过激活Raf/MEK/ERK 通路促进非小细胞肺癌的恶性进展[5];KIF15上调促进泛素特异性蛋白酶15(USP15)介导的DEK 去泛素化导致平滑肌肉瘤细胞生长[6];KIF15通过抑制活性氧介导的细胞凋亡促进胃癌进展[7]。目前,KIF15 在HCC 中的作用尚不确切,因此本研究旨在探究KIF15在HCC中的潜在作用机制,为HCC的治疗提供新思路。
1 材料与方法
1.1 细胞株和主要试剂 人正常肝细胞L02,人HCC细胞株HepG2、LM3、MHCC-97H 和Hep3B(中国科学院细胞库);KIF15过表达慢病毒(LV-KIF15)和对应的阴性对照(vector),KIF15 敲低慢病毒(sh-KIF15)和对应的阴性对照(shNC)及相应的转染试剂HiTransG A/P(上海吉凯生物有限公司);Trizol 试剂(美国Thermo Fisher 公司);逆转录试剂盒和SYBR Green PCR Master Mix 检测试剂盒与CCK8 试剂(诺唯赞生物科技有限公司);抑制剂LY294002(MCE 公司);EDU 试剂盒(锐博生物有限公司);Western Blot 试剂盒(碧云天有限公司)。本研究中抗体包括KIF15、GAPDH、p-PI3K(Tyr458)、PI3K、AKT、p-AKT(Ser473)、mTOR、p-mTOR(Ser2448)。DMEM培养基、胎牛血清(美国Gibco 公司);胰蛋白酶(新赛美公司);青链霉素双抗(上海翊圣生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 使用DMEM(含10%的胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素)培养人HCC 细胞株HepG2、LM3、MHCC-97H、Hep3B 和正常肝细胞L02,放于37 °C 含5% CO2的加湿培养箱中培养。每2天换液1次,当细胞生长汇合率超过85%时,胰蛋白酶消化后分皿传代培养。
1.2.2 慢病毒转染 将Hep3B 和HepG2 培养至状态良好,按每孔100 万接种于6 孔板中,进行慢病毒转染。Hep3B 转染针对KIF15 的干扰慢病毒LV-shKIF15(sh1、sh2 和sh3)以及对照(sh-NC);HepG2 转染编码KIF15 的慢病毒载体(LV-KIF15)以及对照(vector)。使用吉凯公司助转染试剂提高转染效率。培养2天后用含嘌呤霉素(2.5 μg/mL)的DMEM筛选培养。
1.2.3 qRT-PCR 实验 将相应的HCC 细胞培养至状态良好后收集,采用Trizol 试剂提取细胞的总RNA,然后合成cDNA的反应混合物为20 μL/孔,由1 μg总RNA和4 μL 5×HiScript ⅡqRT SuperMix 及无RNase 的ddH2O 组成。qRT-PCR 的反应体系为:1 μL cDNA、5 μL 2×SYBR Green qPCR Master Mix、0.2 μL 上游引物、0.2 μL 下游引物和3.6 μL DEPC 水。设定程序:95 ℃、10 min;95 ℃、15 s, 60 ℃、30 s,72 ℃、10 s,40 个循环。KIF15 mRNA 的相对表达量按2-ΔΔCt法计算。
1.2.4 CCK-8 实验 将稳定转染的HCC 细胞种在96 孔板(500个细胞/孔)中,分别于第1、2、3、4、5天相同时间,在每个孔加入CCK-8 溶液(10 μL/孔),在培养箱中孵育2 h后,使用酶标仪测量每孔在450 nm处的吸光度(OD)值。
1.2.5 平板克隆实验 将培养的相应的HCC细胞按每孔500 个/2 mL 培养基密度接种于6 孔板中,连续培养14 天,弃掉培养基,PBS 洗涤后用4%多聚甲醛固定细胞10 min,弃掉多聚甲醛后每个孔加入2 mL 结晶紫染液,避光染色30 min 后,PBS 洗涤,等待自然干燥后,肉眼计数克隆形成的数目。
1.2.6 EdU 实验 将稳定转染的细胞株接种于96 孔板(2×104个细胞/孔)中,用DMEM 培养1天。然后,在37 ℃下用50 μmol/L 的EdU 孵育2 h。再用4%的甲醛溶液固定细胞30 min,然后用0.5%的TritonX-100 渗透细胞株10 min。加入400 μL 1×ApolloR 反应物,再加入400 μL Hoechest33342,PBS 冲洗3 次后观察EdU 阳性细胞。最后通过显微镜拍摄细胞的图像。
1.2.7 Western Blot实验 收集Hep3B和HepG2细胞,加入包含PMSF和磷酸酶蛋白酶抑制剂的RIPA裂解液裂解细胞30 min。收集蛋白样品并检测其浓度。取30 μg 蛋白样品进行SDS-PAGE(10%)凝胶电泳75 min,继而进行转膜。使用Western Blot 快速封闭液室温孵育30 min。将条带置于相应一抗(1∶1 000)中4 ℃摇床上孵育过夜。第二天用TBST洗膜3次,每次10 min。然后将条带置于特异性二抗(1∶2 000)室温孵育2 h后,再次TBST洗膜3次,每次10 min。天能凝胶成像仪显影蛋白条带。Image J软件分析各蛋白条带的灰度值。
1.2.8 动物实验 将稳定转染的sh-NC/sh3 Hep3B 细胞培养至状态良好,按1×106个细胞/100 μL PBS 的密度重悬,接种于4 周龄雌性BALB/c 裸鼠的皮下,每组3 只裸鼠,皮下注射肿瘤细胞。28 天后摘下皮下瘤,计算肿瘤体积与肿瘤重量。将瘤块石蜡包埋、切片和脱蜡,分别进行Ki67 和TUNEL 染色。实验鼠购自扬州大学比较医学中心,实验动物生产许可证号:SCXK(苏)2022-0009,实验动物使用许可证号:SYXK(苏)2022-0034。
1.2.9 生物信息学分析 使用TCGA-LIHC 数据集分析KIF15 在HCC 中的表达情况以及表达高低对临床预后的影响。GEPIA 数据库分析KIF15 在HCC 中与肿瘤分期的关系以及对预后的影响。
1.2.10 GSEA分析 为了在TCGA-HCC数据集中研究与KIF15相关的潜在信号途径,故进行GSEA分析。首先,基于与KIF15 表达的相关性,生成TCGA-HCC 的FPKM 转录数据中所有基因的有序列表。然后选择参考基因集“h.all.v6.2.entrez.Gmt”进行分析,最后使用GSEA 软件(v2.10.1)分析KIF15高、低表达组之间的基因富集情况。
1.3 统计学方法 采用SPSS 21.0 软件进行数据统计分析。计量资料以±s表示,两组间比较采用成组t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 KIF15 在HCC 中的相对表达情况和对生存率的影响 通过分析TCGA-LIHC 数据集中KIF15的表达,发现在HCC 癌组织中KIF15 的表达量显著高于正常肝组织(P<0.05)(图1a、b);GEPIA 数据集分析发现,KIF15 与HCC 病理学分期呈正相关(P<0.05)(图1c);qRT-PCR和Western Blot 分析发现KIF15 在HCC 细胞株中表达增高,同时选取表达量最高Hep3B 细胞株和较低的HepG2细胞株做后续探究(P<0.05)(图1d、e,表1)。

表1 Western Blot 检测KIF15蛋白在HCC细胞株中的表达水平Table 1 The protein expression level of KIF15 in HCC cell lines by Western Blot
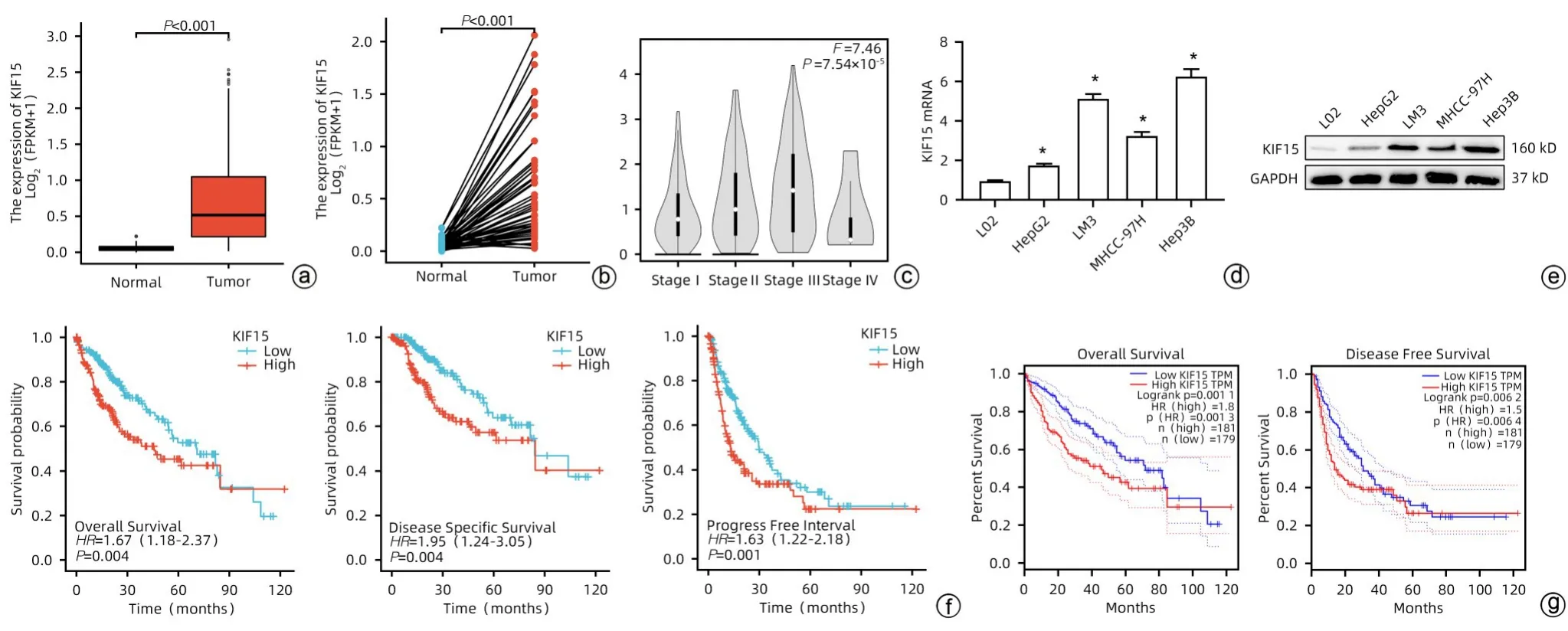
图1 KIF15在HCC中的相对表达情况和对生存率的影响Figure 1 The relative expression of KIF15 in hepatocellular carcinoma and its effect on survival rate
通过分析TCGA-LIHC 数据集中KIF15 与HCC 的生存关系,发现KIF15高表达的患者生存率显著低于KIF15低表达者(P<0.05)(图1f);分析GEPIA 数据集中KIF15与HCC 的生存关系,亦发现KIF15 高表达的患者生存率显著低于KIF15低表达者(P<0.05)(图1g)。综上,KIF15在HCC中表达增高,且高表达患者生存更差。
2.2 KIF15 对HCC 增殖能力的影响 通过转染慢病毒敲低Hep3B 细胞株中KIF15 的表达量,qRT-PCR 和Western Blot实验分析发现sh3慢病毒的敲低效率最高,与sh-NC-Hep3B相比,sh3-Hep3B细胞的KIF15 mRNA(0.17±0.05 vs 0.99±0.03,P<0.001)和蛋白水平(P<0.05)均显著下降(图2a,表2),并选择sh3-Hep3B 细胞用于后续研究。其次,对转染慢病毒过表达HepG2 细胞株中KIF15的表达量,通过qRT-PCR 和Western Blot 实验分析发现,与vector-HepG2 相比,LV-KIF15-HepG2 的KIF15 mRNA水平(11.37±1.17 vs 1.00±0.13,P<0.001)和蛋白水平(6.12±0.23 vs 0.99±0.06,P<0.001)均升高(图2b)。通过CCK-8实验分析发现,与sh-NC-Hep3B相比,sh3-Hep3B的细胞活力受到抑制(0.765±0.104 vs 1.560±0.135,P<0.05)(图2c);而与vector-HepG2 相比,LV-KIF15-HepG2的细胞活力显著增强(1.664±0.133 vs 1.056±0.123,P<0.05)(图2c)。通过GEPIA数据集分析显示,KIF15在HCC中与增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达呈正相关(P<0.05)(图2d),提示KIF15 对于HCC 增殖能力可能存在促进作用。

表2 Western Blot 检测KIF15蛋白在Hep3B中的表达水平Table 2 The protein expression level of KIF15 in Hep3B by Western Blot
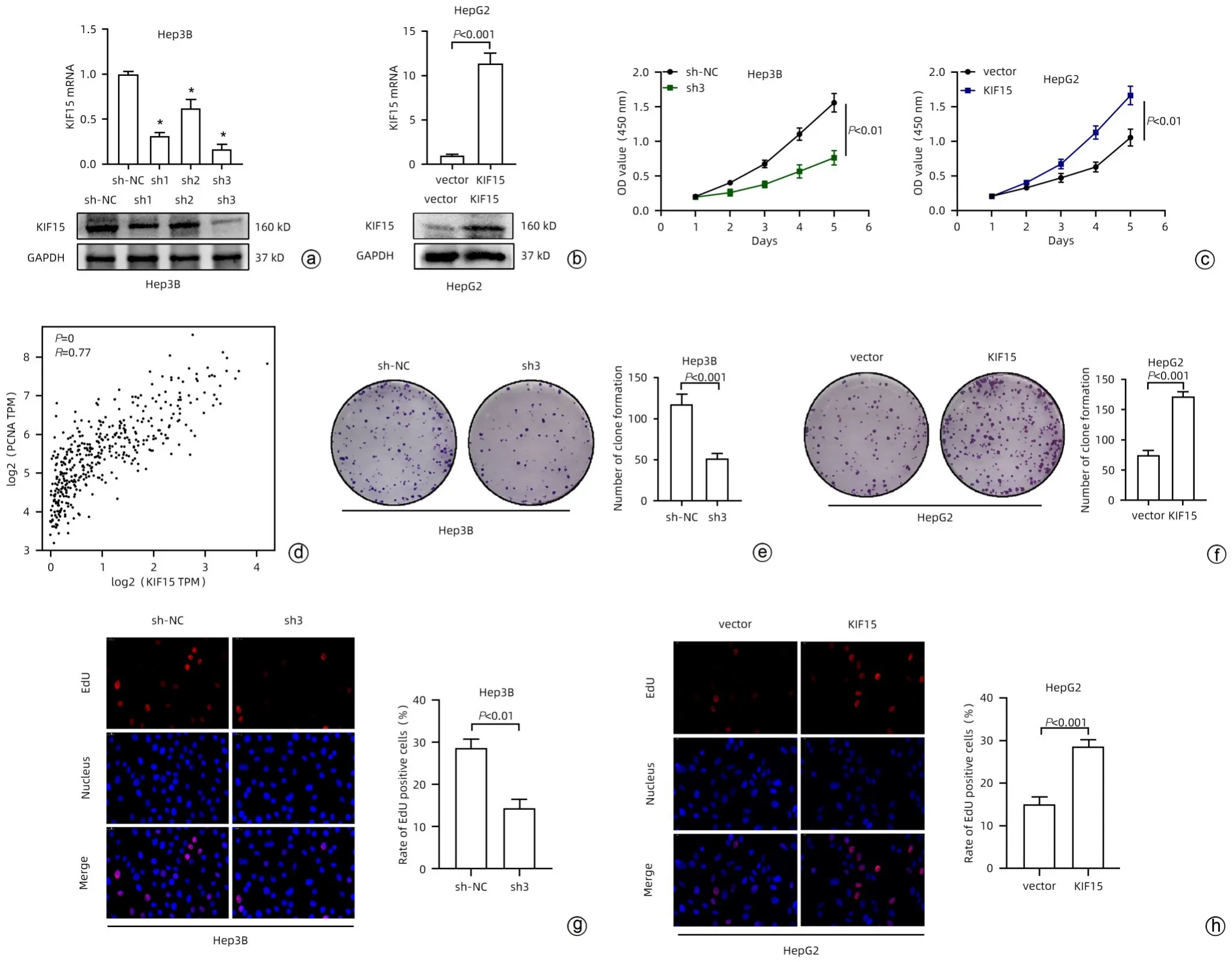
图2 KIF15对HCC增殖能力的影响Figure 2 Effect of KIF15 on proliferation of hepatocellular carcinoma
通过克隆形成实验分析发现,与sh-NC-Hep3B 相比,sh3-Hep3B 的克隆形成数显著减少(51.67±6.03 vs 118.33±11.59,P<0.001)(图2e);而与vector-HepG2 相比,LV-KIF15-HepG2 的克隆形成数显著增多(172.00±7.55 vs 74.67±7.57,P<0.001)(图2f)。同时EdU 染色实验显示,与sh-NC-Hep3B 相比,sh3-Hep3B 的EdU 阳性率显著降低[(14.33±2.08)% vs (28.67±2.08)%,P<0.01](图2g);而与vector-HepG2 相比,LV-KIF15-HepG2 的EdU阳性率显著升高[(28.67±1.53)% vs (15.00±1.73)%,P<0.001](图2h)。综上,KIF15能够促进HCC的增殖能力。
2.3 KIF15 对HCC 体内生长能力的影响 通过构建皮下瘤生长模型,探究KIF15 对于HCC 体内生长的影响。将稳定转染并生长状态良好的Hep3B细胞株(sh-NC/sh3)按照每100 μL中1×106个细胞的数量,接种于裸鼠皮下,造模后皮下瘤瘤体见图3a。研究结果显示,与sh-NCHep3B 细胞相比,sh3-Hep3B 细胞皮下瘤体积[(350.00±100.00)mm3vs (1 046.67±105.03)mm3,P<0.001]和重量[(366.67±110.15)mg vs (1 166.67±76.38)mg,P<0.001]均显著降低(图3b、c)。对皮下瘤进行免疫组化染色发现,sh3-Hep3B 细胞皮下瘤Ki67 的组化评分显著低于转染sh-NC-Hep3B 的皮下瘤(2.33±0.58 vs 7.33±1.15,P<0.01)(图3d);而转染sh3-Hep3B 细胞皮下瘤TUNEL 的组化评分显著高于sh-NC-Hep3B 细胞的皮下瘤(5.33±1.15 vs 1.33±0.58,P<0.01)(图3e),提示敲低KIF15 抑制了Hep3B 皮下瘤的增殖能力,而增强了凋亡水平。综上,敲低KIF15能够抑制HCC的体内生长能力。
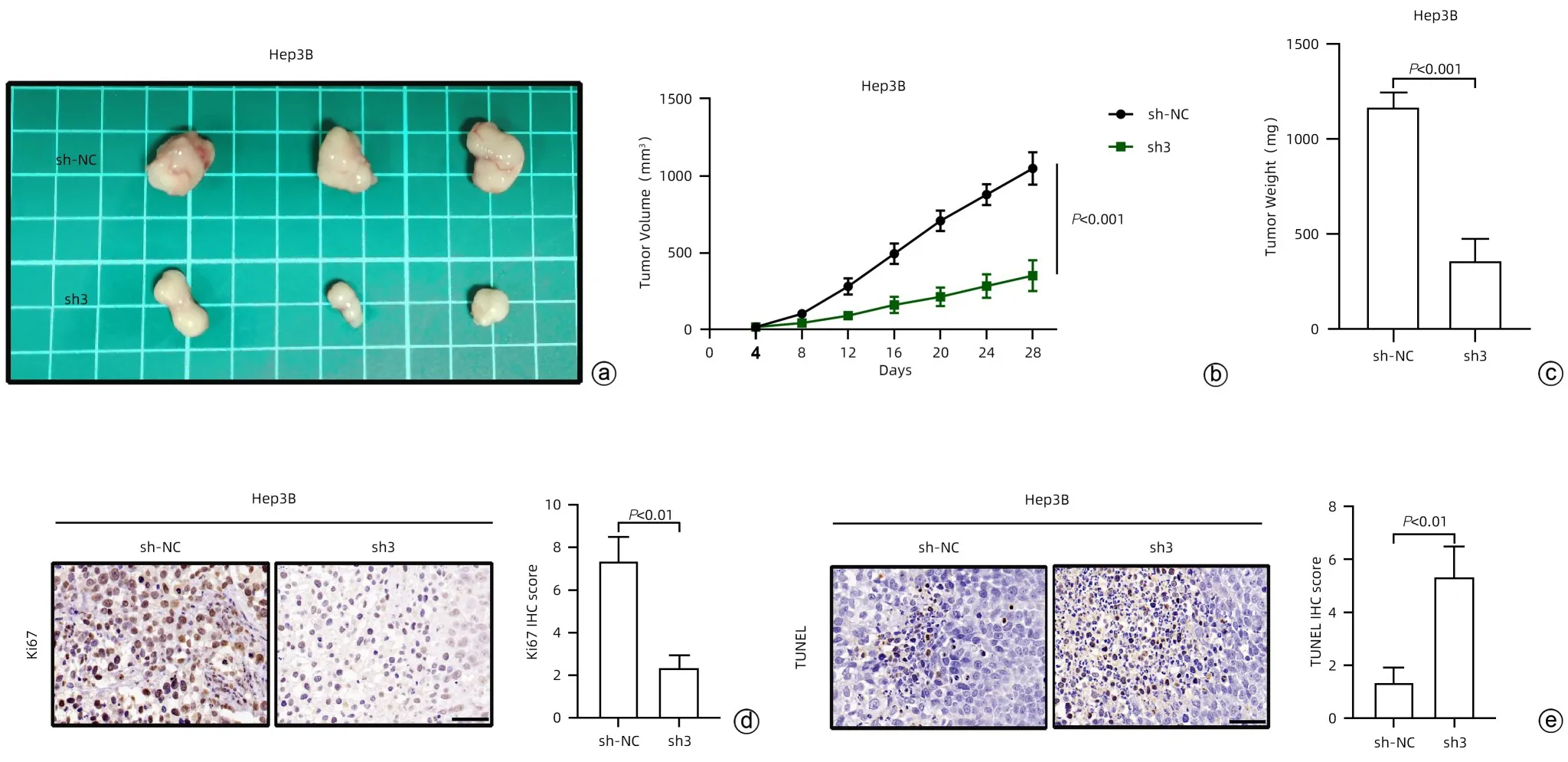
图3 KIF15对HCC体内生长能力的影响Figure 3 Effect of KIF15 on the growth capacity of hepatocellular carcinoma in vivo
2.4 KIF15 对HCC 增殖能力影响的机制 通过GSEA分析KIF15 在HCC 中发挥作用的潜在机制,发现KIF15与PI3K/AKT/mTOR 通路呈正相关(NES=1.59,P<0.001)(图4a)。Western Blot实验结果表明,与sh-NC-Hep3B细胞相比,sh3-Hep3B 细胞中PI3K/AKT/mTOR 信号通路受到显著抑制(P值均<0.001)(图4b,表3);而与vector 组相比,过表达KIF15 能够促进HepG2 细胞的PI3K/AKT/mTOR信号通路显著增强(P值均<0.001)(图4c,表4);此外,PI3K 抑制剂LY294002 能够抑制LV-KIF15-HepG2 细胞中的PI3K/AKT/mTOR信号通路(图4d,表5)。CCK-8实验结果表明,当LY294002抑制PI3K/AKT/mTOR信号通路后,LY294002+LV-KIF15-HepG2 细胞的活力较LV-KIF15-HepG2 细胞明显下降(1.084±0.118 vs 1.670±0.102,P<0.01)(图4e)。平板克隆实验结果显示,相较于LV-KIF15-HepG2 细胞,LY294002 处理后的LV-KIF15-HepG2 细胞的克隆形成能力受到显著抑制(78.33±7.64 vs 161.67±17.56,P<0.01)(图4f)。EdU 染色实验显示,相较于LVKIF15-HepG2 细胞,LY294002 处理后的LV-KIF15-HepG2细胞的EdU阳性率显著降低[(18.61±1.24)% vs (28.54±3.83)%,P<0.05](图4g)。综上,KIF15 通过激活PI3K/AKT/mTOR信号通路促进HCC的增殖能力。

表3 Western Blot 检测Hep3B细胞中相关蛋白表达结果Table 3 Western Blot analysis was performed to determine the expression levels of related proteins in Hep3B cells

表4 Western Blot 检测HepG2细胞中相关蛋白表达结果Table 4 Western Blot analysis was performed to determine the expression levels of related proteins in HepG2 cells
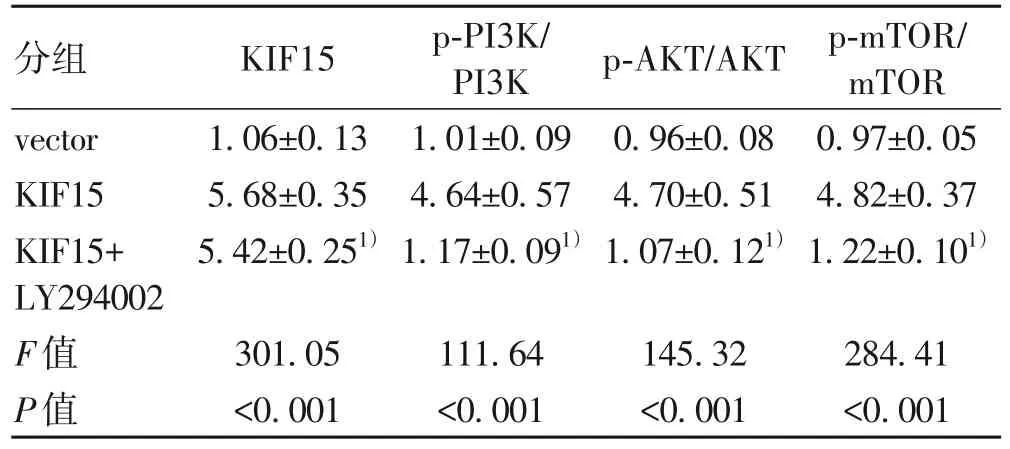
表5 LY294002抑制剂干预对HepG2细胞中相关蛋白表达的影响Table 5 The effect of inhibitor LY294002 intervention on the expression of related proteins in HepG2 cells

图4 KIF15对HCC增殖能力影响的机制探究Figure 4 The mechanism of the effect of KIF15 on the proliferation of hepatocellular carcinoma
3 讨论
肝癌发病率和死亡率位列全球恶性肿瘤第6 位和第4位,预计到2040年全球将有140万肝癌患者,且将有130 万人死于肝癌[8]。目前HCC 的主要治疗方法是手术、介入、化疗和免疫治疗等,但是患者的复发率仍然较高,5年生存率仅约20%[9-11]。因此,探究HCC 发生和发展的机制,对HCC的诊治将提供重要的理论基础。
KIF15,又名kinesin-12,是一种微管相关蛋白,其功能是微管依赖转运或纺锤体组织的调节因子[12-13]。已有大量研究[14-15]揭示了KIF15在多种肿瘤中的作用。在胰腺癌中,KIF15通过招募USP10和磷酸甘油酸激酶1增强胰腺癌细胞的糖酵解能力,从而增强其恶性程度[16];敲低KIF15 后,胶质瘤的增殖能力受到抑制[17];此外,KIF15在鼻咽癌组织中高表达,与鼻咽癌预后不良相关,敲低KIF15 将抑制鼻咽癌细胞株的增殖和倾袭能力[18]。在前列腺癌中,KIF15通过增强前列腺癌细胞的雄激素受体(AR)信号通路来促进恩杂鲁胺耐药;机制上,KIF15直接结合AR/AR-v7的N端,通过增加USP14与AR/AR-v7 的蛋白结合,阻止AR/AR-v7 蛋白的降解[19]。HCC 作为恶性程度较高的常见肿瘤,KIF15对HCC的作用尚不明确。
本研究通过分析TCGA 和GEPIA 数据库发现KIF15在HCC组织中表达显著增高,且KIF15高表达与HCC不良预后相关。通过qRT-PCR 和Western Blot 评估KIF15在HCC 细胞株中的表达水平,选择HepG2 过表达KIF15以及选择Hep3B 敲低KIF15,验证过表达和敲低的效率后进行细胞实验的探究。结果显示,过表达KIF15 导致HCC 细胞株的增殖能力增强,而敲低KIF15 能够抑制HCC 细胞株的增殖;并且敲低KIF15 能够抑制HCC 的体内生长能力。上述结果表明KIF15 在HCC 中发挥促进增殖的促癌作用。
已有大量研究[20-22]报道,PI3K/AKT/mTOR 信号通路在癌症进展中发挥关键作用。TBK1通过激活PI3K/AKT/mTOR信号通路促进甲状腺癌进展[23];UHMK1通过激活PI3K/AKT/mTOR 信号通路促进肺腺癌的发生[24];STK3通过抑制PI3K/AKT/mTOR 通路,降低胰腺癌细胞的增殖能力,并且促进癌细胞的凋亡[25]。本研究通过GSEA 分析发现KIF15 在HCC 中与PI3K/AKT/mTOR 的激活呈正相关。通过Western Blot分析发现,过表达KIF15能够激活HepG2细胞的PI3K/AKT/mTOR 通路,而敲低KIF15导致Hep3B 细胞的PI3K/AKT/mTOR 通路受到抑制。通过进一步实验发现,PI3K 抑制剂LY294002 能够抑制过表达KIF15的HepG2细胞中的PI3K/AKT/mTOR 通路,并且导致细胞的增殖能力受到显著抑制。
综上所述,本研究证实KIF15 通过激活PI3K/AKT/mTOR通路,发挥促进HCC的增殖能力,为KIF15作为肝癌的诊断标志和预后指标提供了理论依据,但是KIF15在HCC中的精确机制仍需深入探究。
伦理学声明:本研究方案于2016 年5 月7 日经由南京大学医学院附属鼓楼医院动物保护与福利委员会批准,批号:2016-057-01,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:仇建南负责实验设计与操作,并撰写论文;汪鹏、曹胤、王忠夏负责数据分析和文章润色;江春平、吴俊华提供课题思路,指导实验内容,审阅最终文稿。

