超重人群中健康者与非酒精性脂肪性肝病患者的临床特征及血清脂质组学分析
陈小燕, 袁乙富, 杜晟楠, 曹 勤, 蒋元烨
上海中医药大学附属普陀医院消化内科, 上海 200062
非酒精性脂肪性肝病(NAFLD)目前已成为一种常见的慢性肝病,被认为是一种以脂质储存和代谢紊乱为特征的疾病。NAFLD与肥胖密切相关,超过60%的肥胖人群患有NAFLD,而在非肥胖人群中,NAFLD 的患病率则较低。研究[1]表明,肥胖是NAFLD 的独立危险因素,与正常体质量相比,肥胖导致NAFLD 的发生风险增加3.5 倍,体质量指数(BMI)与NAFLD 风险之间存在明显的剂量依赖关系。此外,肥胖还会加速NAFLD 的发展,使其更容易进展为肝纤维化、肝硬化和肝癌等严重肝病。肥胖和NAFLD 之间的关系是相互作用的。肥胖患者往往伴随胰岛素抵抗和炎症反应,这些因素都可以促进NAFLD 的发展。而NAFLD 患者中,脂肪酸(FA)释放增加,肝脏中的脂质代谢失调,以上因素也会进一步加重肥胖的发展[2]。但是,对于单纯超重的肥胖患者,其血糖、血压及血脂等代谢功能早期可能并无明显异常[3]。因此,超重NAFLD 患者的临床特征及脂质代谢差异需进一步研究与探讨。
脂质组学是代谢组学研究的一个新的分支,是指对生物样本中脂质分子进行系统性和全面性分析的一种技术。脂质不仅是人体中的能量供给和储存来源,也是构成细胞生物膜的成分,参与许多重要的代谢过程,脂质代谢途径的改变在许多疾病的机制研究,以及预后、诊断中发挥着越来越重要的作用。近年来,基于高通量质谱技术的脂质组学已经成为研究NAFLD 的一种重要方法,通过定量和定性分析细胞、体液、组织中多种脂质代谢产物,例如FA、甘油三酯(TG)、磷脂、胆固醇等,可以更好地理解超重NAFLD 患者的发病机制,并寻找新的治疗方法[4-6]。
1 资料与方法
1.1 研究对象 依据亚太地区的BMI 划分标准[7],将BMI>23 kg/m2定义为超重人群。选取2020 年8 月—2021年4月本院住院部及体检中心经超声诊断为NAFLD且BMI>23 kg/m2的患者作为超重NAFLD 组;另选择同期健康体检者中BMI>23 kg/m2人群作为超重对照组。NAFLD 患者均符合《非酒精性脂肪性肝病防治指南(2018年更新版)》[8]的诊断标准。
纳入标准:年龄≥18 岁;临床信息完整。排除标准:(1)有过量饮酒史或饮酒问卷数据缺失者;先天性肝脏疾病、自身免疫性肝病、药物性肝损伤和酒精性肝病;(2)合并肝外纤维化疾病,包括系统性红斑狼疮、风湿类疾病、肾衰竭、慢性阻塞性肺疾病、糖尿病、高血压病、冠心病等;(3)合并心脑血管、泌尿系统、肾脏、造血系统等原发性疾病;(4)合并甲状腺疾病,包括甲状腺功能亢进、甲状腺功能减退、亚临床甲状腺功能减退、桥本甲状腺炎;(5)恶性肿瘤、其他严重合并症或精神病;(6)孕妇及哺乳期者。
1.2 临床资料收集 所有受试者均完成基本资料/病史资料收集、人体参数测量、血液生化指标检查、肝脏超声检查。计算受试者BMI;采集受试者晨间空腹静脉血样本,进行血常规、肝肾功能、空腹血糖、血脂等实验室生化指标检测,分析仪器为Hitachi 7600d-210 全自动生化分析仪。
1.3 仪器与试剂 UltiMate 3000 超高效液相色谱仪(美国Thermo Fisher 公司);Orbitrap Elite 静电场轨道阱质谱仪(美国Thermo Fisher 公司);冷冻高速离心机(1730R,德国GENE公司)。甲醇(色谱纯,美国Merck公司);乙腈(色谱纯,美国Sigma 公司);其余试剂均为分析纯。
1.4 血清脂质组学样本的前处理 采集受试者晨间空腹静脉血样本,采血后立即放入4 ℃条件下静置2 h,于1 000×g(离心半径7 cm)、4 ℃条件下离心15 min,取上清液分装后保存于-80 ℃冰箱冻存待测。脂质组学分析前,取冷冻血清60 μL,加入1 000 μL 甲基叔丁基醚、300 μL甲醇和290 μL 超纯水,振荡混匀1 min,于1 000×g、4 ℃条件下离心10 min,取上清溶液置于新离心管中冷冻干燥;干燥后的样本中加入100 μL异丙醇-甲醇(体积比1∶1),待样本复溶后在10 000×g、4 ℃条件下离心10 min,取上清液80 μL采用超高效液相色谱-串联质谱法(UPLC-MS/MS)进行分析。
1.5 UPLC-MS/MS 分析 应用超高效液相色谱-静电场轨道阱质谱仪。液相分离使用ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm)液相色谱柱(美国Waters公司)。流动相A 为体积比60∶40的乙腈-水溶液(含有10 mmol/L乙酸铵和0.1%甲酸);流动相B 为体积比50∶50 的乙腈-异丙醇溶液(含有10 mmol/L 乙酸铵和0.1%甲酸);流速0.3 mL/min;进样量2 μL;柱温45 ℃。梯度洗脱程序如下:0 min,30%流动相B;0~2.0 min,30%~43%流动相B;2.0~2.1 min,43%~55%流动相B;2.1~12.0 min,55%~65%流动相B;12.0~18.0 min,65%~85%流动相B;18.0~20.0 min,85%~100%流动相B;20.0~25.0 min,100%流动相B;25.0~25.1 min,100%~30%流动相B;25.1~30.0 min,30%流动相B。
质谱条件:离子源采用电喷雾离子源(ESI),质量分析器为静电场轨道阱。分别在ESI正/负离子模式下采集数据,扫描范围为质荷比50~1 000。正离子模式下,电喷雾电压为3.0 kV,毛细管温度为350 ℃,S-Lens RF Level设置为30%,鞘气压力为45 psi,辅助气流速为5 L/min,尾气流速为0.3 L/min。负离子模式下,电喷雾电压为3.2 kV,毛细管温度为350 ℃,S-Lens RF Level 设置为60%,鞘气压力为45 psi,辅助气流速5 L/min,尾气流速为0.3 L/min。
1.6 统计学方法 采用SPSS 25.0 统计学软件进行数据分析。符合正态分布的计量资料以xˉ±s表示,两组间比较采用成组t检验;不符合正态分布的计量资料以M(P25~P75)表示,两组间比较采用Wilcoxon 秩和检验。计数资料两组间比较采用χ2检验。P<0.05 为差异有统计学意义。
用于脂质组学分析的LC-MS原始数据,通过Xcalibur软件进行采集并进行预处理,包括峰提取、峰对齐、保留时间校正、峰面积校正,随后采用LipidSearch 软件鉴定脂质代谢产物。将鉴定的脂质组学数据导入Simca-P 14.0 软件进行多元统计分析,包括主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)。通过PCA 可以直观地表现出两组之间的差异大小并检查是否存在异常点。脂质成分的组间比较采用GraphPad Prism 9.0软件。
2 结果
2.1 超重NAFLD 组与超重对照组临床资料及生化指标比较 共纳入超重NAFLD 患者62 例(超重NAFLD组),超重健康体检者50 例(超重对照组)。两组一般资料及血液生化指标比较结果显示,年龄、身高、体质量、BMI、RBC、Hb、Hct、尿酸、ALP、TP、Glb、GGT、ChE、ALT、AST、LDL、TC、TG、ApoB、Glu 差异均有统计学意义(P值均<0.05)(表1)。
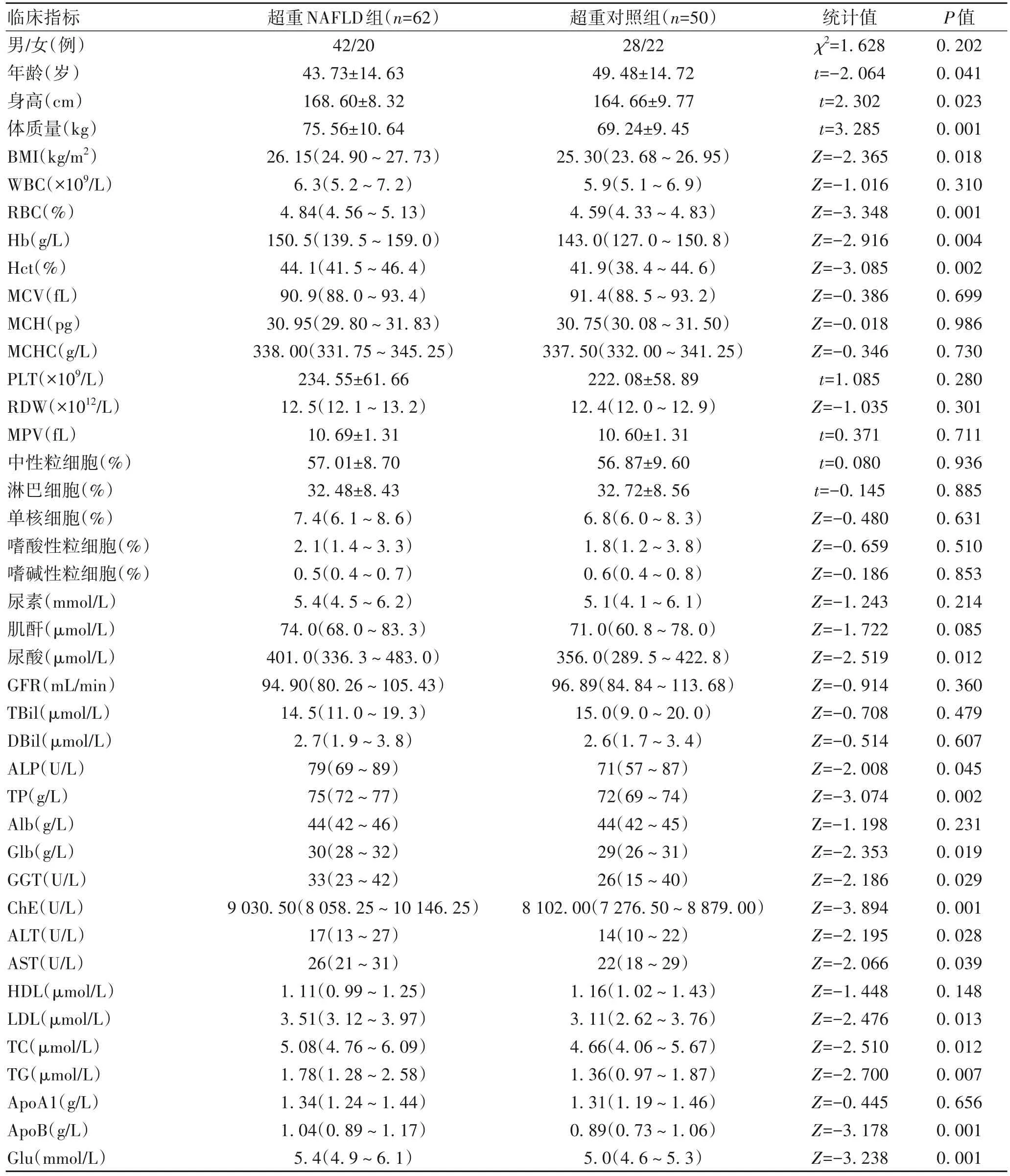
表1 超重NAFLD组与超重对照组一般资料及血液生化指标比较Table 1 Comparison of general data and blood biochemical indexes between NAFLD group and healthy control group in overweight people
2.2 脂质组学多元统计分析 将超重NAFLD 组和超重对照组的血清脂质数据进行PCA,得到基于正离子模式和负离子模式下的脂质PCA 图(图1a、b),结果显示两组之间存在良好的分离,说明超重人群中,NAFLD 患者的脂质谱与健康人相比有明显差异,提示PCA 多元统计拟合模型可靠性良好。
尽管PCA 法可以有效提取主要信息,但两组间的变量差异仍欠明晰。因此,为了探究超重NAFLD组与超重对照组之间具有差异性的主要代谢物,进一步选用有监督模式的OPLS-DA 模型进行拟合。得出的第一主成分的变量投影重要度(variable importance in the projection,VIP)可量化每个化合物贡献的大小。选择VIP 值>1 的变量,并将所选的变量进行Student’st检验(P<0.05),同时满足P<0.05且VIP值>1的变量即为与NAFLD疾病相关的潜在生物标志物(图1c、d)。
2.3 NAFLD 患者的血清脂质变化 基于高分辨质谱的血清脂质检测与多元统计分析,共鉴定出两组之间的差异脂质有493个(P<0.05),可被归纳为12种类别;其中在超重NAFLD 组中显著上调的脂质有143 个,显著下调的有350 个。这些差异脂质中,两组间差异倍数(fold change,FC)>1.5的脂质有412个,主要包括:PC 49个、TG 111个、SM 19个、LPC 11个、DG 7个(图2)。图3展示了所有鉴定到的脂质在两组之间的差异倍数及P值情况。

图2 两组中各类脂质含量的比较Figure 2 Comparison of the contents of lipids between the two groups
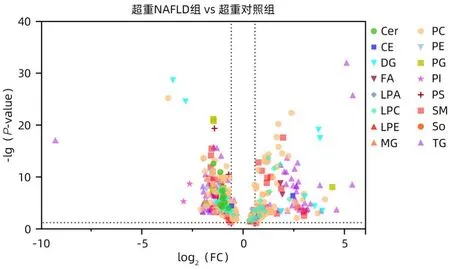
图3 超重NAFLD组与超重对照组差异脂质的火山图Figure 3 Volcanic diagram of lipids in overweight NAFLD group and overweight control group
为了比较两组之间血清脂质类别的差异情况,本研究对脂质组学鉴定到的这12 类差异脂质总体含量进行了分析。结果显示,超重NAFLD 组的总体Cer、PC、PE、PG、PI、PS、LPC、LPE、SM、FA 和DG 类脂质与超重对照组相比,差异均有统计学意义(P值均<0.01),而总体TG含量在两组间差异无统计学意义(P>0.05)(图4)。此12类脂质中,FA、LPE 和SM 的总量在超重NAFLD 组上调,其中超重NAFLD 组的平均FA 总量是超重对照组的3.6倍。
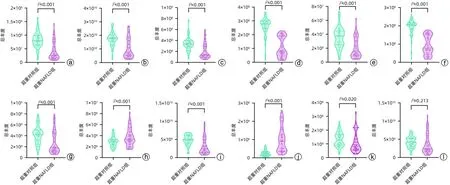
图4 超重NAFLD组与超重对照组血清脂质类别的比较Figure 4 Comparison of serum lipids between overweight NAFLD group and overweight control group
TG以饱和键数3为界,>3为多不饱和型。比较两组间血清中不同不饱和键数的TG 含量,结果显示,与超重对照组相比,超重NAFLD 组不饱和键数>3 的TG 含量降低,而不饱和键数≤3的TG含量增多,差异均有统计学意义(P值均<0.001)(图5)。
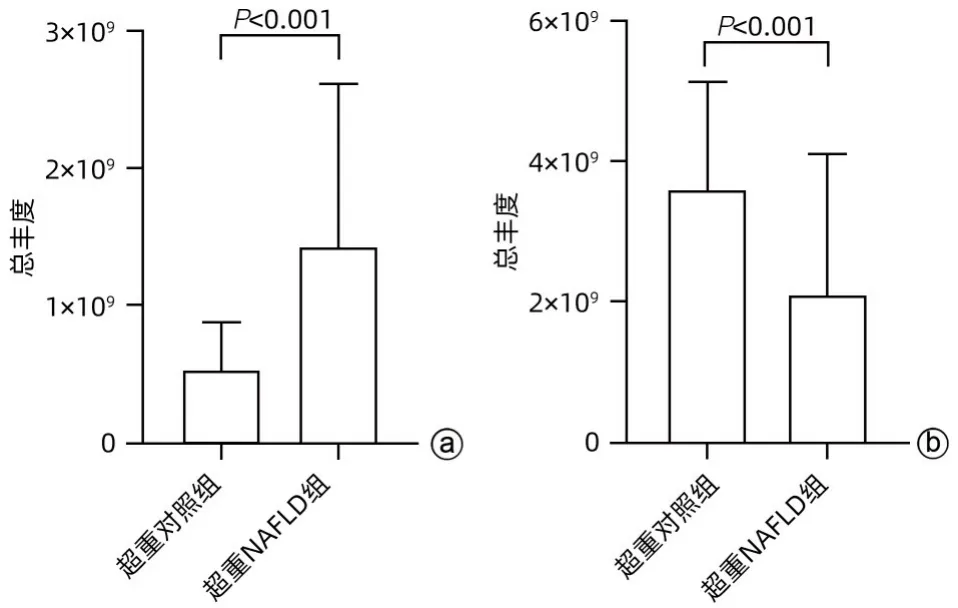
图5 超重NAFLD组与超重对照组血清TG水平比较Figure 5 Comparison of serum triglycerides between overweight NAFLD group and overweight control group
3 讨论
NAFLD 与肥胖密切相关。肥胖是NAFLD 最常见的危险因素之一,脂肪组织作为胰岛素的靶组织之一,可直接或间接影响胰岛素抵抗的发生发展,肥胖人群的脂肪组织通过分泌多种脂肪因子、促炎因子以及招募促炎免疫细胞的浸润等多种途径介导代谢性炎症的发生,从而引起β细胞损伤及胰岛素抵抗,同时,高胰岛素血症也会促进肝脏中FA的新生合成。这些FA和膳食中的游离脂肪酸会被β-氧化或甘油酯化形成TG,然后被储存在肝细胞中形成脂质滴或被包装成极低密度脂蛋白输出。因此,饮食过量和胰岛素抵抗被认为是导致NAFLD肝脂肪积累的主要原因。
本研究中,虽然NAFLD患者与健康参与者均属于超重人群(BMI>23 kg/m2),但NAFLD 组的BMI 仍高于超重对照组,且差异有统计学意义(P<0.05)。此外,NAFLD组患者的ALT、AST 水平较超重对照组显著升高,提示NAFLD 患者有不同程度的肝损伤。原因是当脂肪在肝内堆积过多时,会损害肝细胞功能,导致肝细胞内的ALT、AST 溢出细胞外,使外周血液中ALT、AST 水平升高。此外,超重NAFLD 组的RBC、Hb、Hct 显著升高,而较高的RBC、Hb、Hct 被认为与胰岛素抵抗及代谢综合征相关,有研究[9-11]显示RBC、Hb、Hct 水平与NAFLD 呈正相关。
此外,与超重对照组相比,NAFLD 患者的尿酸水平显著升高。研究[12]表明,NAFLD 患者的尿酸水平通常较高,尤其是在肥胖、高血压、糖尿病等代谢综合征患者中更为明显。这可能是由于NAFLD 导致肝功能异常,使得尿酸代谢能力下降,从而造成尿酸水平升高。还有研究[13]指出,在肥胖的NAFLD 患者中,合并高尿酸血症者发生严重肝脂肪变性的概率较高,而在非肥胖人群中却没有相似现象。高尿酸也可导致胰岛素抵抗,激活肾素-血管紧张素系统,加剧线粒体氧化应激,从而导致NAFLD 的发生。Glu 升高与胰岛素抵抗直接相关,TC、TG、LDL 增高与肝脂肪沉积有关,也增加了肝脏的胰岛素抵抗[14]。本研究中,超重NAFLD 组Glu、TC、TG、LDL显著高于超重对照组,同样提示了胰岛素抵抗可能是超重NAFLD患者与超重健康人群之间的重要差异。
脂质组学结果显示,与超重对照组相比,大多数鉴定出的脂质在超重NAFLD 患者中下调,但是FA 在NAFLD组显著增高。有研究[15]表明,NAFLD 与胰岛素抵抗有关,在胰岛素抵抗的情况下,脂肪组织对胰岛素的抗脂解作用产生抵抗力,FA 的释放增加。胰岛素抵抗伴随着胰岛素水平升高,在脂肪分解增加和/或脂肪摄入增加的情况下,均会促进肝脏TG 合成。亦有研究[16-17]发现,FA水平与BMI呈正相关,这可能是因为BMI反映了体内脂肪组织的含量,而脂肪组织是FA 的主要来源。同时,FA 水平的升高可能加重肝脂肪沉积、氧化应激和纤维化,从而促进NAFLD的进展[18]。
TG 是一种脂类物质,在基本的细胞生命活动中发挥重要作用。高水平的血清TG 与代谢紊乱和心血管疾病有关。有研究[19]指出,NAFLD 在TG 酰基链组成上的差异遵循一种模式,即NAFLD 中短链和饱和脂肪酰基含量较高,而含多不饱和脂肪酸的TG 含量较低。另有部分脂质组学研究[20-22]表明,脂肪变性受试者血浆中的TG 和DG 增加。这可能与FA 从脂肪变性的肝脏中自噬释放增多,或上调的新生脂肪合成增多有关,进而导致极低密度脂蛋白分泌增多。
尽管本研究中观察到超重NAFLD的TG种类有增加的趋势,但与超重对照组相比并没有显著差异,这可能是因为测试了大量的TG种类,导致数据冗余而没有进一步分组划分研究所致。故本研究进一步将TG 按照不饱和键数>3 和≤3 划分,结果显示两组之间有显著差异,即NAFLD 患者的TG 中饱和脂肪酰基含量较高,而含多不饱和脂肪酸的TG 较低。这可能是由于高胰岛素水平驱动从头脂肪生成,导致产生饱和脂肪酸。细胞将饱和脂肪酸储存为TG 的能力达到极限,造成了这种血液中TG组成的变化。此外,单不饱和脂肪酸的产生由甾酰辅酶A(CoA)去饱和酶的活性驱动,该酶依赖于SREBP-1 蛋白。以往有研究[23]表明,由于高胰岛素血症,NAFLD 中的甾醇CoA去饱和酶和SREBP-1激活增加。
综上所述,本研究纳入的超重NAFLD 组患者虽多项临床生化指标处于正常区间,但是与超重健康人群相比,NAFLD 患者中许多与代谢综合征、胰岛素抵抗及肝功能损伤相关的生化指标仍显著升高,提示NAFLD 患者除脂肪肝这一病理性表现之外,还有潜在的其他代谢综合征的风险。脂质组学结果显示超重NAFLD 患者与超重对照组相比较,血液内FA 明显升高;TG 中的含饱和脂肪链的种类显著升高,而含多不饱和脂肪酸的种类则较低。本研究提示,与健康的超重人群相比,NAFLD患者存在胰岛素抵抗的情况。以上结果不仅有助于进一步认识超重人群中NAFLD 的发病机制,也为超重人群特异性的预防、监测以及治疗NAFLD提供了见解。
伦理学声明:本研究方案于2020 年7 月16 日经由上海中医药大学附属普陀医院伦理委员会审批,批号:PTECA-2020-29-1。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:陈小燕负责撰写论文;袁乙富、杜晟楠负责数据收集及处理;曹勤、蒋元烨负责拟定写作思路并最后定稿。

