术后早期疼痛轨迹对于乳腺癌术后持续性疼痛的预测价值研究
徐霜霜,范志君,于 淼,何 侃,陆 军,任炳旭,杨小虎
(1.上海同济大学医学院附属东方医院 麻醉科,上海200120;2.上海市东方医院吉安医院 麻醉科,江西 吉安343000)
乳腺癌是女性中最常见的癌症之一,手术是治疗的主要方法。研究显示[1],在接受乳腺癌手术的存活患者中,有25%至60%的患者经历了持续的术后疼痛,高达25%的患者疼痛度为中度到重度,与生活质量下降、上肢功能障碍和更高的医疗费用有关。术后急性疼痛是一个动态的过程,受组织损伤程度、围手术期药物相互作用和患者特征的影响[2]。有研究[3-4]指出,对疼痛轨迹的时间顺序分析可以提供关于术后急性疼痛强度和持续时间的准确信息,当使用几个不同的子类模式(簇)而不是遵循单一的典型轨迹时,可以更好地描述急性疼痛轨迹。在其他类型手术的研究表明[5],做出这种区分可以改善手术后慢性疼痛的预测。群组化轨迹模型(Group-based trajectory modeling,GBTM)是一种统计方法,可以用来确定随着时间的推移具有相似结果的个体的轨迹簇的数目和特征。因此,本研究基于GBTM,分析术后早期疼痛轨迹对于乳腺癌术后持续性疼痛的预测价值,以期为临床早期干预提供参考。
1 资料与方法
1.1 临床资料
选取2019年1月至2021年12月在上海同济大学医学院附属东方医院治疗的乳腺癌患者临床资料进行回顾性分析。纳入标准:年龄≥18岁;符合乳腺癌临床诊断;接受过乳腺癌手术;临床资料完整。排除标准:患其他恶性肿瘤、精神或神经疾病病史、同侧3个月内乳房手术史、双侧手术、妊娠或哺乳期、糖尿病血糖失控、严重肥胖[体重指数(Body Mass Index,BMI)>35]、认知障碍、围手术期或随访资料不完整。共有224例符合条件的患者入选,其中20例在随访期内接受了二次乳房手术,5例病理分析为乳腺良性肿瘤,3例麻醉后监护病房护理资料不完整,7例随访资料不完整,最终纳入187例患者。本研究已通过我院伦理委员会批准。
1.2 方法
1.2.1手术方法 所有患者均在全身麻醉下接受手术。麻醉诱导采用异丙酚2~3 mg/kg、芬太尼1~2 μg/kg、罗库溴铵6~8 mg/kg。麻醉维持采用丙泊酚持续输注、七氟醚吸入、瑞芬太尼持续输注或芬太尼间歇输注。麻醉结束时,静脉注射芬太尼1~2 μg/kg或氟比洛芬50 mg用于麻醉后疼痛控制。术后止痛包括口服或静脉注射对乙酰氨基酚、静脉注射氟比洛芬和口服洛索洛芬。接受保乳手术的患者均接受了全乳腺照射,剂量为50Gy/25F。乳腺癌切除后放疗用于局部晚期乳腺癌或4个以上腋窝淋巴结阳性的患者,放疗范围包括胸壁、腋窝和锁骨上窝,剂量为50.0Gy/25F。
1.2.2疼痛评估 ⓐ疼痛的定义:根据国际疼痛研究协会(international association for the study of pain,IASP)的定义,术后持续3个月或以上的乳房区域(前外侧胸壁和同侧腋窝区域)疼痛认为是乳腺癌术后持续性疼痛。其他持续性疼痛的原因,如感染、恶性肿瘤或因先前存在的疼痛问题而持续的疼痛,被归类为“非乳腺癌术后持续性疼痛”。采用疼痛数字评价量表(numerical rating scale,NRS)评估乳腺癌术后疼痛程度。乳腺癌术后持续性疼痛的强度分为4组:无疼痛(NRS为0)、轻度疼痛(NRS从1到3)、中度疼痛(NRS从4到6)和重度疼痛(NRS从7到10)。ⓑ疼痛数据收集:用NRS评估麻醉后监护病房患者的术后疼痛情况,并在住院期间每隔6 h在病房至少评估一次。在门诊手术中,手术后24 h的NRS通过电话收集。出院后,根据随访方案,对患者进行每三个月一次,持续两年的随访。患者在随访出现持续疼痛和/或疼痛相关症状时,转介给本院疼痛科医生。
1.3 数据收集
在选择符合纳排条件的患者后,数据从病历、麻醉记录、麻醉后监护病房护理资料和手术资料中获得,包括年龄、BMI、美国麻醉医师协会全身状态(American Society Anesthesiology Physical Status,ASA-PS)分级、手术方式、手术持续时间、术中失血量、辅助治疗等。以麻醉后监护病房的最大NRS评分作为术后早期疼痛轨迹的时间零值,以术后7 d的NRS评分为终值。在这两个点之间,轨迹建模包括术后1、3、5和7 d的NRS评分。在此期间缺失的NRS值使用“最近邻”方法估计。
1.4 统计学方法
统计分析使用SPSS 22.0、STATA 17.0进行。按照STATA统计软件的“TRAJ”程序识别具有相似疼痛轨迹的患者亚组。正态分布的连续变量用平均值±标准差表示,用F检验进行组间比较;非正态分布的连续变量用中位数(四分位间距)表示,用Kruskal-Wallis检验进行组间比较。分类变量用例(百分比)表示,用χ2检验进行组间比较。使用Logistic回归模型分析术后早期疼痛轨迹与术后持续性疼痛的相关性。通过受试者工作特征(receiver operating characteristic,ROC)曲线分析来确定预测的准确性,P<0.05表示差异有统计学意义。
2 结果
2.1 术后早期疼痛轨迹建模
本研究准备了2~6个分组模型作为术后早期疼痛轨迹的候选模型,使用拟合优度对5个分组模型进行分析,结果显示,在3组和4组模型中,熵值最高。同时,考虑到临床对疼痛程度的分级,因此,本研究选择3组(轻度、中度和重度疼痛)作为术后早期疼痛轨迹的分组模型,见表1。

表1 术后早期疼痛轨迹建模指标
2.2 3组患者临床资料比较
按照术后早期疼痛轨迹的分组模型,分为轻度疼痛轨迹(n=30),中度疼痛轨迹(n=99),重度疼痛轨迹(n=58)。3组患者临床资料比较,见表2。
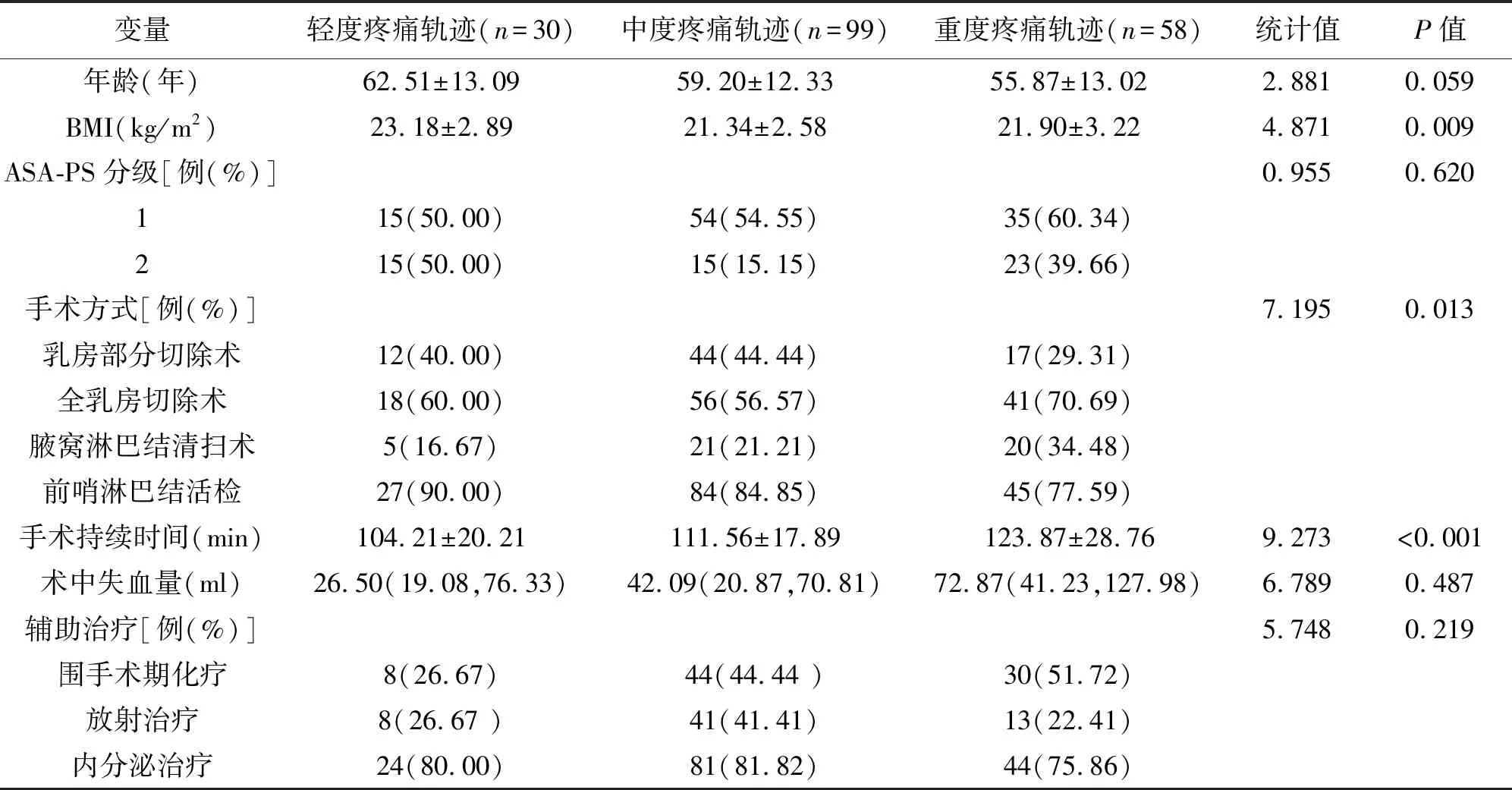
表2 3组患者临床资料比较
2.3 乳腺癌术后持续性疼痛情况
本研究显示,术后6个月持续性疼痛发生率为50.80%(n=95),其中有42.24%(n=79)出现轻度疼痛,有8.55%(n=16)出现重度疼痛。常见疼痛部位依次为胸部(39.57%)、腋窝(27.81%)、手臂(13.91%)和后背(7.49%)。无疼痛组[0(0,0)]、轻度疼痛轨迹[1(1,3)]、重度疼痛轨迹[7(7,8)]组间NRS比较,具有统计学差异(P<0.001)。
2.4 术后早期疼痛轨迹对乳腺癌术后持续性疼痛的预测价值
将术后早期疼痛轨迹(包括轻度疼痛、中度疼痛、重度疼痛)进行Logistic回归分析,结果显示,术后早期疼痛中的重度疼痛轨迹与术后6个月持续性疼痛相关(P<0.001),重度疼痛轨迹的优势比大于中度疼痛轨迹,见表3。ROC曲线显示,重度疼痛轨迹预测乳腺癌术后持续性疼痛程度的AUC为0.865,敏感度为0.846,特异度为0.885,见图1。
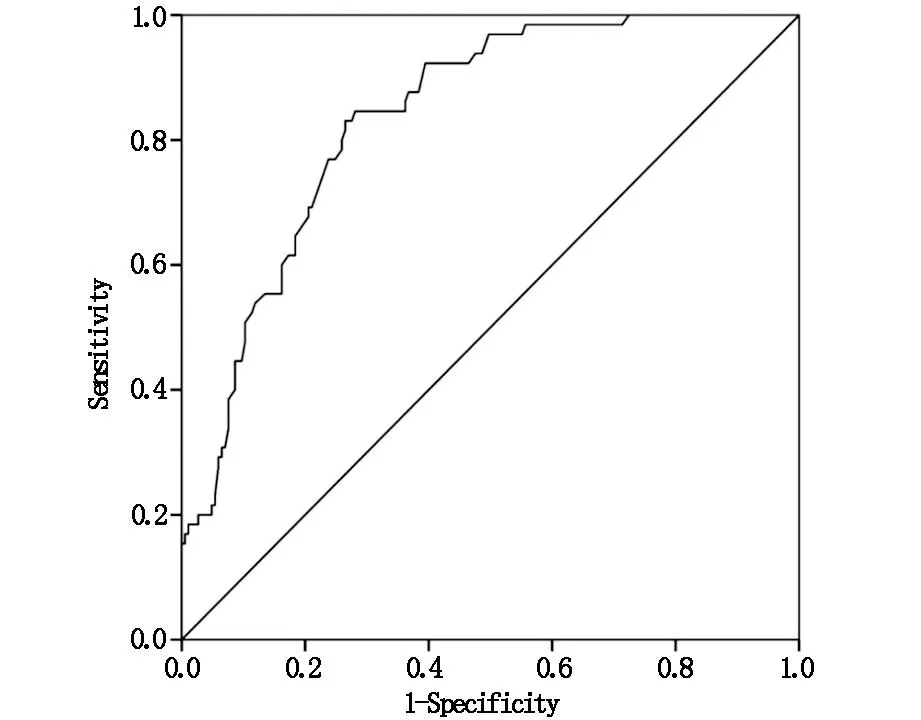
图1 重度疼痛轨迹预测乳腺癌术后持续性疼痛程度的ROC曲线

表3 术后早期疼痛轨迹与乳腺癌术后持续性疼痛程度的相关性
3 讨论
术后持续性疼痛常发生,并对包括乳腺癌手术患者在内的手术患者健康产生严重的负面影响。术后疼痛从急性转变为持续性或急性疼痛缓解失败,涉及到复杂的病理生理原因,很难建立一种可以预防这种疼痛的方法[6]。因此,识别有发生乳腺癌术后持续性疼痛风险的患者,在手术后早期实施适当的干预措施,有助于减少术后持续性疼痛带来的负面影响。
IASP将术后持续性疼痛定义为术后持续至少3个月的疼痛,本研究中对术后患者持续随访6个月,足以获得有关术后持续性疼痛的信息。在欧洲国家进行的相关研究[7]显示,44%~65%的患者在乳腺癌手术后6~12个月出现疼痛,而13%~16%的患者出现中度到重度疼痛。在本研究中,50.80%和8.55%的患者出现疼痛和重度疼痛,这表明即使在不同种族和文化的国家,手术后持续性疼痛的发生率也是相似的。
鉴于乳腺癌术后持续性疼痛的高发生率,国内外已有多项研究[8-10]对乳腺癌术后持续性疼痛的危险因素进行探究,主要包括与患者和治疗相关的因素,与其他手术患者群体中的研究类似,术后早期疼痛的严重程度是持续性疼痛的重要预测因素。同时有研究[11-12]指出,术后1天的疼痛评估与术后持续性疼痛无关,术后7天的疼痛强度对于预测持续性疼痛具有积极效应。因此,本研究基于术后7天的每日疼痛强度,基于GBTM,识别乳腺癌术后持续性疼痛的高风险患者亚组。
本研究基于GBTM,获得术后早期的轻度疼痛轨迹、中度疼痛轨迹、重度疼痛轨迹,结果显示,重度疼痛轨迹与术后6个月持续性疼痛强相关,且具有较好的预测性能。分析其原因可能为重度疼痛轨迹患者手术中采用腋窝淋巴结清扫的比例显著高于轻度及中度疼痛轨迹患者,可能与腋窝组织创伤增加和相关的肋间臂神经损伤有关,从而使得患者经历了更多的神经病理性疼痛[13-14]。这也提示临床管理乳腺癌术后持续性疼痛中应遵循以下步骤:识别高危患者,围手术期风险调整,以及通过药理学(包括神经病理性止痛药)和非药理学措施对已发生乳腺癌术后持续性疼痛的患者进行及时干预[15-16]。
综上所述,术后早期疼痛轨迹可用于预测乳腺癌术后持续性疼痛,且具有较好的预测性能。临床中,应对患者进行风险分层,有助于实施个体化管理。本研究也存在着局限性,一是作为一项回顾性研究,只能从治疗相关资料中收集数据,无法评估其他潜在重要危险因素,二是为单中心研究,限制了研究结果的普适性。因此,后期可扩大样本量、多中心、前瞻性的对本课题进行深入研究。

