阿仑磷酸钠辅助PVP 治疗对老年骨质疏松性压缩性骨折BALP、PTH 及N⁃MID⁃OT 水平的影响
田晓芳 田国华 郑艳杰 刘春香
骨质疏松症是因骨量减低与骨结构遭到破坏进而引起骨脆性提升的系统性骨病[1]。老年骨质疏松性压缩性骨折是指老年人原发性骨质疏松导致的胸腰段骨折,随着人口老龄化加剧,我国老年骨质疏松性压缩性骨折发生率呈上升趋势[2]。经皮椎体成形术(Percutaneous vertebroplasty,PVP)是现治疗骨质疏松性压缩性骨折常用的微创疗法,该方法可有效减轻患者疼痛症状,促进其恢复[3]。但PVP 治疗并不能完全改善患者骨质疏松情况,为避免术后再次发生压缩性骨折,临床应重视PVP术后骨质疏松症治疗,但现对于治疗药物的选取尚无统一标准[4]。阿仑磷酸钠是专门治疗骨质疏松的药物,可让生成骨组织的细胞占主导作用。骨碱性磷酸酶(Bone alkaline phasphatase,BALP)可直接反映成骨细胞功能活性或状况,而甲状旁腺激素(Parathyroid Hormone,PTH)可调节脊椎动物体内钙和磷代谢。本文旨在分析阿仑磷酸钠辅助PVP 治疗对老年骨质疏松性压缩性骨折BALP、PTH 及N 端中段骨钙素(N end middle Osteocalcin,N⁃MID⁃OT)水平的影响,报道如下。
1 资料与方法
1.1 一般资料
选取2019 年1 月至2022 年2 月唐山市丰润区人民医院收治的老年骨质疏松性压缩性骨折患者107 例,按照治疗方式不同分为观察组和对照组,对照组采取PVP 治疗(n=52),观察组采取阿仑磷酸钠辅助PVP 治疗(n=55)。其中对照组男22 例,女30例,平均年龄(62.49±7.25)岁,根据骨折部位分为L120 例,L27 例,L35 例,T101 例,T113 例,T1216 例。观察组男23 例,女32 例,平均年龄(62.82±7.29)岁,根据骨折部位分为L121 例,L26 例,L36 例,T102 例,T114 例,T1216 例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经院医学伦理委员会批准通过,受试者或家属已签署知情同意书。
纳入标准:①符合《实用骨科学》[5]中关于骨质疏松的诊断;②经核磁共振成像或CT 等影像学检查确诊为骨质疏松性压缩性骨折;③无椎弓根破坏、脊髓或神经根破坏征象;④无手术禁忌症;⑤年龄≥60 岁;⑥临床资料无缺乏;排除标准:①开放性等暴力性骨折者;②为甲状旁腺激素分泌过多等致的病理性骨折者;③重要器官衰竭者;④存在恶性肿瘤脑、血管病变者;⑤免疫功能、凝血功能障碍者;⑥合并认知功能障碍,无法正常交流,依从性较差者;⑦对阿仑磷酸钠等治疗骨质疏松药物存在相关禁忌证者。
1.2 方法
对照组:给予PVP 治疗[6],于PVP 术后常规予以补充碳酸钙D3 片600 mg(海南赛立克药业有限公司,国药准字H20183358,规格:600 mg)口服,1~2 次/d。
观察组:在对照组的基础上加用阿仑磷酸钠治疗,予以阿仑磷酸钠70 mg(石药集团欧意药业有限公司,国药准字H10980109,规格:70 mg)口服,1 次/周。两组共服用3 个月。
术后对两组皆进行为期12 个月的随访,随访截止到2023 年2 月,每月随访一次,随访方式采取门诊复查再骨折发生情况。
1.3 观察指标
1.3.1 两组功能障碍程度对比
采用Oswestry 功能障碍指数问卷表(Oswes⁃try Disability Index questionnaire,ODI)[7]对患者术前及术后2 个月、6 个月、12 个月进行评估,该问卷表包括坐立、步行、强度、社会生活等十方面,各方面共为5 分,满分50 分,得分越高提示椎体功能越差。
1.3.2 两组疼痛程度对比
采用视觉模拟量表(visual analogue scale,VAS)[8]对患者术前及术后2 个月、6 个月、12 个月进行评估,满分10 分,0 分表示无痛,10 分表示剧烈疼痛,得分越高提示疼痛越强。
1.3.3 两组骨代谢指标对比
采集所有患者术前、术后6 个月空腹静脉血5 mL,(离心半径:10 cm,转数:3 000 r/min,时间:10 min)处理获取血清,置于-20℃环境中冷冻备用。使用Elecsys 全自动免疫分析仪及配套试剂盒(罗氏公司),采用化学发光法测定BALP、PTH 及N⁃MID⁃OT 水平。
1.3.4 两组不良反应及再骨折发生率对比
不良反应包括发热、头晕、恶心等,并通过X光或CT 等影像学检查,记录两组门诊复查再骨折发生情况。
1.4 统计学方法
采用SPSS 18.0 处理软件对数据进行统计分析,计量资料使用()表示,两两间数据使用t检验;计数数据采用n(%)表示,采用χ2检验;以P<0.05 表示差异具有统计学意义。
2 结果
2.1 ODI 评分
两组术后2 个月、6 个月、12 个月ODI 评分均下降,且观察组术后各时间段ODI 评分均低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组ODI 评分对比[(),分]Table 1 Comparison of ODI scores between the two groups[(),points]

表1 两组ODI 评分对比[(),分]Table 1 Comparison of ODI scores between the two groups[(),points]
注:与同组术前比较,aP<0.05。
2.2 VAS 评分
两组术后2 个月、6 个月、12 个月VAS 评分均下降,且观察组术后各时间段VAS 评分均低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组VAS 评分对比[(),分]Table 2 Comparison of VAS scores between the two groups[(),points]
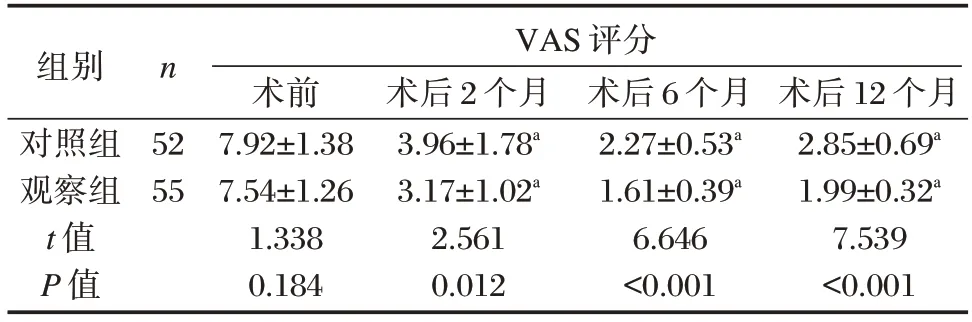
表2 两组VAS 评分对比[(),分]Table 2 Comparison of VAS scores between the two groups[(),points]
注:与同组术前比较,aP<0.05。
2.3 骨代谢指标
两组术后BALP、PTH 及N⁃MID⁃OT 水平均下降,且观察组术后BALP、PTH 及N⁃MID⁃OT 水平均低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组BALP、PTH 及N⁃MID⁃OT 水平对比()Table 3 Comparison of BALP,PTH and N⁃MID⁃OT levels between the two groups()
注:与同组术前比较,aP<0.05。
2.4 不良反应、再骨折发生率
两组不良反应总发生率对比,差异无统计学意义(P>0.05),但观察组再骨折发生率(7.28%)明显低于对照组(25.00%),差异有统计学意义(P<0.05)。见表4。

表4 两组不良反应及再骨折发生率对比[n(%)]Table 4 Comparison of adverse reactions and incidence of refractures between the two groups[n(%)]
3 讨论
老年骨质疏松性压缩性骨折常表现为腰背部疼痛、后凸畸形、背部肌肉痉挛和抽搐等临床症状,也是患者来院诊治的主要原因[9]。目前,临床上对于老年骨质疏松性压缩性骨折主要采取手术治疗、保守治疗等。因保守治疗时间较长,同时治疗效果有限,较多学者认为一旦确诊不需保守治疗,尽快进行PVP 手术[10]。PVP 具有微创特性和优越的临床疗效,能迅速缓解疼痛,防止椎体进一步压缩、恢复椎体力学强度,让患者在短时间内恢复正常活动生活[11]。
相关研究指出,骨质疏松性压缩性骨折无论是否经过PVP 治疗,后续再次发生压缩性骨折的概率仍处于高水平,约为首次发生压缩性骨折概率的3~4 倍,这也表明在PVP 术后进行全身抗骨质疏松综合治疗极其重要[12]。本次研究结果显示,观察组术后各时间段ODI 评分、VAS 评分均低于对照组。说明采取阿仑磷酸钠辅助PVP 治疗能有效缓解老年骨质疏松性压缩性骨折患者术后椎腰背部等部位疼痛感,改善其椎体功能,加快其术后恢复。分析其中原因为,阿仑磷酸钠作为氨基二磷酸盐类骨吸收抑制剂,该药物可通过二磷酸盐类进入体内与羟基磷灰石密切结合,抑制破骨细胞的合成及活性,抑制骨吸收;其次,该药物还具有增加骨量,使丧失的骨组织恢复的作用,可减少疼痛及炎症介质释放,进而缓解患者疼痛感,促进患者功能障碍恢复。
临床已证实骨代谢失衡是诱发骨质疏松的关键,BGP、BALP、PTH 等则是主要的骨代谢生化指标[13]。BALP 是由成骨细胞分泌合成的因子,BALP 水平在反映骨代谢状况中敏感性较高。临床上常用BALP 水平来检查骨软化病、骨髓瘤等。PTH 具有调节体内的钙和磷代谢的作用,研究表明PTH 水平的升高可引发骨质疏松[14]。临床已证实N⁃MID⁃OT 可作为反映骨形成速率的重要指标[15]。相关研究报道,N⁃MID⁃OT 水平较低会引起个体的骨骼组织的坚固性降低[16]。本次研究发现,观察组术后BALP、PTH 及N⁃MID⁃OT 水平低于对照组,提示阿仑磷酸钠辅助PVP 治疗能有效减少骨质疏松性压缩性骨折患者骨吸收程度,改善患者BALP、PTH 及N⁃MID⁃OT 水平,增加骨密度,使骨代谢水平逐渐下降。在安全性上,阿仑磷酸钠可从骨骼组织缓慢释放进入全身循环系统,后经肾脏代谢排除,临床安全性较好,毒性较小。其次,观察组再骨折发生率(7.28%)明显低于对照组(25.00%),说明阿仑磷酸钠辅助PVP 可有效降低再骨折发生率,分析原因可能是因阿仑磷酸钠对骨吸收部位尤其是对破骨细胞作用位置具有亲嗜性,使破骨细胞活性得到有效抑制,降低骨钙丢失,促使骨密度进一步增加。
综上所述,阿仑磷酸钠辅助PVP 治疗可有效改善老年骨质疏松性压缩性骨折患者椎体功能,减轻其疼痛程度,改善患者体内BALP、PTH 及N⁃MID⁃OT 水平,促进其术后恢复。

