TUBA1C 基因在结肠癌中的临床意义
黄奔 刘书娜 仇思洁 徐婷
研究指出,结直肠癌的诊断正在呈现年轻化的趋势,多数患者在诊断时的病理仍处于中晚期[1]。虽然新的治疗方法改善了患者预后,但五年生存率仍然不理想,转移性疾病患者的五年生存率不到20%[1⁃2]。因此,积极寻找结肠癌新型分子标志物,对于指导临床诊断和预后评估至关重要。
微管是真核细胞细胞骨架的核心组分,在细胞分裂、形成、运动和细胞内运输中发挥关键作用[3]。微管蛋白的功能与神经发育、神经退行性疾病以及癌症发生相关[4]。微管蛋白α 家族1c 蛋白(tubulin alpha 1c,TUBA1C)蛋白是α⁃微管蛋白的一个亚型[5]。研究表明,TUBA1C在胶质瘤[6]、乳腺癌[7]、肝癌[8]等肿瘤中异常表达,促进了肿瘤细胞的生长和侵袭。TUBA1C也被报道可以作为恶性肿瘤的预后标志物[9⁃10]。然而,关于TUBA1C在结肠癌中的表达和临床意义尚无研究报道。因此,本研究综合利用生物信息学的方法,分析TUBA1C在结肠癌中的临床意义和预后价值,并探索TUBA1C与结肠癌发生发展的分子通路,旨在为结肠癌提供新型分子标志物。
1 材料与方法
1.1 数据下载与处理
从GEO 数据库中检索并下载结肠癌数据集GSE106582 和GSE37182。在GSE106582 数据集中,有结肠癌组织样本117 例和正常结肠组织样本77 例;在GSE37182 数据集中,有结肠癌组织样本84 例和正常结肠组织样本88 例。在后续分析中,使用R 4.0.3 软件对数据集进行质量控制分析及归一化处理。此外,在TCGA 官方数据库中下载结肠癌的RNA 测序数据(HTSeq⁃FPKM,level 3)和患者的临床数据,其中有结肠癌组织样本471例和正常组织样本43 例。在后续分析中,删除临床信息不完整、生存数据缺失或者生存时间小于30 天的病例,共有364 例患者临床资料完整。
1.2 TUBA1C 基因表达及临床特征的分析
在TCGA 数据库中,根据TUBA1C表达水平的中位值,将患者分为低表达和高表达两组,各182例。使用卡方检验比较分析TUBA1C表达与患者年龄、性别和肿瘤分期的关系。此外,本研究使用GEPIA2 数据库和UALCAN 数据库来验证分析TUBA1C在结肠癌组织中的表达情况。
1.3 TUBA1C 基因表达与预后的分析
根据结肠癌患者的随访数据和生存状态,结合TUBA1C基因的表达情况,使用Kaplan⁃Meier 生存曲线分析高、低表达组之间的总体生存率差异。本研究还使用GEPIA2 数据库、UALCAN 数据库以及OncoLnc 在线数据库验证分析TUBA1C与患者总体生存率的关系。
1.4 TUBA1C 基因功能分析
使用STRING 数据库(https://string⁃db.org/)分析与TUBA1C互相作用的基因。利用R 4.3.0 软件对互相作用的基因进行GO(Gene Ontology,基因本体论)富集分析。KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因组百科全书)和基因集富集分析(gene set enrichment analysis,GSEA)用于探究TUBA1C参与的分子作用通路。P<0.05和错误发现率(false discovery rate,FDR)小于0.05的基因集被认为是显著富集的基因集。
1.5 统计学分析
利用R 4.3.0 和IBM SPSS Statistics 25.0 软件进行统计学分析。采用Mann⁃Whitney U 检验分析肿瘤组织与正常组织TUBA1CmRNA 表达差异。卡方检验用于分析TUBA1C表达与患者临床病理参数的相关性。生存分析采用Log⁃rank 检验。单因素和多因素COX 回归分析用于探究TUBA1C的预后价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 TUBA1C mRNA 在结肠癌组织中表达上调
在TCGA 数据集中,相比于正常组织,TUBA1CmRNA 在结肠癌组织中表达明显上调,差异有统计学意义(P<0.05)。见图1A。在TCGA 结肠癌数据集中,共有41 对配对的癌组织和癌旁组织,Mann⁃Whitney U 检验结果显示,癌组织中的TUBA1C显著高于相应的癌旁组织,差异有统计学意义(P<0.05)。见图1B。在GEO 数据库中,GSE37182 数据集和GSE106582 数据集的分析结果显示,肿瘤组织中的TUBA1C表达水平明显高于正常结肠组织样本,差异有统计学意义(P<0.05)。见图1C~D。使用UALCAN 数据库和GEPIA2 数据库验证分析,结果均显示,TUBA1C在结肠癌组织中表达明显上调,差异有统计学意义(P<0.05)。见图1E~F。
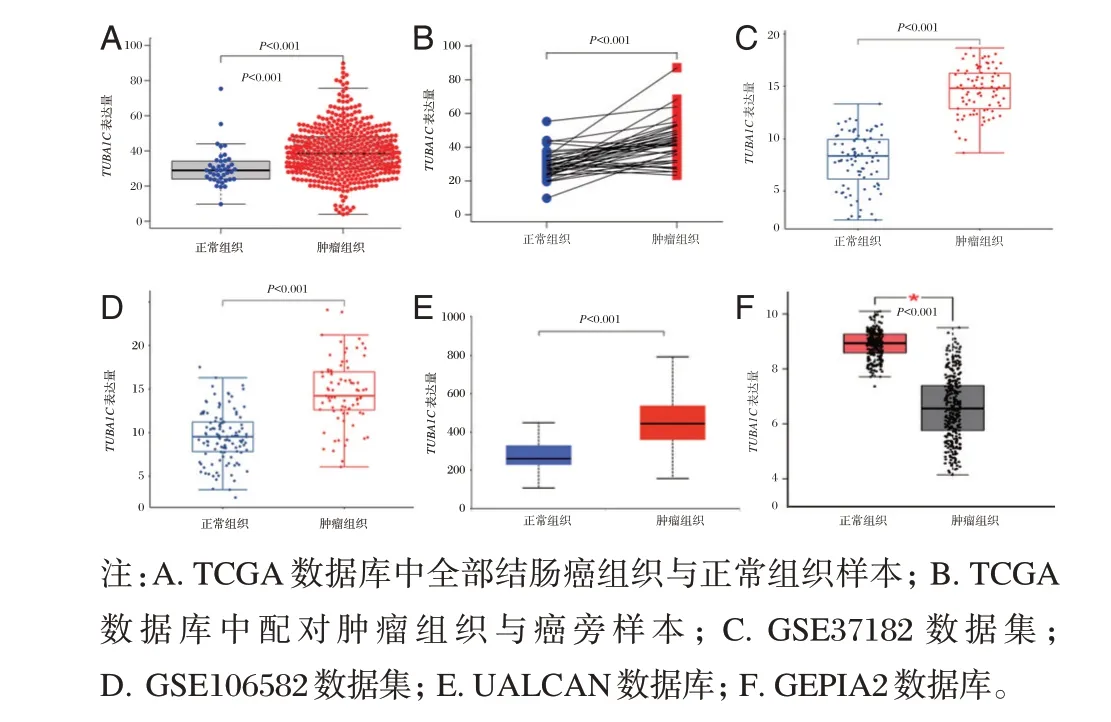
图1 TUBA1C 在结肠癌中的表达情况Figure 1 Expression of TUBA1C in colon cancer
2.2 TUBA1C表达与结肠癌患者的临床特征的关系
在TCGA 结肠癌数据集中,共有临床信息完整者364 例。见表1。根据TUBA1C在结肠癌患者表达水平的中位值(38.64),将患者划分为高表达组和低表达组。结果显示,TUBA1C表达与患者的肿瘤分期显著相关,差异有统计学意义(P<0.05)。
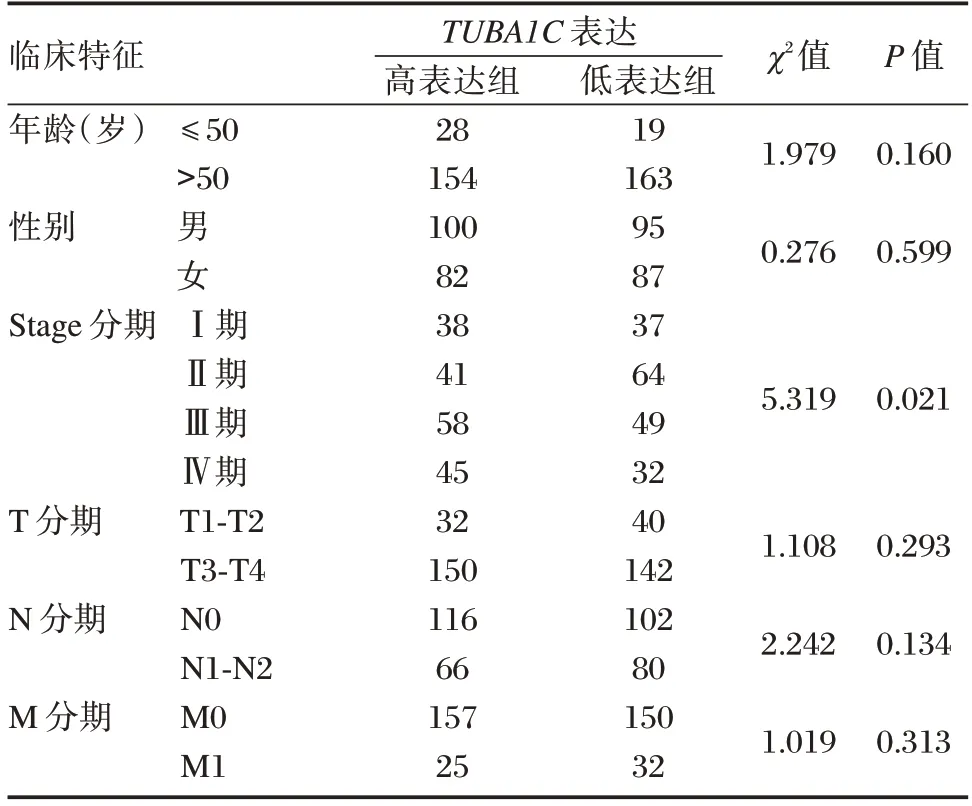
表1 TUBA1C 表达与结肠癌患者临床特征的关系Table 1 Relationship between TUBA1C expression and clinical features of colon cancer patients
Mann⁃Whitney U 检验结果显示,患者在T3 分期和T4 分期的TUBA1C表达水平与T2 分期相比,差异有统计学意义(P<0.05)。见图2A。在N 分期中,N1 期和N2 分期中的TUBA1C表达水平比N0分期显著升高,差异有统计学意义(P<0.05)。见图2C。与临床Ⅱ期相比,临床Ⅲ期和Ⅳ期患者的TUBA1C表达水平也具有明显差异,差异有统计学意义(P<0.05)。见图2D。
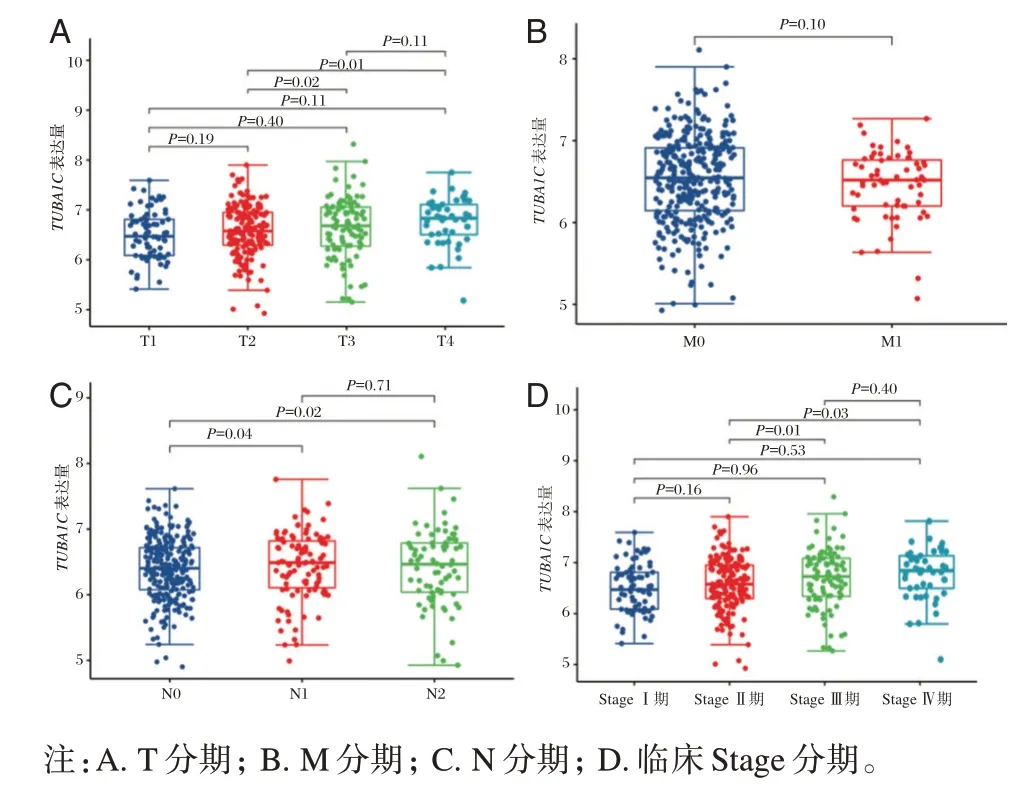
图2 TUBA1C 基因在不同临床分期中的表达情况Figure 2 Expression of TUBA1C gene in different clinical stages
2.3 TUBA1C 表达与结肠癌患者的总体生存率的关系
在TCGA 结肠癌数据集中,高表达组患者的总体生存率明显低于低表达组,差异有统计学意义(P<0.05)。见 图3A。使 用UALCAN 数据 库、GEPIA2 数据库以及OncoLnc 数据库验证分析均显示,具有高表达的TUBA1C患者的总体生存率较差,差异有统计学意义(P均<0.05)。见图3B~D。

图3 TUBA1C 表达与结肠癌患者的总体生存率的关系Figure 3 Relationship between TUBA1C expression andoverall survival in patients with colon cancer
2.4 COX 回归分析
单因素COX 回归分析显示,年龄、Stage 分期、TNM 分期和TUBA1C表达均和结肠癌患者的预后相关,差异有统计学意义(P均<0.05)。见图4A。年龄(HR=1.041,95%CI:1.020~1.063,P<0.001)、T分期(HR=2.087,95%CI:1.234~3.533,P=0.006)和TUBA1C表达(HR=1.993,95%CI:1.077~3.010,P=0.042)可以作为结肠癌患者的独立预后因素。见图4B。

图4 COX 回归分析Figure 4 COX regression analysis
2.5 生存列线图的构建
综合患者年龄、性别、Stage 分期、TMN 分期、TUBA1C表达量等影响预后的危险因素构建了列线表,其得分可直观地预测结肠癌患者1 年、3 年和5 年生存率。见图5。

图5 列线图Figure 5 Nomogram
2.6 TUBA1C 基因功能分析
在STRING数据库中,共有10个基因与TUBA1C互相作用。见图6A。GO 富集分析结果显示,这些基因在体内主要参与了纺锤体的组装作用、细胞运输以及自然杀伤细胞介导的细胞毒性作用等生物学过程;参与了细胞间桥、胞质微管等细胞学成分;参与了细胞骨架结构、细胞凋亡、紧密连接等分子功能。见图6B~C。GSEA 富集分析显示,TUBA1C参与了细胞周期、DNA 复制、错配修复以及P53 信号通路等分子途径。见图6D。

图6 TUBA1C 基因功能分析Figure 6 Functional analysis of TUBA1C gene
3 讨论
TUBA1C是TUBA 基因家族的成员,是α⁃微管的组成部分。研究指出,TUBA1CmRNA 在低分化胶质瘤中的表达明显高于正常组织,并且在恶性脑胶质瘤中表达水平更高,提示TUBA1C与胶质瘤的进展相关[6]。Albahde 等[11]研究发现,TUBA1C在胰腺癌细胞和组织中表达升高,并与患者短期生存率有关。此外,TUBA1C可以激 活Ki⁃67、E2F1 和PCNA 等癌基因的表达,促进胃癌的增殖、迁移和侵袭[12]。这些研究均表明,TUBA1C在多种恶性肿瘤中发挥了重要的作用。
本研究通过数据挖掘分析发现,相比于正常组织,TUBA1C表达水平在结肠癌组织中显著上调,并且TUBA1C表达与患者的肿瘤分期显著相关,提示TUBA1C参与结肠癌的进展。此外,生存分析的结果显示,高表达水平TUBA1C的患者总体生存率较差。多因素COX 回归分析的结果显示,TUBA1C可作为结肠癌患者的独立预后因素,这提示TUBA1C可作为结肠癌潜在的预后分子标志物。
本研究的分子机制分析结果显示,高表达的TUBA1C参与了与肿瘤进展相关的通路如细胞周期、DNA 复制、错配修复、P53 信号通路等,这表明了TUBA1C在致癌相关机制上的潜在作用。已有部分研究揭示了TUBA1C在肿瘤中的分子作用。如在胶质瘤中,敲除TUBA1C可导致细胞周期发生G2/M 期阻滞,机制分析表明,TUBA1C表达降低后,细胞周期蛋白cyclin B1 和CDK1 磷酸化的蛋白表达显著降低,而cyclin B1 和CDK1 是调节G2/M 周期进程的关键因素[13]。在胃癌中,高表达的TUBA1C会加速癌细胞周期从G1 期到S 期的进程,而TUBA1C的敲除会导致胃癌细胞周期停滞在G1期[12]。在胰腺导管腺癌中,TUBA1C下调诱导肿瘤细胞停滞在G0/G1 期,阻止肿瘤细胞从G1 期向S 期过渡[11]。因此,利用TUBA1C可以调控细胞周期这一机制可以作为潜在的肿瘤治疗策略。此外,Wang等[12]研究者认为,TUBA1C的表达还可能与P53 的表达相关。Wu 等[7]研究者发现,TUBA1C在乳腺癌中过表达,并可以通过上调关联蛋白YAP 蛋白表达促进有氧糖酵解和细胞生长。因此,TUBA1C可以通过上述多种途径影响肿瘤的发生和发展。然而,关于TUBA1C在结直肠癌中的研究机制尚无研究报道,需要进一步的分子机制实验加以研究。
由于TUBA1C在肿瘤中的重要作用,通过沉默TUBA1C基因的表达,可以实现抑制肿瘤发生进展的作用。Wang 等[14]在肝癌细胞中敲降TUBA1C后进行增殖和迁移实验,结果显示TUBA1C的下调显著降低了肝癌细胞的增殖和迁移。此外,沉默TUBA1C的表达与低水平的Ki⁃67增殖指数相关,下调TUBA1C的表达可以抑制胰腺癌的进展[11]。因此,TUBA1C有望作为肿瘤治疗的分子靶点。
综上,本研究首次指出了TUBA1C基因在结肠癌组织中异常表达,高表达的TUBA1C与患者的肿瘤分期和不良预后相关。TUBA1C可以通过调控细胞周期等致癌途径影响肿瘤的发生发展。TUBA1C基因可能成为结肠癌潜在的分子预后标志物。

