超声图像对乳腺导管原位癌患者HER⁃2 表达的预测价值
吴育杰 刘春荣★ 林秀荣 许海娜
乳腺导管原位癌是乳腺癌的一种非侵入性形式或前驱病变,其组织学外观和生物学潜力具异质性,部分乳腺导管原位癌可迅速转变为浸润性乳腺癌,增加患者死亡风险[1]。因此,早期效识别乳腺导管原位癌发展为浸润性乳腺癌的高危患者,并予以早期干预是降低患者死亡风险的关键。既往研究指出乳腺导管原位癌中人表皮生长因子受体⁃2(Human Epidermal Growth Factor Receptor 2,HER⁃2)的过度表达是浸润性乳腺癌的重要预测因子[2⁃3],既往研究也证实HER⁃2 表达反映了乳腺导管原位癌病变向侵袭进展的可能性。然而,HER⁃2 表达水平的检测主要依靠扩增阻滞系统、基因测序法检测或免疫组化染色,上述检测方法操作复杂,且需进行有创操作获取标本,使其不能广泛推广[4]。因此,寻找无创、操作方便快捷的检手段对患者具重要意义。Thysell 等[5]研究表明基因生物学行为可直接决定病理学形态特征,且病理学特征是超声图像特征表现的基础。这使探讨基因表达与超声图像特征的相关性成为可能。基于此,本研究通过测量乳腺导管原位癌患者超声图像特征,并构建基于超声图像特征的预测模型,探讨该预测模型是否可用于乳腺导管原位癌患者HER⁃2 的预测。
1 资料与方法
1.1 一般资料
选取2016 年10 月至2020 年6 月于屯昌县人民医院就诊的126 例乳腺导管原位癌患者为研究对象,收集患者入院治疗后1 年的HER⁃2 表达情况,根据患者HER⁃2 表达分为阳性组(67 例)和阴性组(59 例),平均年龄(60.32±8.45)岁。纳入标准:①符合乳腺导管原位癌的相关诊断标准[6],并经病理学检查确诊;②原发性乳腺导管原位癌,单侧病变;③首次确诊,未经治疗者;④接受超声检查及HER⁃2 检测。排除标准:①超声检查显示为非肿块病变;②乳头湿疹;③有α、γ 等射线暴露史者。研究经院医学伦理委员会批准同意,患者和(或)家属签署知情同意书。
1.2 方法
1.2.1 超声检查方法
采用美国飞利浦iU 22 型超声诊断仪,检查过程中嘱患者仰卧位双手上举置于头顶充分暴露乳腺及腋窝。在检查过程中发现病变时在轴向和垂直平面上获取两个正交图像和彩色多普勒图像。超声检查结果由两名经验丰富的主治医生完成。参数分析:由两名经验丰富的主治超声医生进行分析,具体标准参照乳腺影像报告和数据系统(Breast⁃Imaging Reportingand Data System,BI⁃RADS)第二版[7]进行评估。共选取8 个常用超声图像特征,包括肿块形状、生长方位、边缘、边界、内部回声、微钙化、后方回声、淋巴结状态。
1.2.2 HER⁃2 表达检测
利用免疫组织化学染色技术,获取石蜡包埋的肿瘤组织块后,将肿瘤组织切成4 μm 厚的切片,经脱蜡、再水化并在含有0.01 mol/L 柠檬酸盐缓冲液的微波炉中在100℃条件下加热5 min 进行抗原修复,冷却20 min 并用水和缓冲溶液洗涤。后浸于过氧化物酶5 min 并用缓冲溶液洗涤10 min。应用1∶200 稀释的一抗处理30 min,分别应用链环和链霉亲和素处理10 min,然后用缓冲溶液洗涤10 min。使用DAB⁃色原底物可视化结合抗体。然后将切片用苏木精复染,盖上盖玻片。以PBS 代替一抗为阴性对照。评分标准[8]:当膜未染色或膜染色少于10%的肿瘤细胞时染色记为阴性;局灶膜染色超过10%的肿瘤细胞,则为弱阳性(+),完整膜在超过10% 的肿瘤细胞中染色则为阳性(++);完整膜在超过10%的肿瘤细胞中被强染色,则为强阳性(+++),+、++、+++均定义为阳性。
1.3 临床资料收集
收集患者入院时人口学资料,包括性别、年龄、吸烟状况等。记录两组患者手术方式、临床分期、术后放疗等。影像学资料:超声图像特征。为保证数据的有效性,在开展研究之前,广泛阅读相关文献,咨询相关专家,在收集过程中所有资料均由相同两名主治医师按统一标准和方法进行收集、整理及录入,整理数据时剔除部分不合理数据。
1.4 预测模型的建立
采用logistics 回归方程分析乳腺导管原位癌患者HER⁃2 表达的影响因素及拟合方程P=建立预测模型。
1.5 统计学方法
采用SPSS 20.0 软件进行数据处理。符合正态分布的计量资料采用()表示,组间比较采用t检验。计数资料以n(%)表示,组间比较采用卡方检验;多因素分析采用Logistics 回归方程;通过R(3.6.1)建立列线图预测模型,计算C 指数并绘制内部验证曲线,分析淋巴结转移预测模型的诊断效能;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
单变量分析显示阳性组乳腺导管原位癌患者的临床分期、形状、边界、边缘、微钙化、腋窝淋巴结转移比例比较,差异有统计学意义(P<0.05);两组年龄等临床资料比较,差异无统计学意义(P>0.05)。见表1。
表1 两组一般资料比较[(),n(%)]Table 1 Comparison of general data between two groups[(),n(%)]
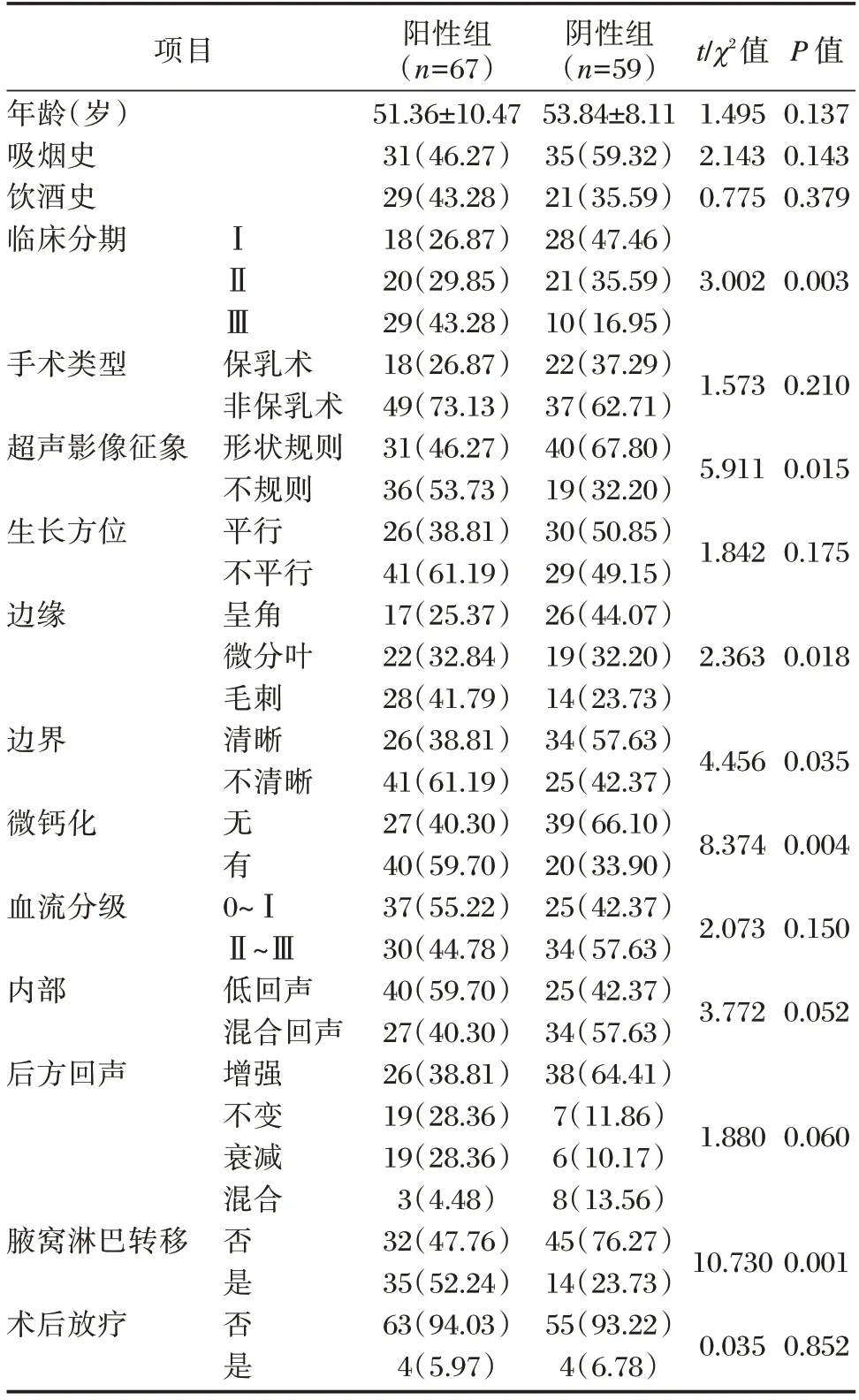
表1 两组一般资料比较[(),n(%)]Table 1 Comparison of general data between two groups[(),n(%)]
2.2 乳腺导管原位癌患者HER⁃2 表达的影响因素分析
Logistics 分析显示高临床分期乳腺导管原位癌(OR=0.073)、边缘毛刺(OR=1.448)、内部微钙化(OR=0.550)、腋窝淋巴结转移(OR=0.481)是影响乳腺导管原位癌患者HER⁃2 表达的影响因素(P<0.05)。见表2。
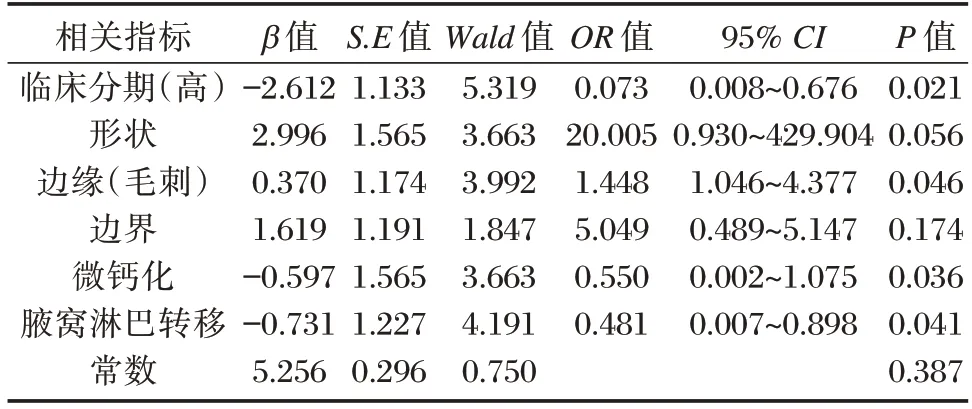
表2 多因素logistics 分析结果Table 2 Multivariate logistics analysis results
2.3 基于超声图像特征的乳腺导管原位癌患者HER⁃2 表达的预测模型构建与验证
基于上述独立风险因素及其回归系数,构建预测模型P=5.256⁃2.612×临床分期+0.370×边缘(毛刺)-0.596×微钙化-0.731×腋窝淋巴转移,对该模型进行Hosmer⁃Lemeshow 检验,结果显示决定性系数R2=0.345,P=0.790,模型拟合度良好。列线图可视化结果显示,模型预测乳腺导管原位癌患者HER⁃2 表达的C⁃index 为0.732,区分度良好。见图1。经Bootstrap 自抽样方法对验证集进行内部验证,校正曲线显示列线图模型预测可能性绝对误差为0.042,一致性良好。见图2。
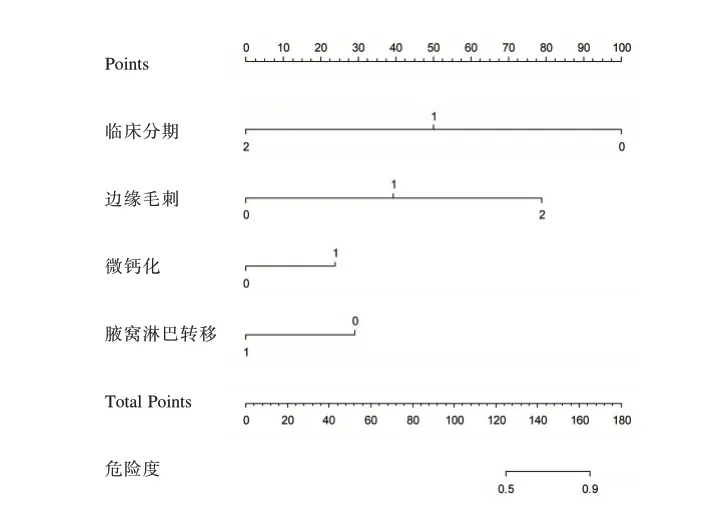
图1 基于超声图像特征的列线图预测模型Figure 1 Prediction model of nomogram based on ultrasonic image features
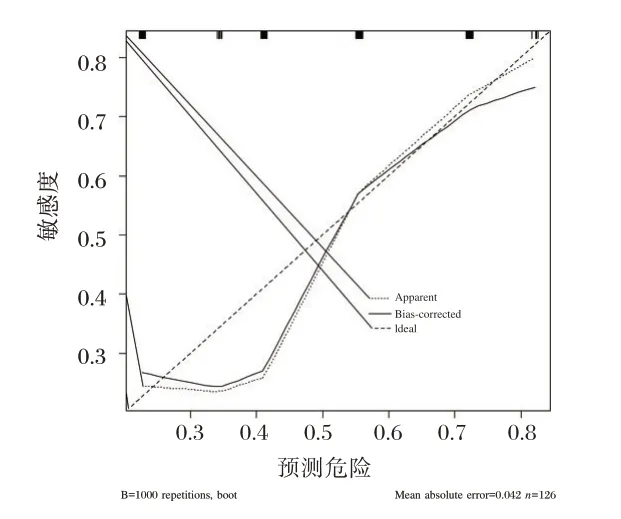
图2 活动校正曲线Figure 2 Activity correction curve
3 讨论
在乳腺导管原位癌的诊治过程中,HER⁃2 是肿瘤靶向治疗药物选择的一个重要靶点,但HER⁃2表达的检测步骤复杂、价格昂贵,导致部分基层医院难以实现HER⁃2 表达的检测[9]。近年来,基因与影像学研究的结合,使影像学研究拓宽至分子领域[10]。Wang 等[11]发现通过观察肺腺癌超声图像表现来解读肺腺癌患者生物学特征,可为肺腺癌临床病理分类、治疗提供指导。基于此,本研究通过建立基于超声图像特征的预测模型,并探讨其预测乳腺导管原位癌患者HER⁃2 表达的效能。
本研究经Logistic 回归分析显示超声影像特征边缘毛刺、内部微钙化以及高临床分期是影响乳腺导管原位癌患者HER⁃2 表达的影响因素。有研究指出ER(⁃)HER⁃2(+)乳腺癌患者呈侵袭性生长[12],Sakunrangsit 等[13]也指出ER(⁃)HER⁃2(+)与乳腺癌患者预后相关,证实肿瘤恶性程度越高,侵袭力越强,乳腺癌患者HER⁃2(+)风险发生率越高。乳腺导管原位癌患者超声影像特征边缘毛刺、内部微钙化、腋窝淋巴结转移特征的表现差异可能由肿瘤细胞生长方式决定。高临床分期恶性肿瘤在发生发展过程中多呈现出多中心、侵袭性生长趋势,同时在肿瘤细胞增殖过程中,肿瘤周围组织的结构和密度差异可导致肿瘤细胞生长阻力差异,导致形状不规则、边缘呈毛刺状的改变[14]。内部微钙化方面,非肿瘤侵袭性较小,在病灶内部淋巴细胞及肿瘤细胞大量聚集生长富集,造成病灶中心液化性坏死、出血等,进而导致病灶中心形成回声增强征象,而不出现内部微钙化征象。另有研究指出腋窝淋巴结转移的患者发生HER⁃2(+)的风险更高[15],本研究得出相似结论。腋窝淋巴结转移为HER⁃2 过表达提供了前提条件,而HER⁃2 能增强肿瘤细胞的运动能力,可促进蛋白酶水解及细胞分裂,提高乳腺癌细胞的转移潜能,从而促进肿瘤侵袭和转移。因此,当乳腺导管原位癌患者出现腋窝淋巴转移时可能提示HER⁃2 具过表达趋势或已存在过表达。另外,本研究通过超声影像特征边缘毛刺、内部微钙化,高临床分期乳腺导管原位癌、腋窝淋巴结转移建立的预测模型C⁃index 为0.732,区分度良好,绝对误差为0.042,一致性良好。表明上述指标建立的预测模型可用于乳腺导管原位癌患者HER⁃2 表达的预测。
本研究的不足之处在于纳入的样本量较小,同时对于具有多个肿块的患者,考虑到图像质量等的限制,仅选择最大肿块进行测量,这可能将一些潜在的偏倚来源引入研究,可能导致研究结果存在偏倚。
综上所述,边缘毛刺、内部微钙化、高临床分期乳腺导管原位癌、腋窝淋巴结转移是影响乳腺导管原位癌患者HER⁃2 表达的影响因素,基于此建立的预测模型可预测乳腺导管原位癌患者HER⁃2 的表达。

