以酸洗废液为原料制备FeCl2 工艺研究
邓炳林,陈金泉,宋德生,肖晋宜
(斯瑞尔环境科技股份有限公司,广东 惠州 516200)
冶金、机械等行业在金属加工过程中,常采用强酸(盐酸或硫酸)对钢材表面进行酸洗,以去除钢材表面的氧化铁锈,酸洗外排的废液就成为酸洗废液。用盐酸清洗钢材表面氧化层,则会产生大量的盐酸酸洗废液,生产1 t 钢材可产生酸洗废液约46~72 kg。盐酸酸洗废液的主要成分为17%~22%的氯化亚铁,70%~75%的水,3%~5%的盐酸及从钢材洗下来的Cu、Ni、Zn、Cr等重金属,该废液具有严重的腐蚀性和危害性,己被列入《国家危险废物名录》,代码为HW34 废酸。该废液未经妥善处理直接排放,不仅严重污染生态环境,而且该废液铁含量高,不加以利用势必会造成极大的资源浪费[1]。
通常无水氯化亚铁以无水三氯化铁为原料,在一硬质玻璃管中迅速放人无水三氯化铁,自管的一端通入经干燥的氢气,充分置换除去管内的空气后,将反应管加热。管的另一端即有大量氯化氢排出,用水吸收即可成稀盐酸。当释放氯化氢的速度减慢,氯化铁变成白色结晶时,表示反应完毕,停止加热,并在弱氢气流中使管中产物降至室温,将反应管封闭存放,然后迅速装入包装容器,制得无水氯化亚铁[2]。
本文通过实验,研究了以酸洗废液为原料制备FeCl2工艺条件。酸洗废液通过加入铁粉耗酸除杂、结晶、高温脱水、真空封装,即可得到含量≥99%的高纯FeCl2产品。本工艺简单易操作,FeCl2生产过程安全环保,可为工业化生产作为参考,实现酸洗废液资源化利用。
1 实验部分
1.1 实验原理
取广东某钢材加工企业的盐酸酸洗废液为实验原料,其酸洗废液的检测数据见表1。
除杂步骤时,向废液中加入铁粉和氢氧化钠,主要发生置换反应和金属的氢氧化物沉淀反应,反应式如下:
Fe+Cu2+=Fe2++Cu
Fe+Ni2+=Fe2++Ni
Fe+2H+=Fe2++H2↑
Fe+2Fe3+=3Fe2+
Cr3++3OH-=Cr(OH)3↓
在结晶步骤时,根据氯化亚铁溶解度曲线,控制结晶温度即可得到四水氯化亚铁晶体。氯化亚铁溶解度曲线见图1。

图1 氯化亚铁溶解度曲线
如图2 所示,FeCl2·4H2O 晶体煅烧分为两个阶段,第一个阶段为晶体脱水,第二个阶段为脱氯氧化生成氧化铁[3]。晶体在33 ℃时开始脱水,脱除4 个结晶水对应4 个吸热峰,峰温分别为80 ℃、125 ℃、150 ℃、185 ℃,脱第2、第3 两个结晶水温度接近,两个吸热峰大部分重叠,可以控制脱水温度来得到FeCl2产品[4]。但是FeCl2极易吸潮和被氧化,因此,高温脱水步骤必须在惰性气氛保护下完成,并且还要有还原剂参与反应。草酸在189.5 ℃会分解生成二氧化碳、一氧化碳和水。分解方程式:

图2 FeCl2·4H2O DTA-TG 曲线
H2C2O4=CO2↑+CO↑+H2O
本次实验采用草酸做还原剂,草酸高温分解成CO 和CO2气体,不影响FeCl2产品纯度。
1.2 实验原料和实验仪器
1.2.1 主要原料及药剂
广东某钢材加工企业的酸洗废液,详细成分见表1。
盐酸(AR),含量36%(以HCl 计);重铬酸钾(AR),含量98%;还原铁粉(工业级),单质铁98%;液碱(工业级),含量32%。
1.2.2 主要实验仪器
X 射线衍射仪(XRD) 仪器型号Bruker D8 Advance,德国;原子吸收光谱仪(AAS)型号WFX-200,北京北分瑞利分析仪器(集团)有限责任公司;管式气氛炉型号1200NT,嵩钛仪器设备有限公司;真空封装机型号MJ-ZKD,美的集团科技有限公司、高速离心机型号TG-16G,东华仪器设备有限公司;pH 计型号PHS-3E,上海仪电科学仪器股份有限公司及玻璃仪器。
1.3 实验方法
1.3.1 四水氯化亚铁晶体制备
酸洗废液中加入铁粉。
反应结束后,溶液过滤,滤液蒸发浓缩,浓缩液倒入带冷却水的烧杯中,边搅拌边冷却。
冷却完后,把晶液倒入高速离心机,进行固液分离,得到四水氯化亚铁晶体。
1.3.2 FeCl2制备
取1.3.1 制得的四水氯化亚铁加入一定量的草酸,研磨混匀后置于管式炉中,并通入氮气于250 ℃进行焙烧。
焙烧结束,等待管式炉降至室温,迅速取出产品,用真空封袋机封装保存。
2 结果与讨论
2.1 铁粉添加量除杂效果的影响
根据实验原理,加入的还原铁粉会与酸洗废液中的HCl、Fe3+、Cu2+、Ni2+反应,因此铁粉的用量即为废液中的HCl、Fe3+、Cu2+、Ni2+消耗铁粉的总量。分别向废液中加入铁粉反应当量的0.9 eq、1.0 eq、1.1 eq、1.2 eq,在水浴锅中恒温80 ℃,搅拌反应1 h。反应结束后过滤,用原子吸收光谱仪(AAS)检测滤液中的HCl、Fe3+、Cu2+、Ni2+含量,实验数据见表2。

表2 滤液中各金属杂质含量及去除率表
由表2 可以看出,Cr3+因为金属活动顺序排在Fe前面,单纯添加铁粉无法去除。还原铁粉的添加量1.1 eq时废液中的Cu2+和Ni2+含量降低趋势接近平稳,已经降到了100 mg/kg 以下。由此,铁粉添加量为废液中HCl、Fe3+、Cu2+、Ni2+反应当量的1.1 倍。
2.2 不同pH 对金属杂质去除的影响
取2.1 步骤中的1.1eq 铁粉反应后的滤液,加入氢氧化钠溶液调节pH 值2.0、2.2、2.5、3.0。溶液过滤,用原子吸收光谱仪(AAS)检测滤液中的HCl、Fe3+、Cu2+、Ni2+含量,则实验数据见表3。
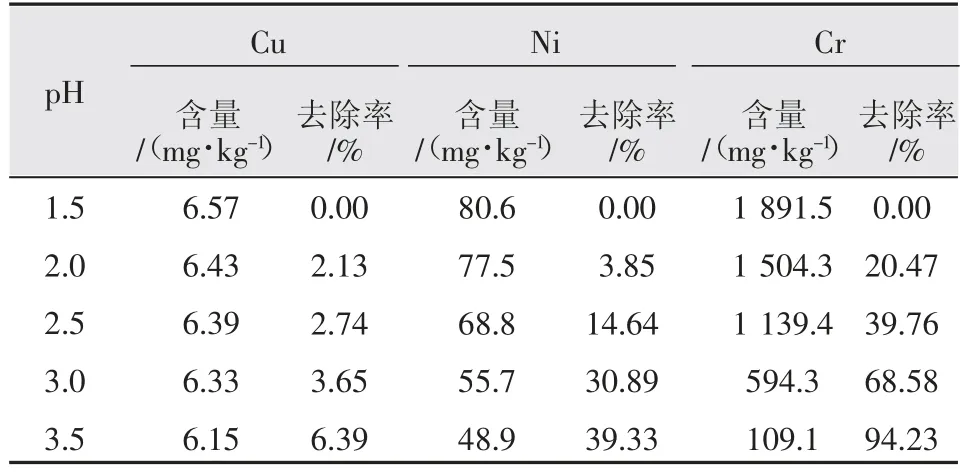
表3 不同pH 滤液中各金属杂质含量及去除率表
如表3 所示,pH=3.5 时,Cu、Ni、Cr 杂质总的去除率均达到94%以上。杂质去除效果明显,酸洗废液除杂时,用铁粉反应后再用氢氧化钠调节pH 至3.5。
2.3 结晶温度对四水氯化亚铁纯度的影响
根据氯化亚铁溶解度曲线可知,氯化亚铁在冷却结晶过程中会有FeCl2·2H2O、FeCl2·4H2O、FeCl2·6H2O,结晶温度高于80 ℃时,大部分是FeCl2·2H2O,结晶温度低于20 ℃时,大部分是FeCl2·6H2O 晶体。高温结晶得到的FeCl2·2H2O 收率低,导致后续FeCl2产品的收率也低;低温结晶得到的FeCl2·6H2O 晶体过多,又会导致后续高温脱水时能耗高,增加了FeCl2的生产成本。本次实验考察不同结晶温度下,以FeCl2·4H2O 的纯度为参照标准,确定最佳的结晶温度。结晶实验数据见表4。

表4 不同结晶温度FeCl2·4H2O 收率及纯度表

表5 不同温度和不同草酸添加量脱水实验数据表
由表4 可知,最佳的结晶温度是30 ℃,此时FeCl2·4H2O 的收率最高纯度也最高。
2.4 高温脱水条件实验
取2.3 步骤中30 ℃结晶制得的四水氯化亚铁进行高温脱水制备FeCl2实验。本次实验进行了225 ℃、250 ℃、300 ℃3 个温度梯度;草酸用量(按四水氯化亚铁的质量)0%、1%、2% 3 个梯度。共6 组实验,所有实验均在N2气氛下煅烧2 h。焙烧结束后,检测样品的全铁含量和二价铁含量,得到FeCl2纯度数据。
由实验A、B、E 看出焙烧温度过低草酸分解不够彻底,FeCl2纯度低;焙烧温度过高草酸分解完后,二价铁又被氧化成三价铁导致FeCl2纯度低;在250 ℃时,效果最佳。
由实验C、D、E 可以看出,虽然N2气氛下焙烧,但因FeCl2极易吸潮极易被氧化的特性导致在不添加草酸时FeCl2的纯度只能到95%左右;添加草酸后FeCl2纯度有提升明显。由实验数据可知,按四水氯化亚铁质量的2%添加量草酸,效果最佳。在本次实验条件下FeCl2纯度可以达到99.9%。FeCl2样品实物见图2,FeCl2样品(b)的XRD 谱图见图3。

图3 FeCl2 样品(a)未添加草酸,FeCl2 样品(b)添加2%草酸

图4 制得FeCl2 样品的XRD 谱图
2.5 封装方式实验
本实验为了验证FeCl2封装方式的差距,确定FeCl2的保存方式。取步骤2.4 制得的样品分别放置在自封袋和真空封袋保存,过3 d、5 d 取样分析亚铁含量。实验数据见表6。

表6 FeCl2 不同封装方式保存情况
表6 的检测数据可以看出,真空封装亚铁含量几乎无变化,可以很好的保存产品。
3 结论
通过一系列的实验,本文以酸洗废液为原料制得FeCl2产品,酸洗废液得到有效的资源化利用,同时为FeCl2提供了一种新的生产工艺,则最佳的工艺参数如下。
3.1 不锈钢酸洗废液中加入杂质总量的1.1 eq 还原铁粉,再用氢氧化钠调节pH 至3.5,可以有效的去除废液中的Cu、Ni、Cr 等重金属杂质。
3.2 除完杂质后的氯化亚铁溶液蒸发至饱和溶液,降温冷却至30 ℃结晶,得四水氯化亚铁晶体。此时四水氯化亚铁的收率最高、纯度也最高。
3.3 四水氯化亚铁在250 ℃,添加2%的草酸在N2气氛炉下焙烧2 h,即可得到纯度大于99%的FeCl2产品。
3.4 通过实验确认了,真空包装能较好的保存FeCl2产品。

