心脏磁共振分形分析评估肥厚型心肌病心肌小梁特征的初步研究
张鑫,周晶晶,温金扬,郑甜,方淇民,肖轩,龚良庚
南昌大学第二附属医院影像中心,江西 南昌 330006; *通信作者 龚良庚 gong111999@126.com
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是较常见的常染色体显性遗传性心肌病,指非完全因心脏负荷异常引起的以左心室壁肥厚为特征的遗传异质性心肌病,发病率约为1/200[1-2]。受心肌肥厚、心室腔缩小、心室壁顺应性降低等多种因素影响,HCM患者左心室心肌细胞肥厚和排列异常,具体可表现为心肌小梁粗大增多、结构紊乱,即发生过度小梁化[3-4]。心肌过度小梁化能够加重左心室流出道梗阻,进而导致心脏排血量减低,与患者心源性猝死、心力衰竭、恶性心律失常的发生和发展密切相关[5-8]。因此,评估过度小梁化对HCM的病理生理变化、疾病诊断、病变随访跟踪均具有重要意义[8-9]。左心室心肌小梁的分布随机而复杂,单纯测量心肌厚度无法反映左心室心肌小梁的整体数量、形态及结构特征;但小梁本身具有无限细分、自相似等基本特性,因此有可能用分形几何进行描述[10-11]。分形分析作为一种量化生物结构中复杂几何图形的定量技术,已经在肺疾病、心血管疾病[12-14]等医学影像领域得到广泛应用,通过分形分析得到的连续变量值——分形维数(fractal dimension,FD),具有高度重复性和准确性,可以对HCM心肌小梁的复杂程度进行量化分析。本研究拟以HCM为研究对象,探讨利用心脏磁共振(CMR)分形分析技术评价左心室心肌小梁复杂程度的可行性,研究HCM左心室心肌小梁复杂程度与左心室结构及心功能的相关性。
1 资料与方法
1.1 研究对象 回顾性纳入2020年8月—2022年12月南昌大学第二附属医院收治的80例HCM患者。选取同期性别、年龄相匹配的健康志愿者80名作为对照组。HCM组纳入标准[2]:①超声心动图或CMR显示舒张末期左心室壁某节段或多个节段心肌厚度>15 mm,或室间隔厚度与侧壁厚度之比>1.5;②室壁轻度增厚(13~14 mm)患者需要综合其家族史、心电图、超声心动图表现及实验室检查明确诊断。排除标准:①合并任何其他原因导致左心室心肌肥厚的心源性或系统性疾病,如高血压性心肌肥厚、甲状腺功能亢进、主动脉瓣狭窄等;②冠心病、先天性心脏病(房间隔、室间隔缺损)、心肌淀粉样变性、心肌炎等其他各种并发症;③心脏病手术史。对照组既往无心血管病、无高血压、糖尿病史,心电图检查正常。所有受检者均签署知情同意书,本研究通过南昌大学第二附属医院伦理委员会批准[研临审〔2020〕第(056)号]。
1.2 CMR扫描序列及定位方法 采用GE Signa 1.5T MR扫描仪,8通道高分辨心脏相控线圈,联合应用回顾性心电门控及呼吸门控。扫描序列:应用快速平衡稳态进动序列得到左心室两腔心、四腔心、左心室流出道及8~10层短轴电影,扫描参数:TR 2.9~3.9 ms,TE 1.4~1.7 ms,翻转角55°,视野34 cm×34 cm,重建矩阵224×224,层厚7 mm。
1.3 图像分析 分别由具有5年以上CMR诊断经验的放射科中级医师及副主任医师采用商用心脏多功能后处理软件CVI42对所有受试者图像进行分析和评估,最终取两者的平均值。
1.3.1 心功能指标分析 将原始图像上传至CVI42 5.11.3后处理软件,在心脏短轴层面用软件自动描记结合人工校正方法勾画最佳舒张末期及收缩末期左心室心内膜、心外膜边界(排除乳头肌),获得以下左心功能相关参数:左心室舒张末期容积指数(left ventricular end-diastolic volume index,LVEDVi)、左心室收缩末期容积指数(left ventricular end-systolic volume index,LVESVi)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心指数(cardiac index,CI)、左心室心肌质量指数,在舒张末期测量左心室最大室壁厚度(maximum wall thickness,MWT)。
1.3.2 分形分析 采用分形分析评价HCM组与对照组左心室基底至心尖小梁的复杂性(图1)。运用CVI42 5.3的3D-short板块,在短轴层面舒张末期手绘心内膜和心外膜轮廓,由软件进行自动化分析。分析主要包括3个步骤:①基于多阈值单水平集的图像二值化法区分左心室心肌和血池;②提取心内膜边界;③用计盒维数法计算图像的FDs。由于部分容积效应,软件会自动将最后一个心尖短轴层面内膜轮廓排除在分形分析之外。该软件将自动计算表示小梁复杂程度的无量纲量FD,是一个范围为1~2的非整数值,大小由其拓扑空间决定。

图1 FD的获取部位及HCM患者、对照组的FDs值。A:四腔心电影图,以乳头肌出现的层面为界,将左心室分为心尖部和基底部;B、C为分形分析后处理图,绿线表示心外膜,黄线/红线表示心内膜,紫线表示乳头肌,B为HCM患者左心室心肌小梁分形分析结果:mean global FD=1.302,max basal FD=1.388,max apical FD=1.393;C为正常志愿者左心室心肌小梁分形分析结果:mean global FD=1.206,max basal FD=1.311,max apical FD=1.217
分形分析技术半自动计算得到左心室短轴每一层的FD值,左心室层数8~10层,因心脏大小而异。通过软件的自动叠加短轴每一层的FD值求平均值,计算得到左心室FD均值(mean global FD),同时获得心尖部各层面中最大的FD值(max apical FD)与基底部各层面中最大的FD值(max basal FD)。
1.4 可重复性检验 由2名医师随机抽取60名研究对象重复以上分形分析后处理操作,再次进行图像分析获得FD指标,包括mean global FD、max apical FD、max basal FD,对上述参数进行观察者间可重复性分析。2名观察者独立完成图像后处理操作,其中1名观察者于3周后再次独立完成所选取病例的后处理分析。
1.5 统计学方法 采用SPSS 23.0软件。分类资料用频数表示,采用χ2检验。计量资料正态性采用Shapiro-Wilk检验,符合正态分布的计量资料以±s表示,两组比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,两组比较采用Mann-WhitneyU检验。对mean global FD、max apical FD、max basal FD诊断HCM的效能进行受试者工作特征(ROC)曲线分析,得到ROC曲线及各参数最佳截断值。采用Pearson相关或Spearman相关评价FD与心功能参数的相关性。采用组内相关系数(ICC)评价观察者组内和组间的一致性。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征及心功能比较 两组受检者性别、年龄、体重指数、心率、收缩压及舒张压比较,差异均无统计学意义(P>0.05)。
HCM组的LVESVi较对照组低,差异有统计学意义(t=3.040,P=0.003),LVEDVi、CI与对照组差异无统计学意义(P>0.05)。HCM组的LVEF在正常范围内,且平均LVEF高于对照组,差异有统计学意义(t=-7.503,P<0.001)。HCM组的左心室心肌质量指数及MWT较对照组增大,差异有统计学意义(P均<0.001),见表1。

表1 HCM组与对照组的临床相关参数、心功能参数及FD比较
2.2 FD HCM组的左心室mean global FD高于对照组,差异有统计学意义(P<0.001);左心室节段性FD包括max basal FD和max apical FD均高于对照组,差异有统计学意义(P均<0.001),见表1。
2.3 FD对HCM的诊断评估 为建立区分HCM和正常人的最佳诊断值,对mean global FD、max apical FD和max basal FD分别进行ROC曲线分析(图2),结果显示mean global FD鉴别HCM与对照组的诊断效能最佳,取1.251为诊断HCM的最佳截断值,其敏感度与特异度分别为92.5%、81.25%,曲线下面积为0.933(95%CI0.896~0.969)。max basal FD取1.361为诊断HCM的最佳截断值时,其敏感度与特异度分别为61.25%、92.5%,曲线下面积为0.745(95%CI0.662~0.828)。max apical FD取1.319为诊断HCM的最佳截断值时,其敏感度与特异度分别为73.75%、86.25%,曲线下面积为0.844(95%CI0.781~0.907)。
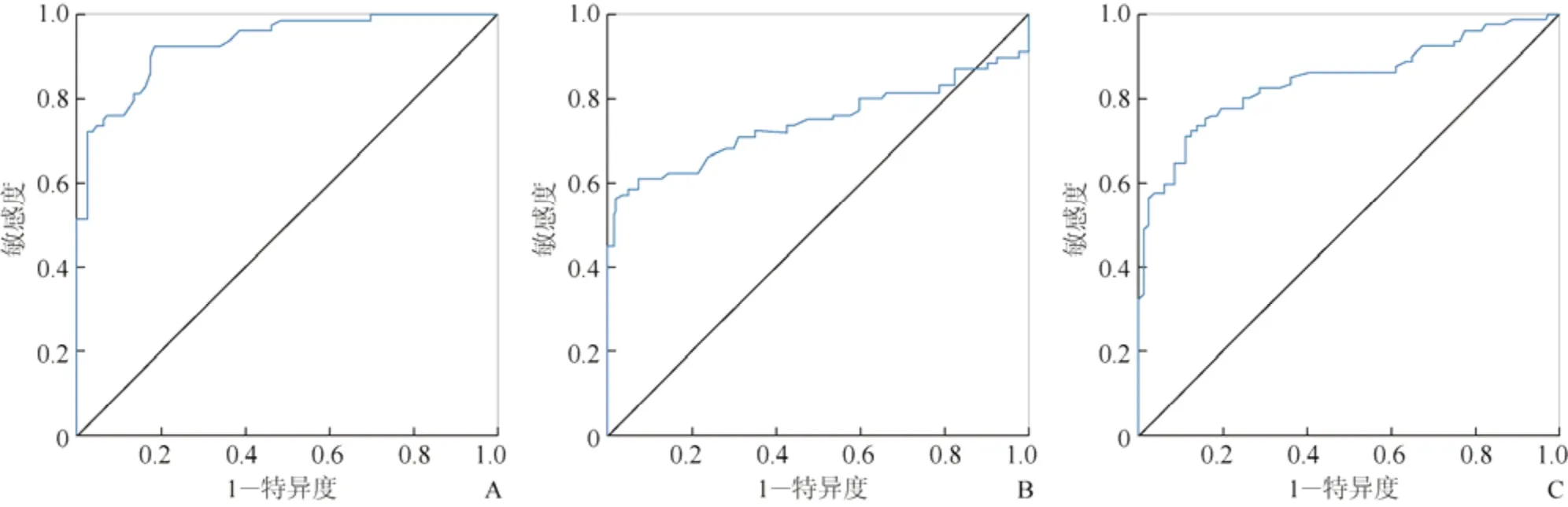
图2 FD参数诊断HCM的ROC曲线。A、B、C分别为mean global FD、max basal FD、max apical FD诊断HCM的ROC曲线
2.4 FD与临床特征、心功能的关系 对所有受试者进行相关分析显示,mean global FD与LVEF呈正相关(r=0.295,P<0.001)。mean global FD与MWT及左心室心肌质量指数均呈正相关(r=0.686、0.687,P<0.001)。平均心尖FD与LVEDVi、LVESVi呈负相关(r=-0.265、-0.352,P<0.001),与LVEF呈正相关(r=0.520,P<0.001)。所有受试者的mean global FD、max basal FD和max apical FD与年龄、性别、体重指数、心率、收缩压、舒张压等均无相关性(P>0.05)。
2.5 一致性检验 对所有研究对象进行一致性检验发现,观察者组内和组间一致性均良好(观察者内:mean global FD、max apical FD、max basal FD的ICC分别为0.986(95%CI0.964~0.994)、0.918(95%CI0.858~0.953)、0.972(95%CI0.929~0.989);观察者间:mean global FD、max apical FD、max basal FD的ICC分别为0.922(95%CI0.862~0.969)、0.922(95%CI0.808~0.965)、0.846(95%CI0.732~0.912)。
3 讨论
本研究基于CMR分形分析技术,对HCM患者的左心室心肌小梁化进行量化,结果得出:①分形分析技术可以定量测量HCM的心肌小梁化,获取反映左心室整体及局部小梁复杂程度的FD,可重复性良好。②HCM患者的左心室心肌小梁FD较健康受试者显著增加,FD可用于鉴别HCM与健康受试者。③研究对象小梁复杂性增加与左心室心肌质量、室壁厚度、LVEF相关。
3.1 分形分析技术评估心肌小梁的复杂性 本研究中,HCM组的mean global FD高于健康对照组,表明HCM患者的左心室整体心肌小梁较正常人更多、结构更复杂,这是HCM患者心室充盈阻力增大和心肌缺血,心脏腔内异常血液直接对心肌小梁产生的高压力效应所致[15]。本研究中HCM组和对照组性别、年龄、体重指数、心率、收缩压及舒张压均无显著差异,排除了非病理因素的干扰。同时对比两组左心室心尖部及基底部最大小梁FD显示,HCM组与对照组间的小梁结构均存在差异,表明HCM患者小梁异常的范围广泛。Captur等[16]研究显示HCM患者的整体与局部FD均高于健康对照组,与本研究结果一致;同时,该研究认为max basal FD大小可能受乳头肌存在的干扰,max apical FD的差异可能更能表现左心室局部的小梁病变。本研究中得到的FD均有较高的准确度及可重复性,不同于既往对心肌小梁的线性测量,在二维平面上能更好地反映心肌小梁的复杂结构[17-20]。
3.2 FD对HCM的诊断价值 ROC曲线结果表明,mean global FD作为量化HCM左心室整体小梁化程度的指标,诊断效益最佳,当mean global FD取1.235时即可鉴别HCM与正常人。本研究中,HCM患者的LVEF虽然均在正常范围内,但较健康受试者的左心室整体或局部最大心肌小梁复杂性显著增高。既往研究显示,HCM患者早期心肌收缩和舒张功能已经受损[21-22]。尽管LVEF是评价收缩心肌功能最常用的影像学生物标志物[6],但本研究结果表明FD的变化相对更加敏感,因此心肌小梁的复杂性更有助于早期发现心肌功能异常,并有助于早期诊断心肌病[23-24]。
3.3 左心室小梁复杂性与左心形态及功能的关系Captur等[16]研究表明,左心室小梁复杂性与左心室舒张末期容积呈负相关,与LVEF呈正相关。本研究结果同样表明,心尖部小梁复杂程度与LVEDVi呈弱负相关,与LVEF呈正相关。对此,部分研究表明心肌小梁的复杂化是为了扩大心内膜表面以减少收缩力而移动大的搏出量,并维持足够的心排血量/搏出量[25-26]。Cai等[27]研究表明左心室小梁复杂性与心肌质量分数呈正相关。本研究结果表明左心室小梁复杂化与心肌质量分数及心室壁最大厚度增加显著相关,既往研究显示小梁是由心内膜下心肌细胞延展至心腔内形成,心肌细胞肥大、排列紊乱与小梁的复杂化密切相关[4,17]。多项因素影响了心肌小梁复杂性。但本研究结果表明左心室小梁的复杂程度与研究对象的年龄、体重指数、血压等均无相关性,与Cheng等[25]的研究结果一致。
3.4 本研究的局限性 纳入样本量较小,且未能对HCM患者进行分组,缺乏疾病组间更多对小梁异常的影响因素研究,有待未来纳入更大样本量进一步探讨;同时,HCM的左心室小梁复杂性与其心肌舒张、收缩功能的关系目前尚未明确,有待进一步深入研究。在技术层面,期待未来的CMR分形分析技术可突破在二维平面图像的应用局限,结合人工智能深度学习,拓展到人体三维全心MRI的小梁网络分布研究中。
综上所述,可通过CMR分形分析技术定量评估HCM患者左心室心肌小梁复杂性,得到的FD可重复性良好,对HCM的诊断有明确价值,并与左心结构及功能存在相关性。

