磁共振扩散张量成像对卒中后抑郁的诊断价值
陈玥寰,隋汝波
锦州医科大学附属第一医院神经内科,辽宁 锦州 125100;*通信作者 隋汝波 srb7246@163.com
急性缺血性卒中是单病种致残率最高的疾病。卒中后抑郁(poststroke depression,PSD)发生于卒中后,表现为一系列抑郁症状和相应躯体症状的综合征,是卒中后常见并发症,其发病率逐年增加,累计患病率可达55%[1]。PSD神经精神功能恶化对卒中患者身体功能恢复和生活质量均有很大影响,具有高发生率、高自残率的特点,甚至会增加死亡风险。然而,PSD的发病机制目前尚未明确,临床工作中PSD主要根据病史及相关心理量表诊断,易受测评者主观因素影响,极易漏诊及误诊,缺乏早期诊断的特异性指标[2]。因此,进一步深入研究PSD的影响因素,为PSD的早期诊断和治疗提供有效的客观依据,具有重要的理论和现实意义。
扩散张量成像(DTI)是近年发展起来的MRI新技术,可将生理、解剖和影像紧密结合,已用于观察抑郁症、痴呆、帕金森病等认知功能障碍患者脑白质结构功能改变[3],但用于观察PSD患者脑内结构改变的研究较为少见。各向异性分数(FA)值是DTI检查中常用的定量分析参数,可反映脑白质纤维束的完整性,老年抑郁症患者脑白质纤维束存在异常[4]。抑郁的产生并非颅内某单一功能区独自作用的结果,而是与多个功能区的损害相关联[5]。作为情感产生的边缘系统以及情感调节的高级中枢,额叶在抑郁症的发生发展中发生了改变[6],而PSD作为一种特殊的抑郁,可能具有类似的表现及发病机制。另外,解剖学上认为任何部位的脑损害均会通过该病变部位与小脑间的突触联系引起对侧远隔部位的小脑改变,即交叉性小脑神经功能联系不能[7-8]。相关研究初步证实小脑可能参与PSD的发生,但其研究部位单一,且未将小脑与其他传统抑郁相关部位进行统一检测[9]。本研究拟利用DTI定量分析PSD患者小脑与传统抑郁相关部位如额叶及边缘系统(扣带回、海马、杏仁核)白质结构的改变,并研究其FA值与抑郁严重程度的相关性,探讨PSD的发病机制。
1 资料与方法
1.1 研究对象 回顾性选择2020年10月—2021年10月锦州医科大学附属第一医院神经内科急性缺血性脑卒中患者39例,男21例,女18例,年龄48~74岁。患者均经影像检查证实为单侧基底节区卒中,发病7 d内入院。分别于卒中急性期及随后的1、3、6个月行抑郁自评量表及24项汉密尔顿抑郁量表(Hamilton depression scale,HAMD)[10]测评,根据测评结果将患者分为PSD组19例及非PSD组20例。同时对每例入组者于卒中急性期行DTI检查,并根据随访的抑郁测评结果及时复查DTI。选择年龄、受教育程度与PSD组相匹配的健康志愿者20例作为正常对照,无抑郁、焦虑个人史或家族史、无脑血管意外病史,经HAMD测评排除抑郁状态。
急性缺血性脑卒中患者纳入标准:①符合《中国急性缺血性脑卒中诊治指南2014》中缺血性脑卒中的诊断标准[11];②符合国际疾病分类第10版抑郁发作诊断标准[12],由1名神经心理学医师行24项HAMD测评,总分均>7分者纳入PSD组,8~17分为轻度抑郁,18~24分为中度抑郁,>24分为重度抑郁。排除标准:①既往有脑血管病事件及其他脑部器质性疾病;②存在抑郁、焦虑等精神疾病个人史或家族史;③存在MRI检查禁忌证或不能配合完成检查;④精神发育迟滞、严重视力、听力障碍及失语,不能配合完成量表评定;⑤酒精和药物滥用或伴严重躯体疾病。本研究经锦州医科大学附属第一医院医学伦理委员会批准(202256),所有受试者均签署知情同意书。
1.2 临床资料收集 记录研究对象的年龄、性别、受教育程度、烟酒史及药物史等。检测血压、血糖、血脂、血常规、尿常规、肝、肾功能等。检查头部CT或MRI、超声心动图、心电图、颈动脉超声、经颅多普勒等。应用美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)评分评估PSD及非PSD组1 d及14 d神经功能缺损情况。
1.3 方法
1.3.1 抑郁状态测评 所有测试均由同一位具有3年临床经验、经过培训的神经内科医师进行双盲判定。所有受试者先行抑郁自评量表(self-rating depression scale,SDS)测评进行初筛,使用HAMD对抑郁严重程度进行测评。
1.3.2 FA值测量 应用飞利浦Achieva 3.0T MRI仪,检查前用泡沫垫、真空囊等固定受试者头部并要求其闭目平卧,最大限度地减少头部及其他部位运动。MRI平扫对患者进行常规检查,包括横断位T1WI、T2WI、扩散加权成像及DTI。扩散加权成像采用自旋回波平面成像(SE-EPI)序列,范围为颅顶到枕骨大孔;扩散敏感梯度方向25个, b=1 000 s/mm2。通过对轴位进行扫描得到DTI(b=0),扫描参数:TR 17 000 ms,TE 85.4 ms,矩阵240×240,视野24×24 cm,层厚2 mm,层间隔0,扫描层数65层,扫描时间7 min 39 s,像素大小2 mm×2 mm×2 mm。
将DTI的原始数据导入DTI-Studio 2.40(Baltimore,MD)软件获得彩色张量图像和FA图。由研究者手动在FA图上选取双侧对称部位的小脑中脚、下脚、前额叶、扣带回、海马、杏仁核共12个部位为感兴趣区(ROI),尽量避免不相关组织,并尽量满足所有受试者层面相同、双侧对称、大小相同,面积为24 cm2。参照彩色张量图像,每个ROI反复测量3次取平均值。所有操作均由同一位经验丰富的放射科医师进行,并将图像存于光盘内,在同一时间测量。本研究将PSD组及非PSD组缺血性脑卒中病灶同侧、对侧研究部位FA值分别与正常对照组进行对比,正常对照组对比左、右侧研究部位FA值。
1.4 统计学分析 使用SPSS 21.0软件。符合正态分布的计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用Dunnett法;计数资料以例数表示,采用χ2检验。使用多重线性回归分析FA值与HAMD及14 d NIHSS评分的相关性。应用Pearson相关分析DTI参数与临床资料的关系。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 各组间年龄、性别、教育年限、低密度脂蛋白、血糖差异均无统计学意义(P>0.05);PSD组与非PSD组1 d NIHSS评分差异无统计学意义(P>0.05),14 d NIHSS评分差异有统计学意义(P<0.05);PSD组SDS评分、HAMD评分较非PSD组及正常对照组差异有统计学意义(P<0.05),见表1。
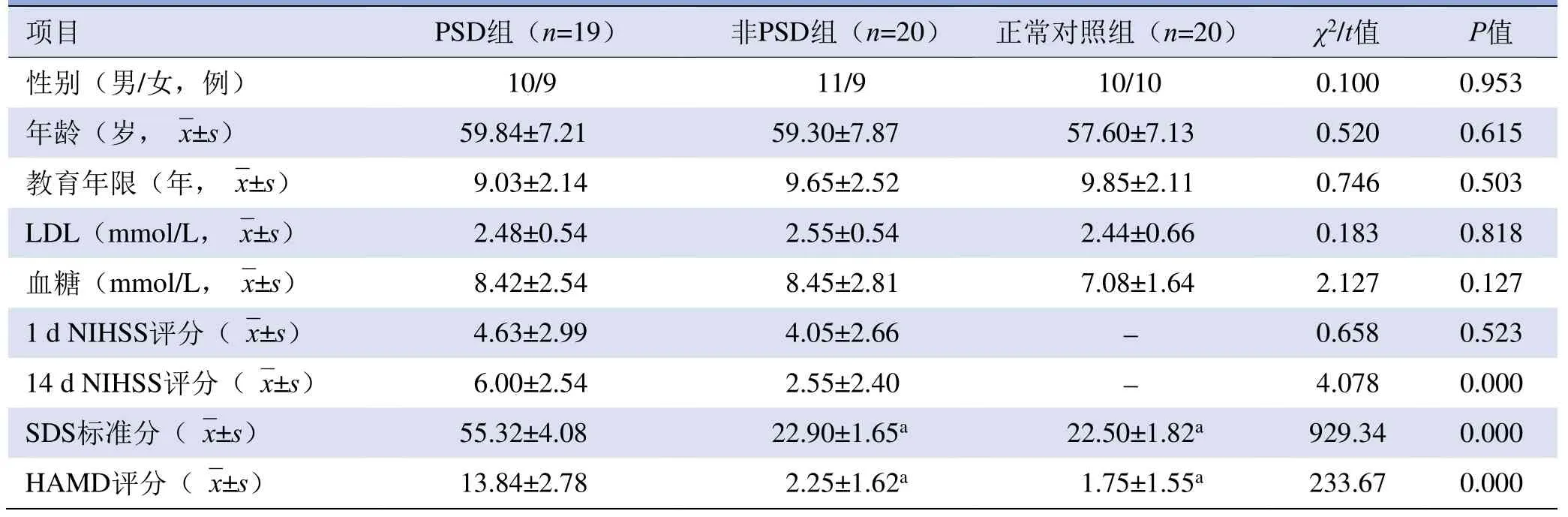
表1 PSD、非PSD、正常对照组一般资料比较
2.2 3组各ROI的FA值比较 PSD组前额叶、海马、扣带回及胼胝体膝部的病灶侧,小脑中脚、小脑下脚的病灶对侧,FA值均显著低于对侧(P<0.05);其与非PSD组及正常对照组相应ROI的FA值比较,差异有统计学意义(P<0.05)。非PSD组、正常对照组两侧各ROI的FA值,两组间同一部位的FA值差异均无统计学意义(P均>0.05),见图1、表2。

图1 PSD组各脑区FA图。A.前额叶;B.扣带回;C.杏仁核;D.小脑上脚;E.小脑中脚;F.小脑下脚
表2 PSD、非PSD、正常对照组各研究部位FA值比较(±s)
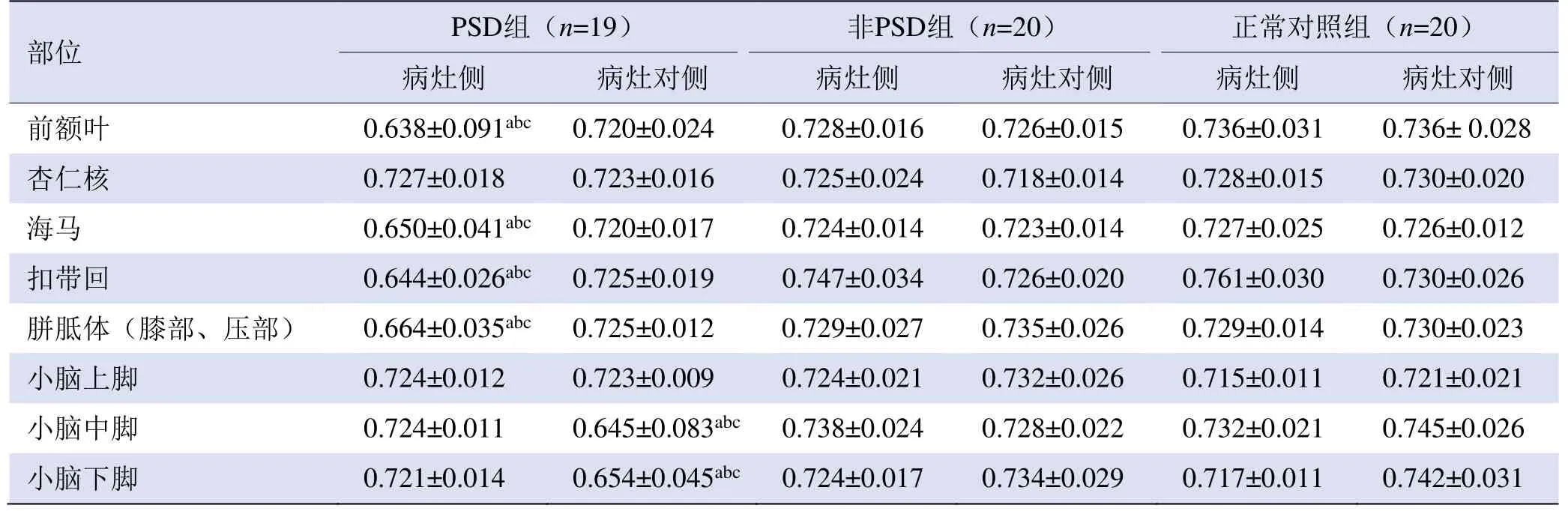
表2 PSD、非PSD、正常对照组各研究部位FA值比较(±s)
注:PSD:卒中后抑郁;a与PSD组另一侧比较, P<0.05;b与非PSD组相应ROI比较, P<0.05;c与正常对照组相应ROI比较,P<0.05
前额叶 0.638±0.091abc 0.720±0.024 0.728±0.016 0.726±0.015 0.736±0.031 0.736± 0.028 0.730±0.020海马 0.650±0.041abc 0.720±0.017 0.724±0.014 0.723±0.014 0.727±0.025 0.726±0.012杏仁核0.727±0.018 0.723±0.016 0.725±0.024 0.718±0.014 0.728±0.015 0.730±0.026胼胝体(膝部、压部) 0.664±0.035abc 0.725±0.012 0.729±0.027 0.735±0.026 0.729±0.014 0.730±0.023扣带回0.644±0.026abc 0.725±0.019 0.747±0.034 0.726±0.020 0.761±0.030 0.721±0.021小脑中脚 0.724±0.011 0.645±0.083abc0.738±0.024 0.728±0.022 0.732±0.021 0.745±0.026小脑上脚0.724±0.012 0.723±0.009 0.724±0.021 0.732±0.026 0.715±0.011小脑下脚0.721±0.014 0.654±0.045abc 0.724±0.017 0.734±0.029 0.717±0.011 0.742±0.031
2.3 FA值与HAMD及14 d NIHSS评分的多重线性回归分析 分别以HAMD评分、14 d NIHSS评分作为因变量,将各ROI的FA值作为自变量行线性回归分析,结果显示14 d NIHSS评分与各ROI的FA值不存在回归性(R2调整=0.212,P=0.139),HAMD评分与各ROI的FA值存在回归性(R2调整=0.954,P<0.05)。
HAMD评分与各ROI的FA值的多重线性回归分析结果显示,病灶侧前额叶、海马、扣带回及胼胝体膝部与病灶对侧小脑中脚、小脑下脚呈显著相关(r=-3.314~-2.044,P均<0.05),见表3。
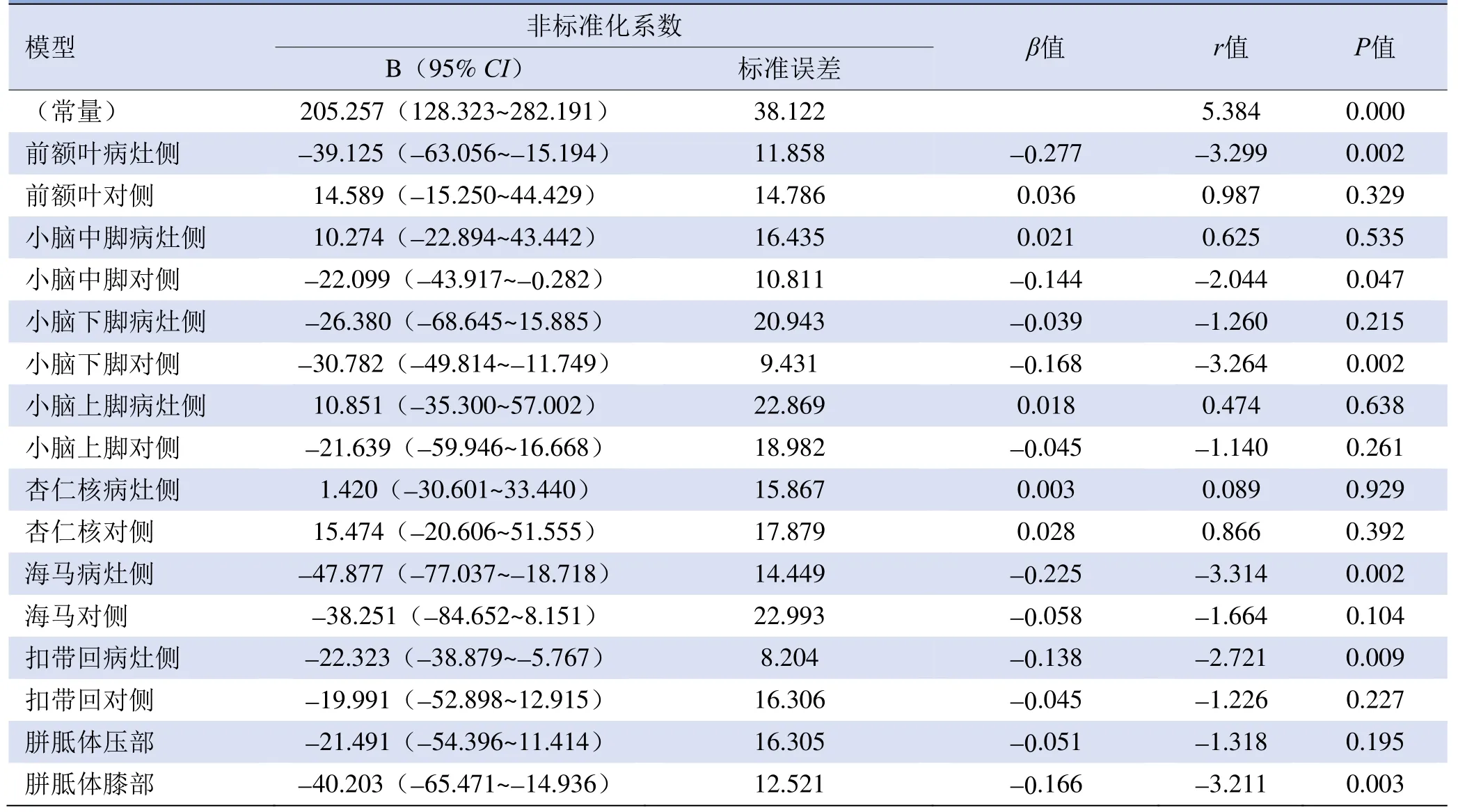
表3 FA值与HAMD评分的多重线性回归分析
2.4 小脑与传统抑郁相关部位前额叶、边缘系统FA值的相关性 对PSD组有回归意义的小脑中脚及小脑下脚FA值与差异有统计学意义的传统抑郁相关部位FA值进行Pearson相关分析,发现小脑中脚病灶对侧FA值与病灶侧前额叶、海马、扣带回及胼胝体膝部FA值呈显著正相关(r=0.977、0.752、0.637、0.539,P<0.05),小脑下脚病灶对侧FA值与上述部位无相关性(r=0.380、0.434、0.219、0.281,P>0.05)。
3 讨论
随着医学科学技术的发展,脑卒中的病死率得到很好的控制,但PSD作为卒中后的并发症,发病率仍较高,严重影响卒中患者的治疗和预后,极大地增加了患者的家庭和社会负担。目前关于PSD机制已有神经解剖学说、遗传机制、神经生物学机制、社会心理学说等多种学说[13]。DTI应用十分广泛,是目前唯一实现无创绘制活体大脑白质神经纤维通路的方法。本研究主要针对神经解剖学说,利用DTI探讨PSD的发病机制并为PSD的早期诊断提供新的思路。
3.1 额叶 纤维束方向性和完整性存在损害的白质区域均显示FA值下降,FA值趋近于0则表示纤维束发育不成熟,脱髓鞘或者纤维轴索破坏。本研究结果显示PSD组病灶侧前额叶FA值明显低于对照组,与组内病灶对侧亦存在显著差异,表明PSD患者额叶结构发生了改变。额叶作为情感网络的重要组成部位[14],参与情绪的控制与调节,基底节区梗死病灶可能破坏了同侧大脑额叶皮层的投射纤维,进而导致情感障碍的发生。杨伟毅等[15]证实PSD患者额叶白质FA值低于非PSD患者,提示PSD的发生可能与前额叶背外侧神经环路受损导致脑白质纤维束细微结构改变有关。
3.2 边缘系统 抑郁症患者脑结构功能的改变与边缘系统-皮层-纹状体-苍白球-丘脑神经环路有关[16-17]。大脑边缘作为重要一环在启动和调节行为和情感反应中起着重要作用,本研究还测定了入组患者双侧边缘系统(扣带回、海马、杏仁核)及胼胝体的FA值,结果显示PSD组病灶侧海马、扣带回及胼胝体膝部的FA值明显低于对侧,与非PSD组及正常对照组相应ROI的FA值亦存在显著差异,说明PSD患者病灶侧海马、扣带回及胼胝体膝部的白质纤维束结构发生了改变。目前国内外关于PSD与边缘系统的研究尚无明确结论[18-19],而抑郁症等精神疾病的研究结果较为一致,主要表现为前扣带回、杏仁核、海马等多个功能网络的功能连接损伤[20-23],与本研究结果基本相同。本研究未发现杏仁核的改变,可能与研究对象群体及ROI的具体划分不同有关。本研究还发现非PSD组上述部位分别与对照组比较均无显著差异,说明卒中后无抑郁者上述ROI未发生改变,该结果更加支持了边缘系统的改变与PSD有关。
3.3 小脑 关于PSD患者小脑结构的改变,本研究结果与本课题组前期研究结果一致,均表现为病灶对侧小脑中脚及小脑下脚FA值降低,且有显著意义。Alalade等[24]在临床上发现小脑-内侧前额叶、小脑蚓部-扣带回连接减少,亦为小脑在情感障碍中发挥重要作用提供了依据。为进一步明确上述有显著差异ROI的FA值改变与PSD的关系,本研究以HAMD评分为因变量、以FA值为自变量行多重线性回归分析,发现其具有显著回归性,可以解释95.4%的HAMD评分的变化。然而,以NIHSS评分为因变量的回归分析结果显示无意义,进一步说明上述ROI白质纤维结构的改变与PSD明确相关,而与梗死的严重程度无关。Kelly等[25]研究发现自闭症患者前内侧额叶和对侧小脑半球之间存在功能连接。
本研究发现具有显著差异的前额叶、海马、扣带回位于病灶侧,而小脑的改变则位于病灶对侧,即交叉性小脑神经功能联系不能现象。
综上,本研究初步证实PSD患者的前额叶、边缘系统及小脑结构发生了改变,目前也有多项研究支持该结果,但其研究部位多分散,未将同一PSD群体的多个ROI进行统一分析,本研究对此实现了初步探究。此外,笔者还发现PSD组患者的病灶对侧小脑中脚FA值改变与病灶侧前额叶、扣带回、海马及胼胝体膝部FA值改变均具有相关性。这一结果提示小脑结构的改变对PSD的意义更为突出与重要,而且多项研究也证实了电刺激小脑能够明显改善PSD患者症状[26-27],可能为PSD的早期诊断和治疗提供简洁有效的依据。本研究中小脑上脚FA值与上述部位无相关性,可能与进入小脑的纤维束多于小脑中脚走行有关。
3.4 本研究的局限性 样本量偏小,今后需要扩大样本量进一步深入研究;仅对PSD患者脑部结构的改变进行探讨,未能从神经代谢及功能水平对其进行研究,仍需进一步探索。
本研究应用DTI进一步证实小脑参与了PSD的发生,并且与其他PSD相关部位(额叶、扣带回、海马、胼胝体膝部)具有显著相关性,初步证实小脑在PSD发生中具有重要意义,为深入研究PSD的发病机制提供思路,进而为PSD的早期诊断及早期预防提供新的线索。

