核桃铵态氮转运蛋白基因JrAMT2 的功能分析
凡婷婷,张佳琦,刘会君,王凤敏,马宇航,吴宇伟,胡恒康,黄有军,李 岩,王克涛,黄坚钦,张启香
(1.浙江农林大学 浙江省森林芳香植物康养功能研究重点实验室,浙江 杭州 311300;2.浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300)
核桃Juglansregia为胡桃科Juglandaceae 胡桃属Juglans植物[1],其种仁含油量高,有“木本油料之王”的称号[2]。同时,核桃木材坚实,是良好的硬木材料。作为重要的经济林树种,核桃大多种植于土壤贫瘠的山坡沟坎,不与粮争地[3]。然而,核桃树体高大,与其他果树相比对矿质营养元素需求量较高,大量元素与核桃产量和品质形成紧密相关[4],因此,提高核桃树体对矿质元素的吸收能力对于提高核桃产量和品质至关重要[5]。研究表明:在核桃树各器官中种仁的氮素质量分数最高,核桃树吸收累积的矿质营养元素中氮素被商品核桃(种仁、硬壳)携走的比例也最高,叶片次之[6]。可见,氮素可能是提高核桃产量和品质的关键营养元素。然而,过量施用氮肥会导致严重的环境问题,因此,提高氮素利用效率是提高核桃产量与品质的重中之重[7]。
土壤中氮素主要分为无机氮和有机氮两大类,植物根系能够吸收利用的主要是无机氮,主要以硝态氮和铵态氮形式存在[8-9]。植物根系对无机氮转运调节途径可分为2 种,即高亲和力(HATs)和低亲和力(LATs)的氮转运系统[10],HATs 在外部铵态氮、硝态氮浓度低于 0.5 mmol·L-1时介导吸收大部分的无机氮,而 LATs 则是在、浓度高于 0.5 或 1.0 mmol·L-1时介导吸收无机氮[10]。植物对铵态氮和硝态氮的吸收主要由铵转运蛋白和硝酸转运蛋白介导。土壤中同时含有植物可吸收利用的硝态氮和铵态氮时,由于植物吸收硝态氮需要先将其还原成铵态氮后才能进行同化利用,消耗的能量更多,所以植物对铵态氮表现出明显的偏好性,而且当植物受盐胁迫及活性氧的伤害时,铵态氮具有缓解作用,因此,介导植物对铵态氮吸收的铵转运蛋白在植物氮同化中起着重要作用[11]。铵转运蛋白基因主要有两大类族,分为AMT1 和AMT2。在已知的铵转运蛋白中大部分 AMT1 家族的转运蛋白属于高亲和转运体[12],如拟南芥Arabidopsisthaliana中有6 个编码铵转运蛋白被鉴定,包括5 个AMT1 家族基因,1 个AMT2 家族基因。AMT1 家族基因中,AtAMT1.1 和AtAMT1.3 对拟南芥根系铵态氮吸收的贡献率最高,为30%,AtAMT1.2、AtAMT1.5 对拟南芥根系高亲和铵态氮吸收的贡献率略低于AtAMT1.1 和AtAMT1.3[13],AtAMT1.4 在花粉中特异性表达[14],在水稻Oryzasativa铵转运蛋白基因家族中AMT1 家族有基因3 个,其中OsAMT1.1 和OsAMT1.2 为高亲和力转运体[15];而 AMT2 家族以低亲和为主,在拟南芥AMT2 家族基因中AtAMT2.1 在低亲和范围内适度促进拟南芥根系对铵态氮吸收,主要在铵从根部到地上部运输中发挥作用[16]。AMT2 型蛋白通常在植物的不同组织中包括根、芽和叶中都有表达,如AtAMT2.1 基因在拟南芥各器官中均有表达,主要表达在拟南芥的维管束及上皮层[17],在拟南芥中AtAMT2.1 与AtAMT1s 之间还存在协同作用。此外,毛果杨PopulustrichocarpaPtAMT2.1 主要在叶片中,PtAMT2.2 在叶柄中高表达。除此之外,玉米Zeamays[18]、番茄Lycopersiconesculentum[19]、欧洲油菜Brassicanapus[20]等高等作物均鉴别出了AMT 基因,但到目前为止,研究大多集中于高亲和的铵转运蛋白AMT1 基因家族,对低亲和的铵转运蛋白AMT2 基因家族的研究较少。因此,阐明AMT2 的生物学功能和调控机制,对于提高核桃自身的氮效率和提高肥料利用效率都具有重要意义。
本研究以核桃JrAMT2 过表达株系为供试材料,采用实时荧光定量聚合酶链式反应(qRT-PCR)及生理检测的方法鉴定JrAMT2 基因在核桃植株体内的表达模式,进一步对核桃JrAMT2 基因进行生物学功能分析,为核桃优良品种选育提供理论依据。
1 材料和方法
1.1 植物材料
实验材料来自浙江农林大学省部共建亚热带森林培育国家重点实验室保存的核桃野生型(WT)以及课题组2019 年获得的核桃JrAMT2 过表达阳性植株[21],其中JrAMT2 基因构建于PCMBIA1300 植物表达载体,载体抗性为卡那霉素(kanmycin,Kan),利用根癌农杆菌AgrobacteriumtumefaciensGV3103 菌株介导将构建好的35S::JrAMT2::GFP 过表达载体转化到核桃野生型体细胞胚中,植物筛选标记为潮霉素(hygromycin,Hyg)。本研究所用核桃组培苗为野生型体胚和JrAMT2 过表达阳性体胚经脱水萌发获得,温室苗则由上述组培苗经生根、炼苗、驯化获得。
1.2 实验方法
1.2.1 生物信息分析运用 SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)网站在线分析JrAMT2 蛋白质二级结构,运用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)在线软件对JrAMT2 蛋白进行跨膜结构域的预测,通过 GSDS(http://gsds.gao-lab.org/)软件在线分析JrAMT2 基因结构。
1.2.2 植株的培养 同一JrAMT2 过表达阳性体胚萌出的植株为1 个株系,选取3 个核桃JrAMT2 阳性株系,命名为JrAMT2-1、JrAMT2-2、JrAMT2-3,每个株系继代培养至50 株以上,培养条件:温度为25 ℃,湿度为 75%~80%,光照强度为2~15 klx,光照周期为16 h 光照8 h 黑暗,培养基为Driver&Kunivuki&McGranahan (DKW)培养基。
采用2 步生根法获得核桃驯化植株,选取阳性体胚萌发后经4 次继代培养的核桃组培苗作为实验材料。第1 步进行根诱导,5~8 cm 长的光生芽,转移到补充有10 mg·L-1吲哚丁酸钾(K-IBA)的DKW 固体培养基,在黑暗中培养7 d,诱导根原基的发生;第2 步,不定根诱导结束后将其转移到粗蛭石∶DKW 培养基比例(体积比)为3∶2 的固体培养基中,温度为25 ℃,湿度为75%~80%,光照强度为2~15 klx,光照周期为16 h 光照8 h 黑暗,培养时间为21~28 d,形成不定根,获得核桃不同株系生根植株[22]。
核桃苗不定根形成后取出用清水冲洗,多菌灵浸泡,移栽到泥炭∶蛭石∶珍珠岩比例(体积比)为2∶1∶1 的混合土中,将移栽驯化成活后获得的核桃再生植株在温度为 25 ℃,湿度为 75%~80%,光照强度为2~15 klx,光照周期为16 h 光照8 h 黑暗的条件下培养[23],获得核桃不同株系温室植株。
1.2.3 核桃JrAMT2 基因阳性鉴定 选用阳性体胚萌发后经4 次继代培养的核桃组培苗进行绿色荧光蛋白(GFP) 检测、PCR 及RT-qPCR 验证,引物见表1。从再生植株顶芽开始向下截取 1.5 cm,培养14 d后观察植株表型,每个株系均5 个生物学重复。选取植株顶芽、叶片、茎段混样提取DNA 及RNA。PCR 反应程序为:94 ℃预变性 2 min;98 ℃变性10 s,55 ℃退火温度 30 s,68 ℃延伸 2 min,共 32 个循环;68 ℃延伸 7 min,PCR 反应产物进行质量分数为1.2%琼脂糖凝胶电泳。使用 The iQ5 Real-Time PCR Detection System 仪器进行RT-qPCR,测定转基因植株中JrAMT2 的相对表达量。反应程序为:95℃ 10 min;95 ℃ 10 s,60 ℃ 31 s,40 个循环;95 ℃15 s;60 ℃ 1 min;95 ℃ 30 s;60 ℃ 15 s。通过 2-ΔΔCt方法计算定量结果[24]。
表1 引物Table 1 Primers
取核桃野生型及核桃JrAMT2 过表达株系组培苗的根、茎、小叶,根纵切、茎横切临时切片分别放置于体视荧光显微镜(Carl Zeiss Stereo D13covery V12,Axio Cam MRc system)在明场和蓝光(488 nm)激发条件下利用 ZEN lite 成像软件连续拍照[25-26]。
1.2.4 生长参数、铵态氮和硝态氮测定 分别选取生长状态一致的核桃野生型与3 个核桃JrAMT2 过表达株系组培苗,从顶尖向下剪取1.5 cm 茎段,含2~4 片复叶,培养14 d,每个株系均5 个生物学重复,测量株高及节间数。选取长势相同的核桃野生型及JrAMT2 过表达植株采用2 步生根法驯化,移栽后用直尺测量统计不同株系生长0、20、40 d 的株高、节间长、叶片长度及叶片宽度。
分别选取生长状态一致的核桃野生型与3 个核桃JrAMT2 过表达株系组培苗,培养14 d,采用2 步生根法获得核桃生根植株,植株分为地上部分及地下部分2 个部分,清洗植株,分别测定地上部分及地下部分鲜质量,于105 ℃下杀青,80 ℃烘干至恒量,称取干质量。使用苏州科铭生物技术有限公司的植物铵态氮(ZATD-1-G)和植物硝态氮(ZXTD-1-G)试剂盒测定地上部分及地下部分铵态氮和硝态氮质量分数,每个株系均5 个生物学重复。
1.2.5 植株叶绿体观察、叶绿素质量分数及叶绿素荧光测定 分别选取生长状态一致的核桃野生型与3 个核桃JrAMT2 过表达株系组培苗,取顶尖向下第2 节间处复叶。将该叶片置于0.35 mol·L-1氯化钠中研磨破碎至絮状,取悬液于高倍光学显微镜下观察,找到视野中单个完整的叶肉细胞,观察细胞中的叶绿体, 使用image J 软件计算叶绿体表面积与单层细胞表面积比率。每个株系均5 个生物学重复。
采用丙酮浸取法测定叶绿素质量分数。分别取0.1 g 核桃野生型与3 个核桃JrAMT2 过表达株系组培苗长势一致的叶片,剪碎,置于15 mL 离心管中,加入10 mL 体积分数 80%丙酮溶液,于室温黑暗处浸提,直至管内材料褪色变白,以80%丙酮溶液为对照,测定663 和646 nm 处吸光值,每个株系均5 个生物学重复。wt=[(wa+8wb)×Vt×(mFW×1 000)-1],叶绿素 a 质量分数(wa) =20.3×D(646),叶绿素 b 质量分数(Cb)=8.04×D(663)。其中:wt为叶绿素质量分数(mg·g-1),Vt为提取液总体积(mL),mFW为叶片鲜质量(g),D(646)和D(663)分别为646 和663 nm 处的吸光度。
叶绿素荧光测定使用M-PEA(multi-function plant efficiency analyser)多功能植物效率分析仪(英国Hansatech 公司)测定。选取生长状态一致的核桃野生型与3 个核桃JrAMT2过表达株系温室苗由上向下第3 片叶片暗处理30 min,在饱和脉冲光(5 000 μmol·m-2·s-1) 下进行快速叶绿素荧光诱导动力学曲线(OJIP 曲线) 的测定和绘制。参照SCHANSKE 等[27]的方法分析叶绿素荧光诱导动力学参数(JIP-test)。
1.2.6 数据分析 利用SPSS 26 软件进行单因素方差分析(one-way ANOVA)和多重比较(邓肯法),显著性水平为0.05。使用GraphPad Prism 7.0 软件绘图。
2 结果与分析
2.1 核桃JrAMT2 基因生物信息学分析
核桃JrAMT2 基因的全长为 1 464 bp,起始密码子为 ATG,终止密码子为 TGA。经过美国国家生物技术信息中心(NCBI)在线序列比对显示:该基因的序列编码的氨基酸序列属于 Ammonium Transporter Family,编码487 个氨基酸(图1),蛋白分子量为52.458 kD,预测分子式为C2433H3715N601O646S23,含有7 418 个原子,理论等电点为7.11,不稳定指数为35.61,脂溶指数为101.56,亲水性平均值为0.472。该段蛋白质中包含20 种常见氨基酸:亮氨酸质量分数最高,达到11.7%,其次分别为甘氨酸11.1%,丙氨酸10.9%,缬氨酸8.6%,半胱氨酸质量分数最低,仅为1.0%。JrAMT2 蛋白中分别含有29 个酸性氨基酸残基(Asp+Glu)和29 个碱性氨基酸残基(Arg+Lys) (表2)。

图1 JrAMT2 基因氨基酸序列Figure 1 Amino acid sequence of JrAMT2 gene

表2 JrAMT2 基因氨基酸组成Table 2 Composition of JrAMT2 amino acids
对核桃JrAMT2 蛋白跨膜区的预测结果表明:该蛋白N 端在膜外,C 端存在膜内,共含有11 个跨膜螺旋,跨膜螺旋区段分别位于24~46、59~81、129~151、158~180、195~214、227~244、254~276、288~310、314~333、346~368 和398~420,推测JrAMT2 属于跨膜蛋白,并在N 端存在信号肽(图2A)。
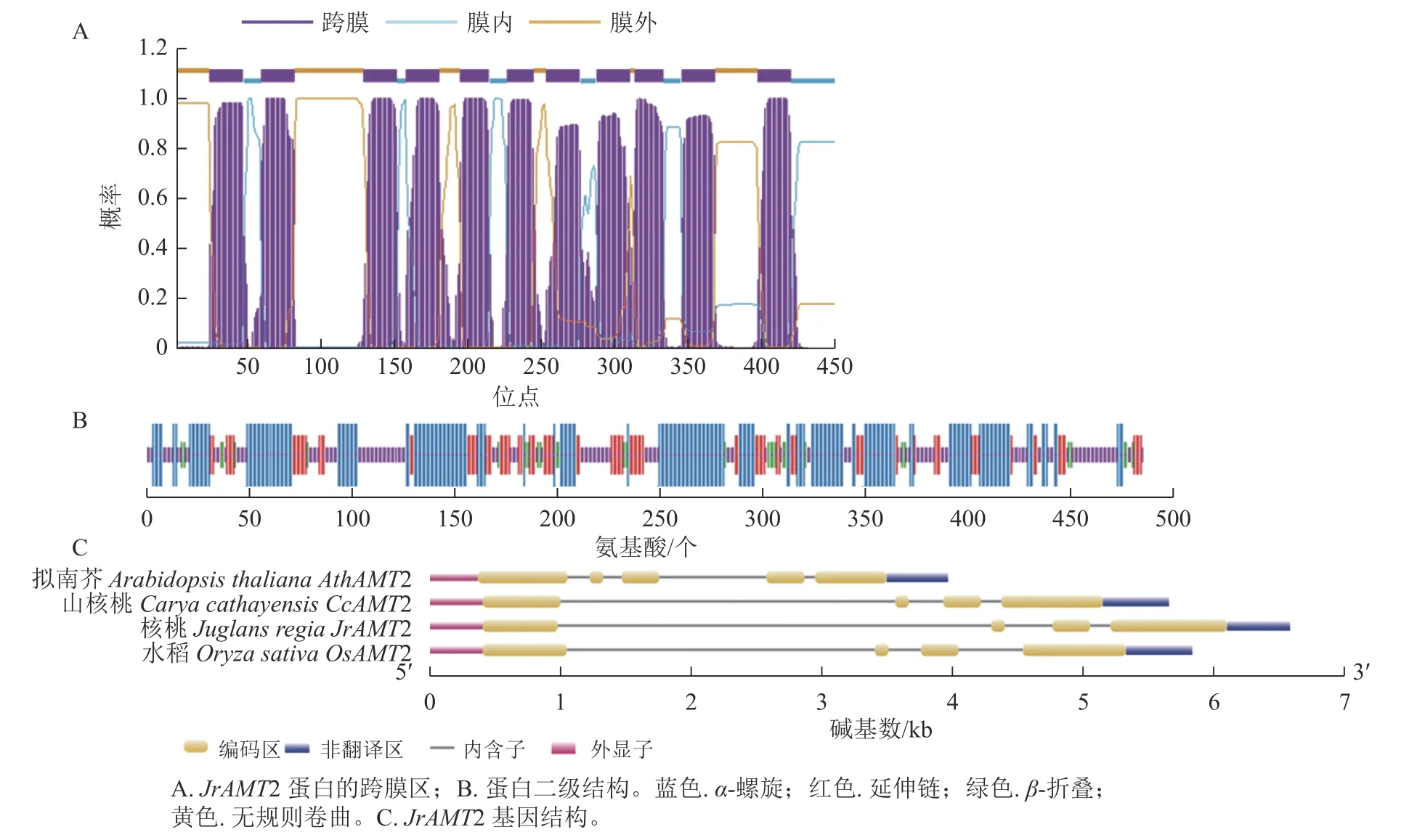
图2 核桃JrAMT2 基因生物信息学分析Figure 2 Bioinformatics analysis of JrAMT2 gene in J.regia
对JrAMT2 蛋白二级结构的预测结果显示:JrAMT2 的氨基酸组成中有4 种构象,其中 α- 螺旋有201 个氨基酸,占比 43.12%;延伸链有 93 个氨基酸,占比19.10%;β- 转角有 30 个氨基酸,占比6.16%;无规则卷曲有154 个氨基酸,占比 31.62%。JrAMT2 铵转运蛋白主要由 α- 螺旋和无规则卷曲组成(图2B)。
对JrAMT2 基因结构的分析显示:JrAMT2 基因由4 个外显子,3 个内含子组成。与拟南芥AtAMT2 基因相比,拟南芥基因结构多了1 个外显子和1 个内含子,与山核桃Caryacathayensis CcAMT2 基因[28]、栓皮栎QuercussuberQsAMT2 基因[29]相比,外显子和内含子数量相同,同源性较高(图2C)。
2.2 核桃JrAMT2 过表达植株阳性验证
在成功构建35S::JrAMT2::GFP 的过表达载体并通过农杆菌介导转化核桃体胚后,对同一无性系JrAMT2 体胚经脱水萌发获得的再生植株进行阳性鉴定。利用PCR 技术,以核桃JrAMT2 过表达植株3 个株系(JrAMT2-1、JrAMT2-2 和JrAMT2-3) DNA 为模板,进行外源GFP 基因(729 bp)的PCR 验证,检测到大小约为 750 bp 的电泳条带,与GFP 基因大小符合(图3A);进行目的基因JrAMT2 加外源GFP 基因全长(2 193 bp)的PCR 验证,检测到大小为2 000 bp 的电泳条带,与目的基因大小符合(图3B);以核桃JrAMT2 过表达植株3 个株系的cDNA 为模板,利用实时定量PCR 技术对JrAMT2 基因表达量进行检测,结果显示:核桃JrAMT2 过表达植株3 个株系JrAMT2 基因相对表达量分别为野生型的10.58、12.80 和14.94 倍,显著上调(图3C),表明核桃JrAMT2 过表达植株中JrAMT2 基因稳定表达。

图3 PCR 和RT-qPCR 对核桃组培苗的JrAMT2 基因的检测Figure 3 Detection of JrAMT2 gene in J.regia tissue culture seedlings by PCR and qRT-PCR
对获得的过表达株系进行GFP 荧光阳性鉴定,分别将核桃过表达及野生型幼苗(图4A)的小叶、茎、根置于荧光体视显微镜下在波长为488 nm 蓝光激发下拍摄。结果显示:过表达植株的小叶、茎、根表面呈现均匀的绿色荧光,其中腋芽处荧光更明亮(图4B1~6),野生型核桃幼苗的小叶、茎、根在荧光下拍摄无绿色荧光激发(图4B7~12),说明JrAMT2 蛋白在腋芽处积累。为进一步研究JrAMT2 基因在核桃幼苗中的表达,对过表达株系及野生型组培苗的茎段进行横切,根进行纵切后,进行GFP 荧光检测,结果显示:核桃JrAMT2 过表达植株茎段横切中呈现均匀的绿色荧光,其中在维管组织中荧光更明亮,野生型植株茎段横切面无绿色荧面光(图4B1~12);核桃JrAMT2 过表达植株根段纵切面中呈现均匀的绿色荧光,且在维管组织中荧光更明亮,野生型植株根段纵切面无绿色荧光(图4C1~8)。表明JrAMT2 基因在核桃幼苗的根和茎中均可稳定表达,其中JrAMT2 蛋白在根和茎的维管束组织中积累。

图4 铵态氮转蛋白基因JrAMT2 在核桃苗中稳定表达Figure 4 Stable expression of ammonium nitrogen transfer protein gene JrAMT2 in J.regia
2.3 核桃JrAMT2 基因的生物学功能分析
2.3.1 核桃JrAMT2 过表达植株生长表型分析 为了进一步研究核桃JrAMT2 基因的生物学功能,将3 个JrAMT2 过表达植株与野生型核桃植株培养14 d。结果表明:与野生型相比,核桃JrAMT2 过表达植株均生长旺盛,株高显著增加,节间显著增长(P<0.05,图5A)。3 个JrAMT2 过表达株系株高分别为3.87、4.23 和4.12 cm,节间长分别为0.33、0.35 和0.34 cm,野生型植株株高为3.30 cm,节间长为0.28 cm,与野生型相比,3 个JrAMT2 过表达株系株高分别增加了17.0%、28.0%和29.0% (图5B),节间长分别增加了19.0%、25.0%和24.0% (图5C)。综上所述,JrAMT2 过表达对核桃幼苗的生长有显著提高作用。
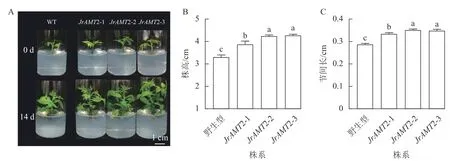
图5 核桃JrAMT2 过表达离体培养植株表型分析Figure 5 Phenotypic analysis of J.regia JrAMT2 overexpression plant in vitro culture
对核桃JrAMT2 过表达植株进一步驯化培养,成功获得核桃JrAMT2 过表达温室苗。对其生长表型进行分析(图6A),定植后培养40 d,核桃JrAMT2 过表达温室苗的株高、节间长、叶片长度、叶片宽度增加显著高于野生型(P<0.05)。培养至第20 天时,与野生型相比,核桃JrAMT2 过表达温室苗3 个株系株高分别增加21.9%、26.0%和24.6% (图6B),节间长分别增加41.2%、27.7%和26.3% (图6C),叶片长度分别增加18.7%、16%和30.7% (图6D),叶片宽度分别增加41.3%、48.2%和55.1% (图6E);培养至第40 天时,与野生型相比,JrAMT2 过表达温室苗3 个株系株高分别增加53.6%、68.2%和62.1%,节间长分别增加37.2%、50.3%和44.8%,叶片长度分别增加了27.8%、34.1%和49.3%,叶片宽度分别增加24.3%、19.5%和29.2%。综上所述,核桃JrAMT2 过表达温室苗与野生型相比,株高、节间长、叶片大小均显著增加,进一步证明JrAMT2 基因过表达加快了核桃的生长速度。

图6 核桃JrAMT2 过表达阳性温室苗性状分析Figure 6 Character analysis of J.regia JrAMT2 overexpression positive greenhouse seedlings
2.3.2 核桃JrAMT2 过表达植株对氮素吸收分析 为探究JrAMT2 基因在核桃中是否存在差异表达,将核桃野生型及核桃JrAMT2 过表达植株进行2 步生根,获得核桃JrAMT2 过表达生根植株,将其分为地上部分与地下部分。与野生型相比,核桃JrAMT2 过表达生根植株地下部分不定根生长旺盛(图7A)。对核桃JrAMT2 过表达植株地上部分及地下部分差异分析,分别提取3 个核桃JrAMT2 过表达株系生根植株地上部分及地下部分RNA,利用实时定量PCR 技术,分析地上部分及地下部分JrAMT2 基因表达的差异。结果表明:3 个JrAMT2 过表达株系地上部分JrAMT2 基因表达量分别是野生型的11.94、12.70 和15.06 倍,地下部分JrAMT2 基因表达量分别是野生型的19.07、23.34 和24.00 倍(图7B)。对核桃野生型及3 个JrAMT2 过表达株系地上部分及地下部分进行干质量和鲜质量测定。结果表明:3 个JrAMT2 过表达株系地上部分鲜质量和干质量显著高于野生型(P<0.05),与野生型相比,鲜质量分别增加23.45%、33.67%和56.26%,干质量分别增加23.45%、43.89%和56.26%;3 个JrAMT2 过表达株系地下部分干质量和鲜质量显著高于野生型(P<0.05),与野生型相比,鲜质量分别增加222.65%、199.24%和344.38%,干质量分别增加222.65%、199.24%和354.33%(图7C)。
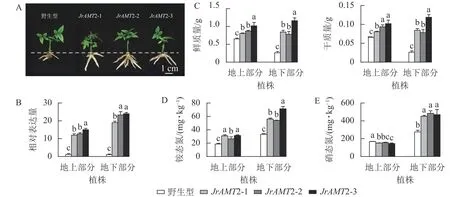
图7 核桃JrAMT2 过表达植株氮素吸收分析Figure 7 Character analysis of the regenerated plants with expression of JrAMT2 in J.regia
基于核桃JrAMT2 过表达植株表型变化,本研究进一步测定核桃JrAMT2 过表达植株对硝态氮及铵态氮吸收。结果表明:与野生型相比,核桃3 个JrAMT2 过表达株系地上部分及地下部分铵态氮质量分数显著增加(P<0.05),地上部分分别增加59.1%、32.3%和55.1%,地下部分别增加68.1%、61.9%和114.1% (图7D);核桃3 个JrAMT2 过表达株系地上部分硝态氮质量分数显著降低(P<0.05),地下部分硝态氮质量分数显著增加(P<0.05),地上部分分别降低10.1%、7.1%和13.6%,地下部分别增加63.5%、75.7%和70.3% (图7E)。综上所述,JrAMT2 基因主要作用于核桃地下部分,且JrAMT2 基因过表达促进植株地下部分对铵态氮和硝态氮的吸收,并介导了铵态氮从地下部到地上部的运输。
2.3.3 核桃JrAMT2 过表达植株叶绿素质量分数及叶绿素荧光特性分析 对核桃JrAMT2 过表达植株叶色与叶片细胞叶绿体进行观察。核桃JrAMT2 过表达植株叶色与野生型相比颜色较深(图8A),在显微镜下观察3 个核桃JrAMT2 过表达植株株系及野生型叶绿体特征发现,3 个核桃JrAMT2 过表达株系扩张的栅栏叶肉细胞中的叶绿体更致密(图8B)。进一步分析发现:对3 个阳性株系进行总叶绿素质量分数测定,3 个核桃JrAMT2 过表达株系叶绿素质量分数显著高于野生型(P<0.05),野生型总叶绿素质量分数为3.53 mg·g-1,核桃JrAMT2 过表达阳性植株3 个株系总叶绿素质量分数分别为4.64、4.69 和6.10 mg·g-1,与野生型相比分别增加了32.6%、34.0%和74.3% (图8C);JrAMT2 过表达株系叶绿体表面积在单层细胞表面积的占比显著高于野生型(P<0.05),野生型叶绿体表面积与单层细胞表面积的比率为0.56,3 个核桃JrAMT2 过表达株系叶绿体表面积与单层细胞表面积的比值分别为0.67、0.68 和0.69,与野生型相比分别增加了19.41%、21.18%和22.94% (图8D)。综上所述,JrAMT2 基因过表达提高了叶绿体表面积与单层细胞表面积的比率及核桃叶肉细胞内叶绿素的积累。
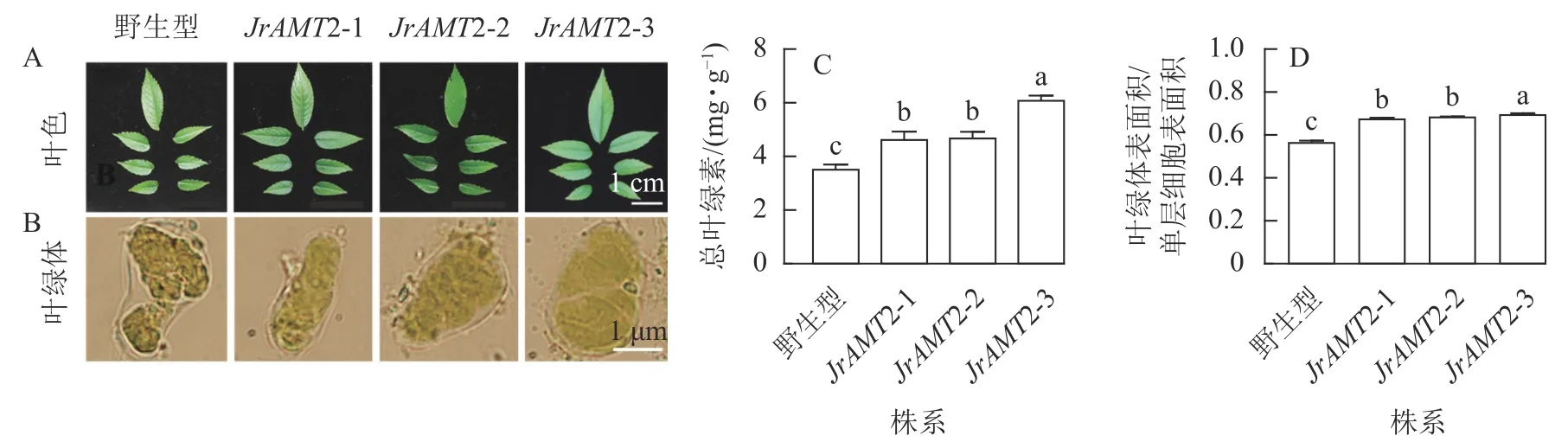
图8 核桃JrAMT2 过表达植株叶绿体及叶绿素质量分数分析Figure 8 Analysis of chloroplast and chlorophyll content in J.regia with JrAMT2 overexpression
对3 个核桃JrAMT2 过表达株系进行快速叶绿素荧光诱导动力学曲线测定。结果显示:与野生型相比,3 个核桃JrAMT2 过表达株系的O (Fo点)相、K 相降低,J 点、I 点、P (Fm)及J~P 点振幅均提高,OJIP 曲线较陡,表明JrAMT2 基因一定程度上提高了叶片的活性(图9A)。与野生型相比,3 个核桃JrAMT2 过表达株系暗适应后的最大荧光强度(Fm)、最大量子产额(Fv/Fm)均提高,Fm分别提高了47.1%、45.9%、50.2%,Fv/Fm分别提高了15.6%、13.4%、14.7%,表明JrAMT2 基因一定程度上提高了光系统Ⅱ(PSⅡ)的光化学效率(图9B)。计算归一化处理的OJIP 曲线(Vt)[Vt=(Ft-Fo/(Fm-Fo),Ft为任意时刻t的荧光值],并计算相对荧光差异ΔVt[ΔVt=Vt处理-Vt对照,用ΔK、ΔJ值分别显示在300 μs 和20 ms处的ΔVt值,表示放氧复活体的活性(OEC)]。结果显示:与野生型相比,3 个核桃JrAMT2 过表达株系ΔK、ΔJ值下降且<0 (图9C),表明JrAMT2 基因一定程度上提升了核桃叶片PSⅡ供体侧及受体侧电子传递效率及放氧复活体的活性。

图9 铵态氮转运蛋白JrAMT2 基因表达对核桃叶绿素荧光的影响Figure 9 Effect of ammonium nitrogen transporter JrAMT2 gene on chlorophyll fluorescence of J.regia
用JIP-test 参数对OJIP 曲线进行定量分析,结果显示:核桃3 个JrAMT2 过表达株系在t=0 时的最大光化学效率(φPo)、反应中心捕获的光能用于下游电子传递的量子产量(ΨEo)、吸收的能量用于电子传递的量子产量(φEo)上升,分别上升了14.62%、44.59%、65.80%;在J 点的相对可变荧光强度(VJ)、最小荧光强度与最大荧光强度比值(Fo/Fm)、反应中心关闭净速率(dV/dto)下降,分别下降了31.03%、35.29%、49.34% (图9D),表明JrAMT2 基因一定程度上提高了PS 反应中心的量子比率及产额;对单位PS 反应中心比活性参数分析,结果显示:与野生型相比,3 个核桃JrAMT2 过表达株系在t=0 时的单位反应中心捕获的用于电子传递的能量(ETo/RC)、在t=0 时的单位反应中心传递到电子链末端的能量(REo/RC)无明显变化,在t=0 时单位反应中心吸收的能量(ABS/RC)、在t=0 时单位反应中心耗散的能量(DIo/RC)、在t=0 时单位反应中心捕获的用于还原QA 的能量(TRo/RC)显著下降,分别为36.43%、58.67%、27.22%,表明JrAMT2 基因一定程度提高了核桃叶片反应中心活性和用于电子传递的能量份额,增强了电子传递能力(图9E);对单位受光截面比活性参数分析,结果显示:与野生型相比,3 个核桃JrAMT2 过表达株系在t=tFM(暗适应后达到最大荧光强度时间点)时的单位受光截面耗散的能量(DIo/CSm)无明显变化,在t=tFM时单位受光截面吸收的能量(ABS/CSm)、在t=tFM时单位受光截面捕获的用于还原QA 的能量(TRo/CSm)、在t=tFM时单位受光截面捕获的用于电子传递的能量(ETo/CSm)、在t=tFM时单位受光截面传递到电子链末端的能量(REo/CSm)上升,分别上升了 47.79%、69.39%、145.10%、303.62%(图9F),表明JrAMT2 基因一定程度提高核桃叶片单位受光截面的电子传递的份额及电子传递效率。综上所述,JrAMT2 基因过表达促进核桃的光合作用。
3 讨论
氮素作为植物生长发育必不可少的营养元素,是核酸、蛋白质、酶、叶绿素、植物激素等的重要组成部分[30]。自然界中可供利用的氮素资源有限,作物高产就需要化肥的投入。中国的化肥投入总量逐渐升高,但化肥利用率很低,给自然环境带来极大的负担[31-32],因此合理使用化肥,提高作物对氮素的吸收效率是促进农业生态化发展的重要途径。铵转运蛋白基因AMTs 是广泛存在于动物、植物、微生物中用于运输的载体蛋白,从分子层面提高植物对氮素的利用具有重要意义。前人研究发现:在拟南芥中,氮饥饿能诱导AtAMT1.1、AtAMT2.1 基因上调表达,并且AtAMT2 基因的表达水平随着氮饥饿时间的延长而增加[33-34]。在充足或高氮条件下,观察到拟南芥中AtAMT2.1 及水稻根中OsAMT1.2 基因表达水平仍上调[35-36],其中氮素形态对AMT 基因转录水平的调控也取决于AMT 基因个体和植物物种。
本研究对核桃JrAMT2 过表达植株进行初步的功能验证,对JrAMT2 基因进行生物信息学分析表明:JrAMT2 蛋白中含有29 个酸性氨基酸残基(Asp+Glu)和29 个碱性氨基酸残基(Arg+Lys)。该蛋白N 端在膜外,C 端存在膜内,共含有11 个跨膜螺旋结构域,与李畅[36]预测的OsAMT2.1 蛋白结构域特点相同,且与夏金泽等[37]研究的木薯ManihotesculentaMeAMT2.6 基因的蛋白结构相似。AMT2 型蛋白通常在植物的各种组织中表达,包括根、芽和叶。前人研究发现:杜梨PyrusbetulifoliaPbAMT2 基因在所有器官中均有表达,但在根部表达最高[38]。在拟南芥中发现:AtAMT2.1 基因主要在维管组织中表达,在芽中的表达高于根[15]。本研究对核桃JrAMT2 过表达植株进行绿色荧光观察发现:JrAMT2 蛋白在核桃苗整株均有表达,且在芽及根茎的维管束中荧光更明亮,说明与拟南芥相同,核桃JrAMT2 蛋白在所有器官中表达,且主要在维管组织中表达。
在植物生长发育重要阶段充足的氮素营养供给可以促进其生长发育,增加产量,对植物外施氮素能增加植株株高及叶面积[39]。本研究对核桃JrAMT2 过表达植株生长性状分析发现:JrAMT2 基因在核桃中过表达对植株生长发育有调控作用,主要表现在过表达植株株高、节间长显著增加。对过表达植株生根驯化结果显示:过表达植株生物量显著增加,根系发达。对核桃JrAMT2 过表达植株移栽驯化,定植后植株生长速率显著高于野生型,主要表现在节间伸长快,叶面积增加。AMT2 是具有铵吸收功能的铵转运蛋白,且在维管组织表达,暗示着该基因可能参与铵向木质部的装载,介导铵在植物中的长距离运输。研究发现:拟南芥AtAMT2.1 除了对根吸收氮素有一定贡献外,主要作用于从根部到茎部的运输[40]。本研究对核桃JrAMT2 过表达植株地上部分和地下部分基因表达测定发现:植株地下部分JrAMT2 基因表达量显著高于地上部分,且植株地下部分生物量的增加显著高于地下部分,说明核桃JrAMT2 基因主要在地下部分表达。对核桃JrAMT2 过表达植株对铵态氮和硝态氮吸收测定结果表明:核桃JrAMT2 过表达植株地上部分仅对铵态氮的吸收显著上调,地下部分对铵态氮与硝态氮的吸收均显著上调,说明JrAMT2 基因促进植株对铵态氮和硝态氮的吸收,并介导了铵态氮从地下部分到地上部分的运输。氮素营养还会通过影响叶绿素合成和叶绿素荧光参数的变化来参与光能的利用和调控[41]。有研究表明:水稻OsAMT2.1 基因敲除株系的光合特性与野生型相比出现下降趋势,同样说明了AMT2 基因对植物光合作用有调控作用[36]。本研究对核桃JrAMT2 过表达植株叶绿素质量分数及叶绿素荧光参数变化的测定结果显示:JrAMT2 基因显著提高了核桃的叶绿体表面积与单层细胞表面积比率、叶绿素质量分数及叶绿素荧光参数中叶片放氧复活体活性、量子产额、电子传递效率。
4 结论
JrAMT2 作为铵态氮转运基因,促进核桃对铵态氮和硝态氮的吸收,且介导铵态氮从根部到茎部的运输,对核桃生长发育、光合作用等有积极作用,对研究核桃高效利用氮素及良种的筛选有重要意义。

