临床病理特征结合SWE参数对乳腺癌腋窝淋巴结转移的预测价值
于鑫, 赵俊杰, 刘峰, 常红军
阜阳市肿瘤医院 1.超声科,2.乳腺肿瘤外科,安徽阜阳 236000
乳腺癌的发病部位为乳腺上皮细胞,因其亚型较多,故其症状、治疗方案及预后差异较大[1]。由于大部分乳腺淋巴液进入腋窝淋巴结,因此乳腺癌患者通常伴有腋窝淋巴结转移,从而导致患者复发及远程转移的风险增加,不利于预后和疾病恢复,因此治疗乳腺癌及判断其预后的关键因素为是否存在腋窝淋巴结转移[2]。研究表明,临床病理特征是腋窝淋巴结转移发生的关键因素[3]。剪切波弹性成像(shear wave elastic,SWE)可检测出常规超声无法检测到的病变,对于隐匿型病灶以及良、恶性肿瘤的辨别有较好的临床诊断效果[4]。本文分析临床病理特征联合SWE参数对乳腺癌腋窝淋巴结转移的预测价值,以期为早期防治腋窝淋巴结转移提供科学依据。
1 资料和方法
1.1 一般资料
选取2022年7月—2023年1月本院收治的72例女性乳腺癌患者,年龄22~75岁,平均(50.25±11.44)岁。全部患者均行SWE检查、同侧腋窝淋巴结清扫或前哨淋巴结活检。纳入标准:①患者均满足乳腺癌诊断标准[5];②术后病理证实腋窝淋巴结转移情况;③术前未进行系统治疗;④临床数据完整。排除标准:①合并其他恶性肿瘤;②双侧乳腺癌;③具有乳腺肿瘤既往史;④对超声造影剂过敏;⑤合并结核、淋巴瘤等疾病。本研究患者均签署知情同意书。根据病理检测结果,将发生腋窝淋巴结转移的患者33例纳入转移组,未发生转移的39例纳入未转移组。
1.2 资料收集
收集72例乳腺癌患者的临床及病理资料,包括年龄、绝经情况;病理指标包括分子分型、组织学分级、是否发生淋巴管血管侵犯(指肿瘤细胞侵犯淋巴管血管壁或弥漫于管腔内形成癌栓)、病灶微钙化情况以及孕激素受体(progesterone receptor,PR)、雌激素受体(estrogen receptor,ER)、Ki-67、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达水平。
1.3 临床病理特征分析
标本采用HE染色后,记录标本的病理分型、组织学分型等。采用免疫组化法(仪器为罗氏全自动免疫组化仪)检测ER、PR、HER2、Ki-67表达水平。ER、PR阳性为癌细胞核内可见棕褐色颗粒;HER2阳性为(+++)、可疑阳性为(++),阴性为(+)或(-)。Ki-67高表达为癌细胞核内可见棕褐色颗粒细胞占比>14%,低表达为≤14%[6]。
1.4 SWE检查
SWE检查仪器为Resona 7彩色多普勒超声诊断仪(迈瑞昆仑)。患者取仰卧位,外旋、外展患肢,腋窝充分暴露,经皮前哨淋巴结超声造影;随后行超声检查,观察病灶位置、声像图特征,记录淋巴结最大横径、淋巴结最大纵径、淋巴结皮质厚度;将L14-5WU探头轻放于受检病灶前哨淋巴结体表投影处,切换至SWE模式,在探头不施压的前提下嘱患者屏气数秒,获取取样框内颜色充填良好时的横切、纵切面弹性图像,在稳定且重复性高处冻结图像。SWE视觉模式分类选择Q-BOX trace手动不规则描记法测定弹性模量最大值(elastography maximum value,Emax)、弹性模量最小值(elastography minimum value,Emin)、弹性模量平均值(elastography mean value,Emean)以及弥散度(standard deviation,SD),图1为1例典型乳腺癌病例的SWE腋窝淋巴结图像。
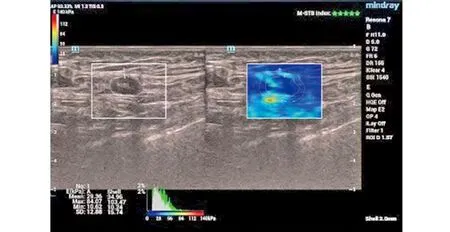
图1 典型乳腺癌病例的SWE腋窝淋巴结图像SWE图像显示患者淋巴结皮质增厚,淋巴门结构消失,弹性指数上升,硬度增加。
1.5 统计学处理
采用SPSS 23.0统计软件。计量资料采用t检验;计数资料采用χ2检验。采用多因素Logistic回归分析乳腺癌患者发生腋窝淋巴结转移的危险因素。ROC曲线评估临床病理特征联合SWE对腋窝淋巴结转移的预测效能。P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床病理特征和SWE参数的比较
两组患者组织学分级、淋巴管血管侵犯、病灶微钙化、Ki-67、淋巴结最大横径、淋巴结最大纵径、淋巴结皮质厚度、Emean、Emax及SD比较,差异有统计学意义(P<0.05;表1)。

表1 乳腺癌患者发生腋窝淋巴结转移的单因素分析
2.2 多因素Logistic回归分析结果
根据腋窝淋巴结转移情况为因变量,赋值1=转移,0=未转移。以表1中P<0.05的因素为自变量进行多因素Logistic回归分析。结果显示,Emax、SD、组织学分级(Ⅲ级)、淋巴管血管侵犯为乳腺癌患者腋窝淋巴结发生转移的危险因素(P<0.05;表2)。

表2 多因素Logistic回归分析
2.3 ROC预测效能
ROC结果显示,组织学分级为Ⅲ级、存在淋巴管血管侵犯、Emax≥45.635 kPa、SD≥8.450联合预测腋窝淋巴结转移的AUC高于各指标单独预测效能(表3)。

表3 ROC预测效能
3 讨 论
腋窝淋巴结是否转移是乳腺癌治疗及预后的关键指标之一,术前评估乳腺癌患者腋窝淋巴结转移状态,了解患者肿瘤发展情况,从而选择合适的手术方案,避免因过度淋巴结清扫而引起并发症,有利于患者身体恢复[1,7]。目前,超声影像学检查能够观测肿瘤及周围淋巴结的大小、形态以及血流情况,结合临床病理指标能够有效判断患者淋巴结状态[8]。SWE作为超声弹性成像的全新技术,常被用于乳腺、前列腺、甲状腺等疾病的临床诊断,但其与临床病理特征相结合用于乳腺癌患者腋窝淋巴结转移情况预测的相关研究较少。
本文结果显示,转移组与非转移组患者的组织学分级、淋巴结最大横径、血管淋巴管浸犯、Ki-67、淋巴结最大纵径、淋巴结皮质厚度、病灶微钙化、Emean、Emax及SD比较,差异有显著性。多因素Logistic回归分析显示,组织学分级(Ⅲ级)、淋巴管血管侵犯、Emax及SD为乳腺癌患者发生腋窝淋巴结转移的危险因素。分析原因可能如下:乳腺癌患者的组织学分级与病灶转移密切相关,组织学分级高的乳腺癌患者的淋巴结转移率、死亡率及复发率均明显高于分级低的患者。国外研究则指出,组织学分级越高的肿瘤患者病情越严重,病灶转移率亦越高[9]。陈洁文等[10]研究表明,组织学分级是浸润性乳腺癌发生腋窝淋巴转移的独立危险因素,与本研究结论一致。由于淋巴结转移患者的肿瘤周边血管浸润程度更高,从而更易发生淋巴血管侵犯,而新生淋巴管血管侵犯与腋窝淋巴结转移相关。Wang等[11]研究结果显示,淋巴管血管侵犯患者的占比在腋窝淋巴结转移患者中较高,多因素Logistic分析结果显示,淋巴管血管侵犯是患者发生腋窝淋巴结转移的独立危险因素,与本文结论一致。同时,由于肿瘤生长过程中会诱使炎症因子过度表达,导致间质成分增加,组织质地逐步变硬,与正常乳腺组织及脂肪组织有明显硬度差异。腋窝淋巴结转移患者的腋窝淋巴结边缘在SWE图像上观察到有明显特征性的局部彩色局域呈硬环状[12]。而SWE参数中的Emean、Emax、SD能反映淋巴结硬度及异质程度,Emean、Emax、SD值越高代表淋巴结硬度及异质程度越高[13]。陈佳等[14]研究发现,腋窝淋巴结转移组患者Emax、Emean明显高于未转移组,而本研究亦得到相同结论。
本文ROC曲线结果显示,组织学分级为Ⅲ级、存在淋巴管血管侵犯、Emax≥45.635 kPa、SD≥8.450的联合预测效能高于各指标单独预测效能。
综上所述,临床病理特征联合SWE参数对乳腺癌腋窝淋巴结转移具有一定预测价值,值得在临床中推广应用。

