绿茶天然果胶的酶法提取及其组成、结构与性质
罗 钰,刘咏雪,付杨楠,张 晨,*
(1 福州大学生物科学与工程学院 福州350108 2 福州大学先进制造学院 福建泉州362251 3 福建省食品生物技术创新工程技术研究中心 福州 350108)
茶饮料是目前市场上最受欢迎的饮品之一,在我国有悠久的历史[1]。当前茶叶品质的研究主要集中在茶风味物质的组成和氧化上[2-3],然而这些风味物质及其氧化衍生物从叶组织溶出的过程对茶汤品质的影响却被忽略[4]。该溶出过程受到茶叶细胞壁的阻碍,可能会因其中果胶的作用而影响各种物质的溶出速率[5],进而影响茶汤品质。因茶汤泡制过程中,风味物质的变化无法从果胶对其溶出的影响而得出,可通过提取获得的天然果胶与纤维素膜结合,模拟茶叶细胞壁结构,以分析茶风味物质溶出过程[6]。因此,建立新型的果胶提取方法,获得结构相对完整的天然果胶,是研究果胶对茶风味物质溶出影响的关键。
果胶是一种从高等植物细胞壁中提取获得的结构复杂的酸性杂多糖[7]。若在提取过程中果胶结构不被破坏,且其性质仍被保留,则为天然果胶。当前,果胶的提取方法主要有水热法、酸法及碱法[8],然而,这些方法均对果胶分子结构有影响,无法用于模拟叶细胞壁。水热法主要以高温的方式来增加细胞间质中果胶分子在水中的溶解度[9],其果胶提取率较低(30%~40%),且果胶分子容易发生断裂[10]。酸法提取是利用稀酸将非水溶性的果胶转变成水溶性的果胶[11],提取率约为70%[12]。酸处理过程中半乳糖醛酸主链易发生断裂,且果胶分子连接了纤维素片段,凝胶性相对较差[13]。碱法提取是通过将果胶酸中和以提高果胶溶解率,提取率可达90%[14]。此法提取过程中果胶脱酯[15],果胶与蛋白质形成的复合物提高了果胶的流变性[13]。
理论上,天然果胶的提取可通过使用碳水化合物酶降解细胞壁成分中的纤维素和半纤维素[16-17],以促进果胶的释放。然而,目前可行的碳水化合物酶提取方案尚未清晰。其原因:一是植物细胞壁结构复杂,酶分子不易进入且需要使用多种靶向的碳水化合物酶进行复合降解,果胶提取效率较低。二是市售纤维素酶和半纤维素酶复合酶可能会降解果胶,对果胶结构产生破坏。为了获得天然果胶,本研究以绿茶为材料,分析4 种商业酶(S22178 酶、半纤维素酶、ViscozymeⓇL 和FoodProⓇCBL)对果胶提取、结构和功能的影响。测定提取液中半乳糖醛酸含量,分析提取率。采用凝胶色谱分析其分子质量分布。以标准果胶(商业柑橘果胶和阿拉伯半乳聚糖)为模型,检测4 种酶对果胶HG 主链结构和RG-I 侧链结构的降解作用。采用红外吸收光谱分析果胶链中酯化羧基含量的变化。通过乙醇沉降对果胶提取物进行纯化,分析纯化样的外观,以及化学成分、分子质量分布、粒径与黏度的关系。
1 材料与方法
1.1 材料与试剂
绿茶叶(Green tea leaf,GTL)由中国福建省工泰公司提供。ViscozymeⓇL(主要含有纤维素酶,酶活力120 U/mL),美国Sigma 公司;FoodProⓇCBL(主要含有纤维素酶,酶活力1 500 U/g),中国上海杜邦公司;S22178 酶(主要含有纤维素酶,酶活力10 000 U/g),上海玉博生物科技有限公司;半纤维素酶(酶活力为20 000 U/g)、阿拉伯半乳聚糖(RG-I 结构),上海源叶生物科技有限公司;商业柑橘果胶(HG 结构),甲氧基化度(76.68±0.35)%,德国CNW 试剂公司。所有化学品均为分析纯级。
1.2 主要仪器
Nicolet iS50 FT-IR 傅里叶红外光谱仪,武汉德盟科技有限公司;Thermo Fisher Scientific 3000高效液相色谱仪(配有示差折光检测器),中国赛默飞世尔科技有限公司;OMNI 粒径分析仪,美国Brookhaven 仪器公司;MCR302 安东帕旋转流变仪,上海安东帕商贸有限公司。
1.3 提取方法
1.3.1 果胶酶提取方案 将绿茶叶研磨成粉末,分别称取200 mg 绿茶粉,与4 mL 含不同酶的0.02 mol/L 乙酸-乙酸钠缓冲液(pH 4.5)进行充分混匀后,于恒温振荡器中30 ℃反应3 h。酶的添加量是:1)S22178 酶50,200,250,500,700 U;2)半纤维素酶4.5,45,90,135,300,600 U;3)FoodProⓇCBL 90,180,713,1 000,1 420 U;4)ViscozymeⓇL 0.24,0.6,1.8,3,6 U。将反应后的样品离心(4 000×g,20 min),收集上清液,测定半乳糖醛酸含量。
式中,A1——上清液中半乳糖醛酸含量(mg);A2——200 mg 绿茶粉中半乳糖醛酸含量(mg)。
1.3.2 酶对果胶HG 主链和RG-I 侧链的影响 以商业柑橘果胶和阿拉伯半乳聚糖分别作为果胶HG 主链结构和RG-I 侧链结构的标准模型。分别将100 mg 商业柑橘果胶和阿拉伯半乳聚糖与2 mL 0.02 mol/L 乙酸-乙酸钠缓冲液(pH 4.45)混合,在该混合液中加入不同量的酶,充分混匀后在恒温振荡器中30 ℃反应3 h。酶的添加量是:1)600 U S22178 酶;2)1 200 U FoodProⓇCBL;3)0.25 U ViscozymeⓇL;4)500 U 半纤维素酶。将反应后的样品离心(4 000×g,20 min),收集上清液后冻干,于干燥皿中保存,待用。
1.3.3 乙醇沉降纯化酶果胶提取物 根据1.3.1节提取方案,将10 g 绿茶粉分别与含10 000 U S22178 酶、4 500 U FoodProⓇCBL、15 U ViscozymeⓇL 或4 500 U 半纤维素酶的缓冲液混匀。在恒温振荡器中30 ℃反应3 h 后,离心(4 000×g,20 min),收集上清液。加入2 倍体积的无水乙醇,沉淀,离心(4 000×g,15 min),收集沉淀物。加入1倍体积的去离子水,重复乙醇沉淀步骤2 次,使用去离子水充分溶解果胶沉淀。将果胶纯化液冻干后置于干燥皿中拍照,记录样品的外观。
1.4 测定方法
1.4.1 半乳糖醛酸含量的测定 参考咔唑比色法测定溶液中半乳糖醛酸含量[18]。显色反应后,测定样品在530 nm 波长处的吸光值,并以0~200 mg/L的半乳糖醛酸为参照,计算半乳糖醛酸含量。若待测样品为固体,则采用酸降解法进行半乳糖醛酸含量的测定。将25 mg 绿茶粉溶解于0.5 mL 64%硫酸中,静置30 min 后加入5.5 mL 蒸馏水,将混合溶液置于80 ℃恒温振荡器中加热60 min,离心获得上清液,测定其半乳糖醛酸含量。
1.4.2 傅里叶红外光谱分析 果胶样品的特征吸收峰采用傅里叶红外光谱仪测定[19]。将1 mg 果胶样品和200 mg KBr 充分混合后,用玛瑙研钵和研杵均化混合物并压成薄片。在400~4 000 cm-1波数范围对果胶样品进行扫描,记录光谱图。采用Sun 等[20]和Liu 等[21]的方法,建立DE 值与A1742/(A1742+A1642)值之间的线性回归方程:Y=87.609X+25.768 来计算果胶的酯化度。式中,A1742——色谱图中1 742 cm-1处的峰面积;A1642——色谱图中1 642 cm-1处的峰面积。
1.4.3 分子质量分布的测定 果胶样品的分子质量分布采用高效液相色谱仪测定[22]。制备质量浓度为0.5 mg/mL 的果胶溶液,经0.22 μm 滤膜过滤,备用。使用赛默飞SEC 300 凝胶色谱柱,示差折光检测器对样品进行分析。选择流速0.25 mL/min,进样体积20 μL 和含有0.1 mol/L NaCl 的乙酸钠-乙酸缓冲液(pH 4.5)为流动相,在25 ℃下检测。
1.4.4 蛋白质含量的测定 以0~100 mg/L 硝酸钾溶液制作标准曲线,用总有机碳分析仪(TOC)测定果胶样品中总氮质量浓度(g/L)[23],采用转换因子5.4 来计算蛋白质浓度[14]。
1.4.5 中性糖含量的测定 果胶样品(20 mg)经4 mL 4 mol/L 三氟乙酸(120 ℃,4 h)水解后,加入0.5 mL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(PMP)(70 ℃,30 min)进行衍生化。衍生化后样品的中性糖含量采用高效液相色谱仪测定[13]。用于分析的柱子为Thermo C18 柱(4.6 mm×250 mm,孔径5 μm),洗脱液为0.1 mol/L 磷酸盐缓冲液(pH 7)∶乙腈=82∶18(V/V)。设置UV 检测器波长为245 nm,流速1.0 mL/min,进样体积10 μL,于25 ℃检测。
分别配制质量浓度为10 mg/mL L-(+)-鼠李糖、L-(+)-阿拉伯糖、D-(+)-木糖、D-(+)-甘露糖、D-(+)-半乳糖(97%)、D-(+)葡萄糖(99.5%)溶液为标准溶液。RG-I 型果胶由重复的半乳糖醛酸和鼠李糖二糖骨架和阿拉伯聚糖、半乳聚糖和/或阿拉伯半乳聚糖的侧链组成[24]。由于阿拉伯糖和半乳糖主要存在于RG-I 型果胶中,因此阿拉伯糖和半乳糖含量被用来代表RG-I 果胶[25]。RG-II 型果胶具有HG 型果胶的骨架,该骨架具有复杂的侧链,其包含连接至半乳糖醛酸的鼠李糖[26]。由于RG-II 型果胶中几乎不含半乳糖和阿拉伯糖,因此半乳糖和阿拉伯糖含量与鼠李糖含量的比率变化可用来表示RG-II 型果胶提取率的变化。
1.4.6 多酚含量的测定 果胶样品的多酚含量参考酒石酸亚铁法测定[27]。将250 μL 果胶溶液与315 μL 酒石酸亚铁溶液充分混合,加入1 mL pH 7.5 的磷酸盐缓冲液,于室温反应5 min。测定样品在540 nm 波长处的吸光值,以0~0.5 mg/mL 茶多酚绘制标准曲线,计算果胶样品中的多酚含量。
1.4.7 黏度的测定 果胶样品的黏度采用安东帕旋转流变仪测定[28]。将果胶样品与去离子水充分混合,25 ℃下测定混合溶液(50 g/L)在剪切速率1~100 rad/s 范围的黏度。记η1为剪切速率在1 s-1时的黏度。
1.4.8 粒径的测定 基于样品的多分散性和基线指数介于0.1~0.3 和5~10 之间,选择配制果胶质量浓度为1 mg/mL 的溶液。采用粒径分析仪(OMNI,Brookhaven,USA)测定其粒径分布[13]。
1.5 统计方法
采用Microsoft Excel 2016 软件进行数据的统计与分析。若无特别说明,每个样品重复测定3次,其结果表示为“平均值±标准差(x¯ ±s)”。采用单因素方差分析(One-way ANOVA)和Duncan's法多重比较分析各组的差异显著性,显著性水平为P<0.05。
2 结果与分析
2.1 4 种酶对果胶提取率的影响
绿茶粉分别经4 种酶处理后获得上清液,通过测定其半乳糖醛酸含量估算果胶提取率,结果如 图1 所 示。采 用S22178 酶、FoodProⓇCBL、ViscozymeⓇL 和半纤维素酶都能高效提取果胶,提取率均可达80%。4 种酶中,ViscozymeⓇL 辅助果胶提取的效果最佳,每mg 茶粉仅用0.003 U 酶即可获得97%的果胶,而其它酶达到这一条件需要的酶添加量均超过3 U/mg。这可能是由于ViscozymeⓇL 除了含有纤维素酶活力外,还含有阿拉伯聚糖酶和木聚糖酶等多种酶活力,可有效提高叶细胞壁的降解效率[14]。

图1 不同酶添加量下果胶的提取率Fig.1 Extraction rate of pectin under different enzyme addition amounts
2.2 4 种酶对果胶HG 主链和RG-I 侧链的影响
以商业柑橘果胶和阿拉伯半乳聚糖分别作为果胶HG 主链和RG-I 侧链的标准模型,通过分子排阻色谱分析4 种酶对果胶HG 主链和RG-I 侧链的影响,如图2 所示。图2a 显示,商业柑橘果胶仅有1 个组分,在SEC 试验中的保留时间约23 min。ViscozymeⓇL 处理后的商业柑橘果胶在色谱图中23 min 处的信号峰基本消失,可见ViscozymeⓇL 可完全降解果胶HG 主链。S22178 酶处理后的商业柑橘果胶在色谱图中23 min 处的信号峰变小,发生拖峰现象,表明S22178 酶对果胶HG 主链产生部分降解。相比之下,经半纤维素酶和FoodProⓇCBL 处理的商业柑橘果胶在色谱图23 min 处的信号峰基本没有变化,表明这两种酶对果胶HG 主链没有影响。图2b 显示,阿拉伯半乳聚糖只有1 个组分,在色谱图中的保留时间约38 min。经4 种酶作用后的RG-I 侧链在SEC 图谱中峰型相似,表明4 种酶对果胶的RG-I 侧链没有影响。
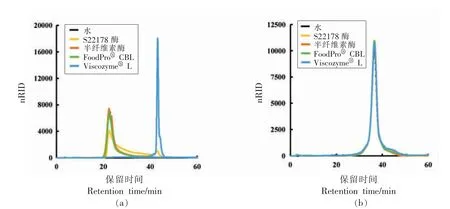
图2 经不同酶处理前、后商业柑橘果胶(a)和阿拉伯聚糖(b)的分子质量分布Fig.2 The molecular weight distribution of commercial citrus pectin(a)and arabinoxylan(b)before and after treatment with different enzyme concentrations
可见,半纤维酶或FoodProⓇCBL 处理获得的果胶结构与天然果胶结构相似,而其它两种酶均破坏果胶结构。
2.3 4 种酶对果胶酯化度的影响
为了进一步探究4 种酶对绿茶果胶酯化度的影响,测定果胶提取液的红外光谱图,结果如图3所示。果胶酯化度通过1 742 cm-1处的峰面积与1 742 cm-1和1 642 cm-1处的峰面积之和的比值来计算。S22178 酶处理样、FoodProⓇCBL 处理样和半纤维素酶处理样的酯化度相近,分别为40%,41%和44%,ViscozymeⓇL 的最低为31%。可见,S22178 酶、FoodProⓇCBL 和半纤维素酶对果胶的酯化度影响较小,ViscozymeⓇL 具有一定的脱酯作用。
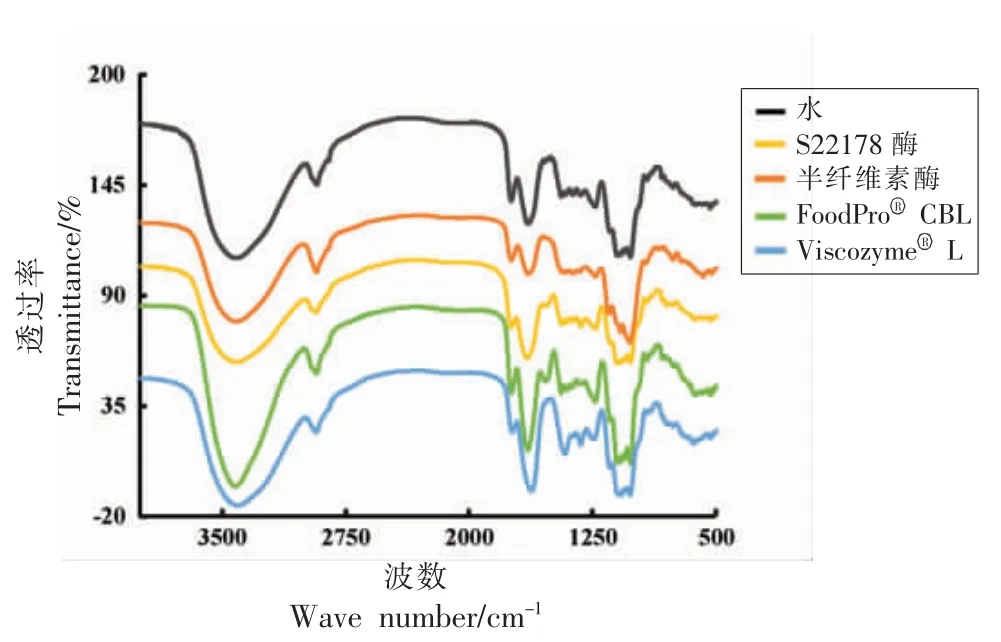
图3 4 种酶提取的绿茶果胶的傅里叶红外光谱Fig.3 Fourier transform infrared spectroscopy of green tea pectin extracted by four enzymes
2.4 4 种酶对果胶纯化样的影响
2.4.1 外观 将绿茶果胶提取物用乙醇沉降进行纯化,其冻干样品的外观如图4 所示。由于ViscozymeⓇL 破坏了果胶分子结构(见图2a),因此果胶样品中小分子物质居多,冻干品呈粉末状。其它3 种酶对HG 果胶仅存在部分降解或无明显降解作用,使获得的果胶样品中存在更多的大分子物质呈云片状。与未经酶处理和半纤维素酶处理相比,S22178 酶、FoodProⓇCBL 和ViscozymeⓇL纯化样颜色较浅,推测叶绿素与纤维素之间发生了结合[29]。叶绿素可通过纤维素降解,溶于乙醇溶液后去除。
2.4.2 黏度 纯化后果胶样品的黏度采用安东帕旋转流变仪检测,结果如图5 所示。4 种酶法纯化样的黏度随角频率的增加呈现剪切稀化的现象。比较剪切速率为1 时,各果胶样品的黏度(η1)差异,FoodProⓇCBL 纯化样的黏度最大(η1=1 227 mPa·s),S22178 酶纯化样的黏度次之(η1=862 mPa·s),而半纤维素酶纯化样的黏度较低(η1=154 mPa·s),ViscozymeⓇL 黏度基本为0。4 种酶处理的纯化样黏度存在较大差异,这或许与纯化样的分子质量分布、化学组成及其粒径分布相关。
2.4.3 化学组成 测定了纯化后绿茶果胶样品的化学组成(包括半乳糖醛酸、蛋白质、多酚和各种单糖含量),结果见表1。以半乳糖醛酸、半乳糖、阿拉伯糖和鼠李糖含量表示各种类型果胶的总量,ViscozymeⓇL 纯化样中果胶含量最高,其次为S22178 酶纯化样和半纤维素酶纯化样,而Food-ProⓇCBL 纯化样和水纯化样中果胶含量相对较少。水纯化样和S22178 酶纯化样中GA/Rha 的值较大,约为20。可见其主要为果胶的HG 结构。ViscozymeⓇL 纯化样、半纤维素酶纯化样和FoodProⓇCBL 纯 化样的GA/Rha 和(Ara+Gal)/Rha 值较小,表明其果胶提取物中含有更多其它的果胶结构。在保证HG 果胶提取率的情况下,获得更多RG-I 和RG-II 结构的果胶,以更接近天然果胶的状态。果胶RG-II 结构在细胞壁中的空间位置更靠近内侧的细胞膜,而RG-I 充斥于整个细胞壁[30],相对而言RG-II 结构的提取难度较大。可见,纯化样中更多RG-II 侧链的存在表明其果胶提取物结构更接近细胞壁中的天然果胶。果胶的溶出与纤维素和半纤维素的降解相关[31],而各样品中葡萄糖和木糖的含量变化并未表明其相关性。这一现象可能是由于纤维素和半纤维素在不同酶处理条件下被降解的程度不同,从而导致它们在乙醇沉降过程中的损失不同。水纯化样、S22178 酶纯化样、FoodProⓇCBL 纯化样和半纤维素酶纯化样中蛋白质含量相差不大,而ViscozymeⓇL 纯化样中的蛋白质含量相对较少。这可能是ViscozymeⓇL 酶还具有一定的蛋白酶活性,可降解蛋白质,导致它们在乙醇沉降过程中的损失较大。
理论上果胶HG 主链含量与黏度呈正相关,然而S22178 酶纯化样的黏度低于FoodProⓇCBL纯化样的黏度,可见果胶的非HG 型主链结构也能提供部分的黏性特质[2,29]。
2.4.4 分子质量分布与粒径分布 纯化后果胶样品的分子质量分布用高效液相色谱仪测定,粒径分布用粒径分析仪检测,结果如图6 所示。图6a表明,S22178 酶纯化样和FoodProⓇCBL 纯化样在SEC 图谱中的分子质量分布与水处理的纯化样的分子质量分布相似,在20~25 min 内出现较多的大分子物质。ViscozymeⓇL 纯化样和半纤维素酶纯化样中含有的大分子物质较少,小分子物质较多。由于半纤维素酶可降解非果胶和纤维素等多糖类物质,这些物质可能在乙醇沉降的过程中没有被去除[32],导致其在35~44 min 内的小分子峰明显增强。ViscozymeⓇL 可彻底破坏HG 果胶主链,因此其果胶样在色谱图中20~25 min 内的大分子峰基本消失,在35~44 min 内小分子峰的信号增强。相比之下,FoodProⓇCBL 纯化样只在20~25 min 内出现1 个主峰,说明此果胶样品的分子质量较大,且组分间的分子质量差异较小。可见,分子质量大且分布较为集中的果胶样品具有更好的黏性[33](见图5)。
纯化后果胶样品的粒径用粒度仪测定,结果如图6b 所示。半纤维酶纯化样的平均粒径最大,S22178 酶纯化样和FoodProⓇCBL 纯化样平均粒径接近,而ViscozymeⓇL 纯化样的平均粒径最小。相比于其它纯化样,FoodProⓇCBL 纯化样在光散图中只有1 个峰呈正态分布,出现在100~1 000 nm 范围,表明样品的组分间颗粒大小相近。其它3 种酶纯化样均呈现2 个不同的信号峰,其中主峰出现在200~1 000 nm 范围,次峰出现在40~200 nm 范围。ViscozymeⓇL 纯化样粒径较小,主要出现在200 nm 附近。由于半纤维素酶纯化样中的纤维素未降解且与果胶结合形成较大的颗粒,因此即使半纤维素酶纯化样和FoodProⓇCBL纯化样成分接近,其黏度仍存在较大差异(见图5)[14]。
可见,由于FoodProⓇCBL 纯化样的结构与天然果胶相似且具有较好的黏性,因此将其浸泡于纤维素膜中,可制作出与叶细胞壁结构相近的体外模型[6,34]。此外,还可将其作为增稠剂应用于食品行业。
3 结论
S22178 酶、半 纤维素 酶、FoodProⓇCBL 和ViscozymeⓇL 都能高效提取果胶,提取率均能达80%。S22178 酶和ViscozymeⓇL 对果胶HG 主链有破坏,且其几乎完全被ViscozymeⓇL 降解。半纤维素酶和FoodProⓇCBL 对果胶HG 主链和RG-I 侧链均无显著影响。经纯化后,FoodProⓇCBL 纯化样的黏度最大(η1=1 227 mPa·s),半纤维素酶纯化样的黏度较低(η1=154 mPa·s),ViscozymeⓇL 黏度基本为0。FoodProⓇCBL 纯化样中果胶含量为48%(HG 主链43%,RG-I 侧链5%),且相比于半纤维素酶纯化样,FoodProⓇCBL纯化样中果胶结构更丰富,组分间颗粒大小相近,呈现典型的剪切稀化现象,最接近天然果胶的状态,可用于模拟茶叶细胞壁,研究果胶对风味物质溶出的影响。

