荧光免疫层析技术原理及其在病原微生物检测中的研究进展
苏华彬,刘蒙达,南文龙,孙明军,焉 鑫,毛迎雪,4,曲 瑶,4,孙淑芳,李桂梅,樊晓旭
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.青岛农业大学动物医学院,山东青岛 266109;3.农业农村部反刍动物重大疫病防控重点实验室(东部),山东青岛 266032;4.山东农业大学动物科技学院,山东泰安 271000)
免疫层析技术是20世纪末发展起来的一种检测方法,其结合了免疫技术和色谱层析技术,具有操作简单、反应快速等特点,已被用于临床诊断、环境监测、食品安全等多个重要领域[1]。传统免疫层析技术以胶体金为标记物,通过条带显色对目标物进行定性检测或半定量分析,其虽然简单快速,但灵敏度较差,难以做到准确定量[1]。荧光免疫层析技术作为一项新型免疫学检测技术,既保留了传统胶体金试纸条的检测速度快、价格便宜、操作简单、携带方便等优点,又通过荧光技术提高了检测的灵敏度[2]。荧光免疫层析技术以荧光微球为标记物。荧光微球是一种亮度适中、吸光度高、稳定性好的示踪标记物[3],可用于各种生物分析物的检测[4],检测抗原时不受外界因素影响,光学稳定性好[5]。微球与抗体或抗原的结合不影响后续的抗原抗体结合反应。在检测过程中,荧光免疫层析技术受到的环境因素影响和样品中的溶剂影响较小,检测荧光微球信号连续且稳定[5]。本文从荧光免疫层析技术的原理以及在病原微生物快速检测中的应用方面作综述,以期为后续相关研究提供参考。
1 技术原理
1.1 荧光微球制备原理
根据制备方法不同,可将荧光微球分为三类:第一类是将荧光材料包封于微球内,第二类是将荧光材料修饰在微球表面,第三类是在原位合成微球过程中嵌入荧光材料。
1.1.1 荧光材料包封于微球内 纳米颗粒被封装在微球核中或其内壁。该方法是基于溶胀原理,将荧光纳米颗粒分散在有机溶胀溶剂中[6]。溶剂通过孔的渗透导致微球溶胀,使纳米颗粒扩散进入溶胀的微球内部;在通过极性溶剂进行溶剂交换时,微球收缩将纳米颗粒包封在内部[4]。该方法制造荧光微球的过程较为简单,成本较低,但无法在渗透过程中人为控制纳米颗粒,可能导致因丢失颗粒而引起荧光强度降低[4]。另外,纳米颗粒封装后存在泄漏的可能,会造成检测失准[4]。
1.1.2 荧光材料修饰于微球表面 纳米颗粒在微球表面逐层修饰,其中单层或多层带电荧光纳米颗粒与带相反电荷的聚电解质交替沉积。用聚电解质交替沉积形成的聚合物层修饰荧光微球,使荧光微球表面具备捕获探针的能力[7]。该方法灵敏度高、稳定性强,但制造工艺复杂[7]。在制造过程中,每一个纳米粒子和聚电解质沉积步骤的洗涤过程费时费力,并且修饰后的纳米粒子由于水溶性差而荧光强度降低[7]。用该方法制作的微球性能较佳,对试验有较高要求时可选该方法。
1.1.3 原位合成微球过程中嵌入荧光材料 原位合成微球嵌入荧光材料的过程中,根据对纳米粒子的修饰与否,可分为两种方法:聚合法和乳化-溶剂蒸发法。在聚合方法中,用可聚合的配体对纳米粒子进行表面修饰,并与微球前体混合形成乳液液滴[8]。该液滴通过自由基或光聚合方式进行聚合,聚合后从溶液中沉淀出难溶的纳米颗粒微球,然后收集并使用[8]。与聚合方法相比,乳化-溶剂蒸发法不需要对纳米粒子进行化学修饰,聚合物前体可直接与纳米粒子在含有表面活性剂的溶液中混合[9]。在搅拌或超声波分散混合物时,混匀后的溶液形成乳状液滴[9]。当溶剂蒸发时,凝固的微球产生,此时微球内已嵌入纳米颗粒[9]。量子点嵌入的亚微米级荧光珠浸泡于水溶剂中时,可保留荧光长达数月[9]。以上两种方法通过改变前体浓度和混合速度,可以调节常规聚合和乳化方法制备的荧光微球粒径[9]。然而,用该方法得到的微球多呈分散形式,影响后续生物标志的测定效率和可靠性[9]。需要制作不同粒径大小微球时可以选该方法。
1.2 免疫层析技术检测原理
将特异性抗原或抗体及二抗与制备好的荧光微球混合后,将混合液分别固定在硝酸纤维素膜(NC 膜)上,在NC 膜上制成质控线(C 线)和检测线(T 线)[10]。步骤1,加样孔中滴加样品:将样品溶液滴加到加样孔中,通过毛细管虹吸作用,使样品溶液从加样孔流向另一端[10]。步骤2,抗原与标记抗体形成免疫复合物:在检测过程中,样品首先与免疫标记物相互作用,之后反应溶液流向NC 膜;阳性样品会与NC 膜上T 线包被的抗原或者抗体特异性结合,形成特异性结合物,而后结合物会被T 线固定;阴性样品则不会发生特异性结合[10]。步骤3,复合物经NC 膜与捕获抗体发生反应:无论样品为阳性还是阴性,反应溶液会因毛细管作用流经C 线而与C 线包被的二抗发生特异性结合;在紫外光照射下,若C 线和T 线均出现条带,则检测结果为阳性;如果只有C 线出现条带,则检测结果为阴性;如果只有T 线有条带,则检测结果无效[11]。荧光免疫层析检测原理见图1。同时也可将试纸条放入相应仪器进行定量分析[12]。
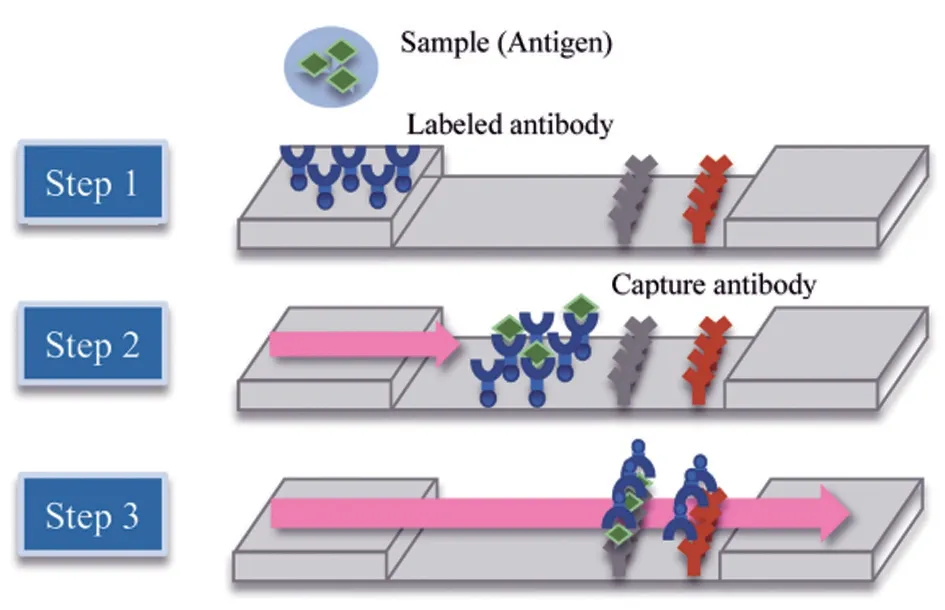
图1 荧光免疫层析检测原理[11]
2 检测应用
以PubMed(NLM) 数据库为例, 以“Fluorescence immunochromatography diagnosis”进行检索,规定时间为2018—2023年,检索到应用荧光免疫层析技术检测病原微生物相关文献共43 篇,研究病原涉及病毒、细菌、寄生虫等,其中病毒26 篇、细菌12 篇、寄生虫5 篇。本文从中挑选最具代表性的研究文献进行简述,以说明荧光微球检测技术在病原检测领域的巨大潜力。
2.1 病毒检测
Cameron 等[13]建立了一种基于荧光微球的新型冠状病毒检测方法,其检测3 个主要抗原——刺突蛋白、刺突ACE2 受体结合域蛋白和核衣壳蛋白。根据核衣壳蛋白比刺突蛋白更保守的特性,Li等[14]以新型冠状病毒核衣壳蛋白为抗原建立了荧光免疫层析检测方法,其C 线包被的核衣壳蛋白能与特异性抗体结合,之后被T 线包被的葡萄球菌蛋白A 捕获并显示荧光;通过对偶联和检测条件进行优化,确定检测限为97.65 ng/mL,IgG 质量浓度为48.84 ng/mL,同时对其他种类冠状病毒和呼吸道相关病毒(n= 5)显示了良好的特异性。Mao 等[8]以荧光微球为载体,研制了新型冠状病毒核衣壳蛋白检测试纸条,其灵敏度非常高,检测限可达0.01 ng/mL,在大规模人群筛查中具有较大的应用前景[8]。Zhang 等[15]基于逆转录和等温扩增方法检测新型冠状病毒刺突蛋白编码基因片段,将特异性探针结合CRISPR/Cas13a 反应,使用荧光微球免疫层析条读取扩增结果,可在1 h 内完成检测。Wang 等[16]建立了一种应用快速荧光微球免疫层析试纸条定量检测禽白血病病毒的方法,其将禽白血病病毒核衣壳蛋白特异性单克隆抗体偶联标记荧光微球,制备用于样本检测的T 线,显示最低检出限为1 ng/mL。Ji 等[17]将两种伪狂犬病病毒重组蛋白(GE 和GB)偶联到磁性微球上,建立了两种单荧光微球免疫分析方法。与ELISA 相比,GE 蛋白荧光微球免疫层析试纸条的特异性和敏感性符合率分别为99.26%和92.3%,GB 蛋白荧光微球免疫层析试纸条的分别为95.74%和96.3%,2 种方法结合可快速、灵敏、特异性检测伪狂犬病病毒。
2.2 细菌检测
Chen 等[18]通过引入磁珠纯化、生物素-链霉亲和素体系和荧光微球技术,建立了一种快速、敏感性强、特异性好的福氏志贺菌荧光微球检测方法,其最低检出限为2 ng/mL,与荧光定量PCR 的检出限大致相同。Kong 等[19]建立了一种基于荧光微球的,快速、准确、简便、灵敏的动物布鲁氏菌感染抗体检测方法,其将荧光微球与布鲁氏菌Omp22外膜蛋白共价偶联,将外膜蛋白Omp28 和Omp22的单克隆抗体分别喷涂到NC膜上作为T线和C线,通过检测线与对照线的荧光信号比值确定阴阳性临界阈值为0.049 2,检出限达1.05 ng/mL。Liu 等[23]研制了一种基于荧光微球的简单、快速的手持侧向流免疫层析检测系统,其灵敏度为0.03 ng/mL,可用于降钙素原检测,为非典型细菌性脑膜炎的脑脊液检查与病毒性脑炎的鉴别提供了指示参考。
2.3 寄生虫检测
Tachibana 等[25]证明溶组织内半乳糖胺抑制凝集素是阿米巴病血清诊断的有效抗原,使用荧光微球包被半乳糖胺抑制凝集素于标记物垫,用半乳糖胺抑制凝集素包被T 线,形成自夹心荧光微球试纸条,使用手持式读取器测量荧光强度,其半乳糖胺抑制凝集素特异性抗体的最小量为100 pg,血清样本工作量为20 µL,反应总耗时为30 min。Xu等[26]为对家畜旋毛虫进行特异性、定量和现场筛查,采用竞争夹心方式建立了基于荧光微球的免疫层析分析方法,其具有良好的线性范围,检测限为189.92 ng/mL,检出率为100%,高于市售ELISA试剂盒(90%),在不同感染剂量模型中检测的血清学阳性率(100%)均一致。
3 前景展望
荧光免疫层析方法操作简单、耗时短,无需昂贵的设备及相关的专业培训,在检测灵敏度和特异性上与ELISA 和PCR 大致相同,且不用担心气溶胶污染问题。该方法配合荧光读数仪在条件有限的实验室和野外可以进行定性与半定量分析。但是荧光免疫层析基于免疫分析的原理,依赖于特异性抗体的高效结合来识别或捕获相应的分析物,而在复杂的实际样品中,某些血清蛋白会引起与抗体蛋白的交叉反应,导致其灵敏度和特异性降低。因此,有必要开发分子印迹聚合物、分子配体或适配体等来替代传统的捕获探针。近些年,荧光微球读数仪更加轻巧且携带方便,可以对荧光微球免疫层析试纸条进行定性与半定量分析,希望随着技术发展可以解决无法准确定量的问题,使其在条件有限的实验室和野外也可以进行准确分析。
荧光免疫层析技术除了可用于疾病早期的病原检测,还可用于癌症筛查以及药物残留、有害物质残留等检测,目前已有成熟的商品试剂盒,如猪瘟抗体定量检测试剂盒、三聚氰胺定量检测试剂盒、呋喃妥因代谢物定量检测试剂盒等。相信未来随着新兴交叉融合技术的发展,荧光免疫层析技术将在更多领域发挥更大作用。

